Содержание
- 2. Очень древний я металл, Счет столетьям потерял; Наблюдатель египтянин имя дал «небесный камень» Был нескромным я
- 3. Основа всего мира.
- 4. «Железо не только основа всего мира, самый главный металл окружающей нас природы, оно – основа культуры
- 5. Железо в периодической системе Д.И. Менделеева. Порядковый номер Период Группа Подгруппа Электронное строение атома Атомная масса
- 6. Русское название элемента № 26 связано с корнем «жель», означающим «блестеть», «пылать». В земной коре содержится
- 7. Физические свойства железа: Цвет Блеск Пластичность Магнитные свойства Температура плавления Твердость Серебристо-белый Блестящий Очень пластичный, легко
- 8. Взаимодействие железа с концентрированными кислотами Безводная серная и азотная кислоты не реагируют с ним. Однако концентрированные
- 9. 3. Качественные реакции на ионы железа Качественная реакция на ион железа (II) – реакция с красной
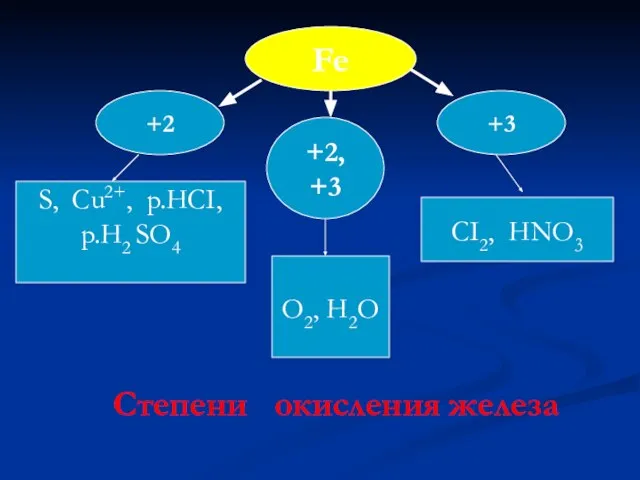
- 10. Fe +3 +2 +2, +3 O2, H2O CI2, HNO3 S, Cu2+, p.HCI, p.H2 SO4 Степени окисления
- 11. Природные соединения железа FeS2 Пирит (железный или серный колчедан) FeCO3 Сидерит Fe2O3*3H2O Лимонит (бурый железняк) Fe3O4
- 12. Нахождение в природе. В свободном виде в метеоритах В живых организмах В воде минеральных источников содержится
- 13. Железо, как элемент жизнедеятельности организма. «Что не излечивают лекарства, то излечивает железо, что не излечивает железо,
- 14. Входя в состав гемоглобина, железо обуславливает красный цвет этого вещества, от которого, в свою очередь, зависит
- 15. Добыча железа. Железная руда превращается в железо в доменных печах. Печь загружается сверху смесью железной руды,
- 16. Применение. В настоящее время железо – это основа современной техники, машиностроения, транспорта. Предметы изготовленные из железа:
- 17. Опорный конспект «Железо»
- 19. Скачать презентацию















 Новый менеджер в сформировавшейся команде – методы безболезненного внедрения Вершинина Екатерина
Новый менеджер в сформировавшейся команде – методы безболезненного внедрения Вершинина Екатерина SPE Outstanding Student Chapter and Gold Award Criteria
SPE Outstanding Student Chapter and Gold Award Criteria Предлог
Предлог Презентация на тему Физминутка для глаз
Презентация на тему Физминутка для глаз  Теплота згоряння палива. Розрахунок кількості теплоти внаслідок згоряння палива
Теплота згоряння палива. Розрахунок кількості теплоти внаслідок згоряння палива Вакцины от ВПЧ. Конкурентная борьба и стратегия работы врача женской консультации.Нужна ли нам государственная программа вакцина
Вакцины от ВПЧ. Конкурентная борьба и стратегия работы врача женской консультации.Нужна ли нам государственная программа вакцина Египетские пирамиды в Гизе
Египетские пирамиды в Гизе О дисциплинах цикла ГСЭ
О дисциплинах цикла ГСЭ Проект для сотрудников (шаблон)
Проект для сотрудников (шаблон) «Работа учреждения в рамках реализации закона 83-ФЗ»
«Работа учреждения в рамках реализации закона 83-ФЗ» Карикатурный портрет
Карикатурный портрет Am, is or are
Am, is or are ДОКЛАД: М.М. ТУЛЯГАНОВОЙ ОСОБЕННОСТИ НЕФОРМАЛЬНОЙ ЭКОНОМИКИ В РЕСПУБЛИКЕ УЗБЕКИСТАН
ДОКЛАД: М.М. ТУЛЯГАНОВОЙ ОСОБЕННОСТИ НЕФОРМАЛЬНОЙ ЭКОНОМИКИ В РЕСПУБЛИКЕ УЗБЕКИСТАН Кленовый лист, кленовый лист, ты мне среди зимы приснись
Кленовый лист, кленовый лист, ты мне среди зимы приснись Путешествия в сказку
Путешествия в сказку Визитная карточка школы
Визитная карточка школы ОПЕРАТИВНАЯ ПОЛИГРАФИЯ
ОПЕРАТИВНАЯ ПОЛИГРАФИЯ Учебный проектОсновные темы рассказа А.И. Куприна «Белый пудель»
Учебный проектОсновные темы рассказа А.И. Куприна «Белый пудель» London. Sightseeing of London
London. Sightseeing of London Документы и сведения, представляемые таможенным органам при прибытии на таможенную территорию Подготовили: студентки 3-го курса
Документы и сведения, представляемые таможенным органам при прибытии на таможенную территорию Подготовили: студентки 3-го курса  Логічні одиниці інформаціи
Логічні одиниці інформаціи Основы ЭКГ
Основы ЭКГ Английская монархия от завоевания до парламента
Английская монархия от завоевания до парламента Налоги. Объект налогообложения
Налоги. Объект налогообложения Освещение. Свет и тень. Правила распределения светотени в натюрморте
Освещение. Свет и тень. Правила распределения светотени в натюрморте Презентация "Художественный образ в произведениях музыки и изобразительного искусства" - скачать презентации по МХК
Презентация "Художественный образ в произведениях музыки и изобразительного искусства" - скачать презентации по МХК Учитель начальных классов высшей категории МОУ «СОШ №6» г. Бузулука Оренбургской области
Учитель начальных классов высшей категории МОУ «СОШ №6» г. Бузулука Оренбургской области Организация и планирование закупок. Тема 2
Организация и планирование закупок. Тема 2