Содержание
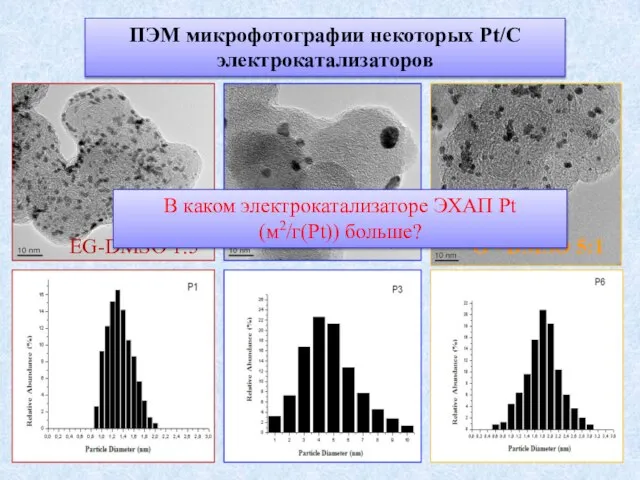
- 2. ПЭМ микрофотографии некоторых Pt/C электрокатализаторов EG-DMSO 1:5 G-Et 1:5 G - DMSO 5:1 В каком электрокатализаторе
- 3. Способы определения истинной площади поверхности Адсорбционные Электрохимические HUPD, CuUPD, COad Основанные на использовании структурных методов исследования
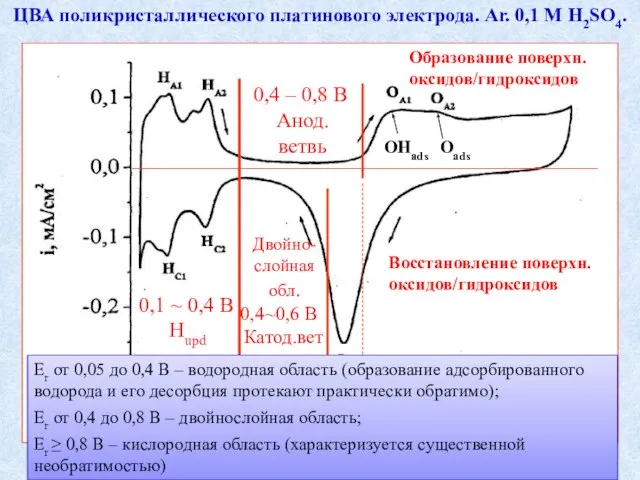
- 4. ЦВА поликристаллического платинового электрода. Ar. 0,1 М H2SO4. Дисс. к.х.н. Шерстюк О.В., Новосибирск Еr от 0,05
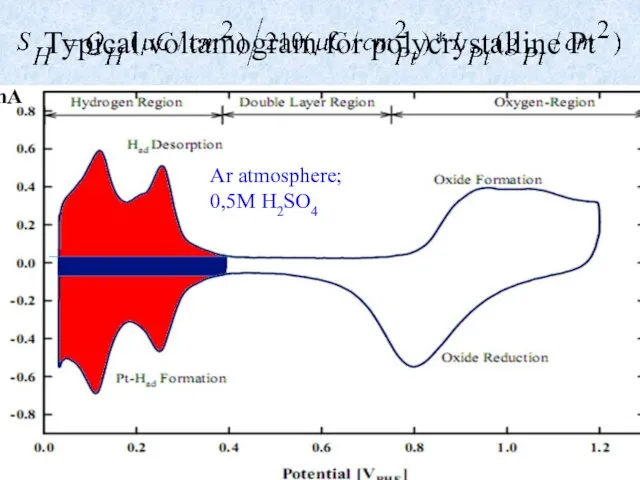
- 5. Typical voltamogram for polycrystalline Pt I,mA Ar atmosphere; 0,5M H2SO4
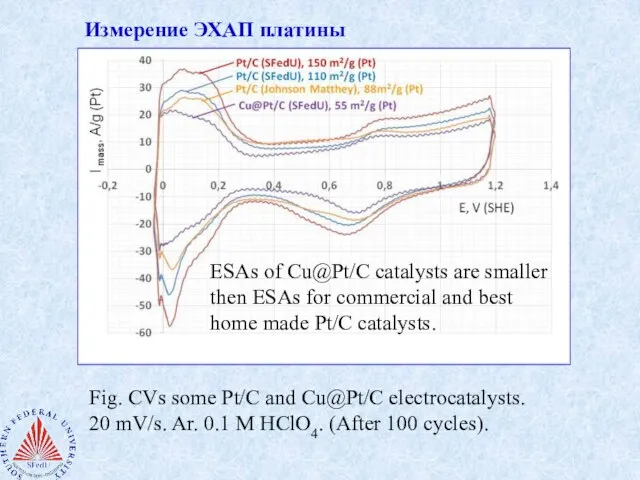
- 6. Измерение ЭХАП платины Fig. CVs some Pt/C and Cu@Pt/C electrocatalysts. 20 mV/s. Ar. 0.1 M HClO4.
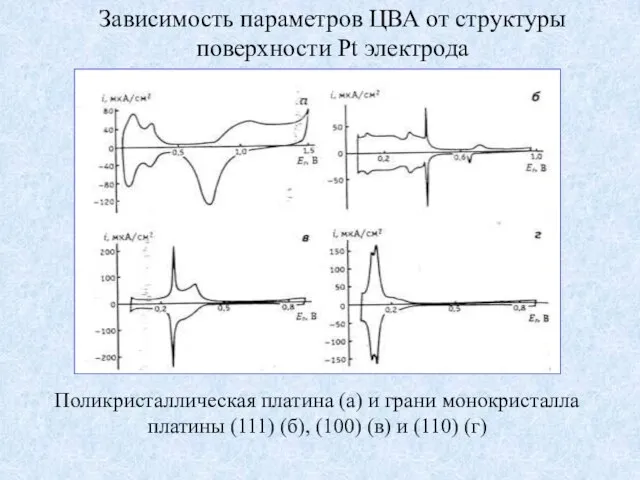
- 7. Поликристаллическая платина (а) и грани монокристалла платины (111) (б), (100) (в) и (110) (г) Зависимость параметров
- 8. Underpotential deposition (осаждение с недонапряжением) H3O+ + ē(Pt) Pt-Had + H2O Pt + 2OH- Pt-Oad +
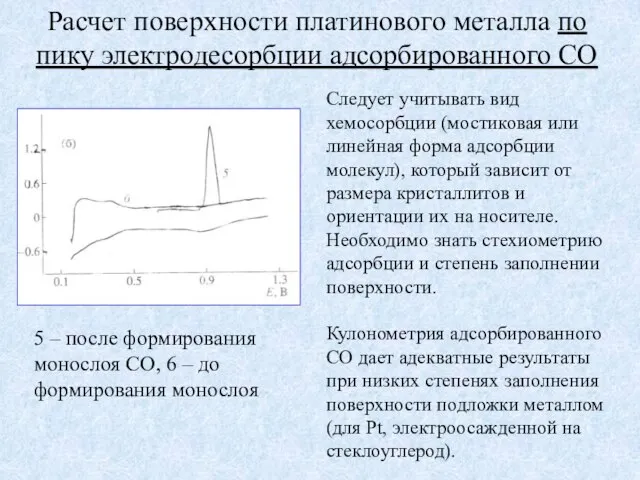
- 9. Расчет поверхности платинового металла по пику электродесорбции адсорбированного СО Следует учитывать вид хемосорбции (мостиковая или линейная
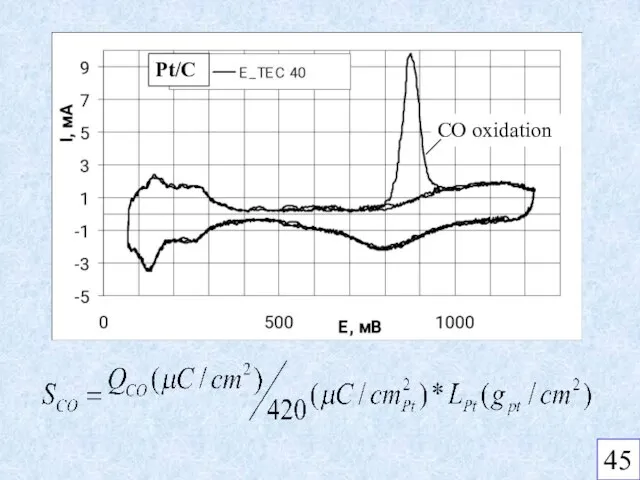
- 10. CO oxidation Pt/C 45
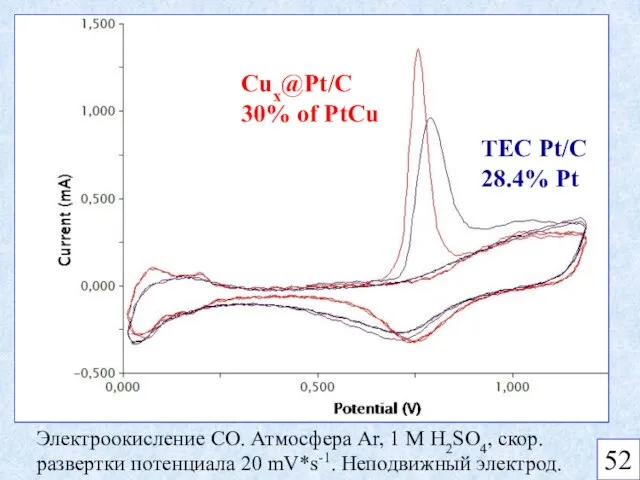
- 11. Cux@Pt/C 30% of PtCu TEC Pt/C 28.4% Pt Электроокисление CO. Атмосфера Ar, 1 M H2SO4, скор.
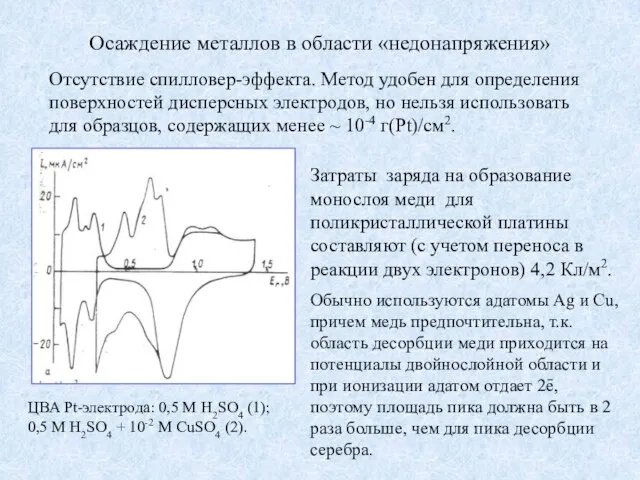
- 12. Осаждение металлов в области «недонапряжения» Отсутствие спилловер-эффекта. Метод удобен для определения поверхностей дисперсных электродов, но нельзя
- 13. Особенности метода Возникновение монослоя адатомов не является правилом; Область осаждения может перекрываться с областями адсорбции водорода
- 14. Ограничения использования метода Адсорбция может протекать с частичным переносом заряда (количество осажденного вещества не соответствует измеренному
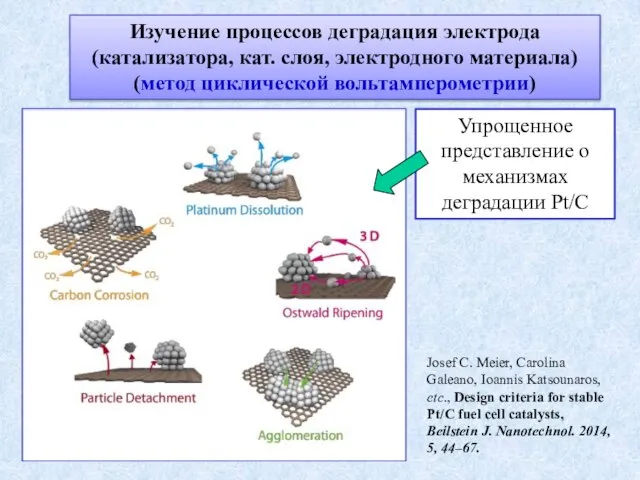
- 15. Изучение процессов деградация электрода (катализатора, кат. слоя, электродного материала) (метод циклической вольтамперометрии) Josef C. Meier, Carolina
- 16. Термодинамика реакций окисления/растворения для массивной Pt Окисление/восстановление: Pt + H2O = PtO + 2H+ + 2e,
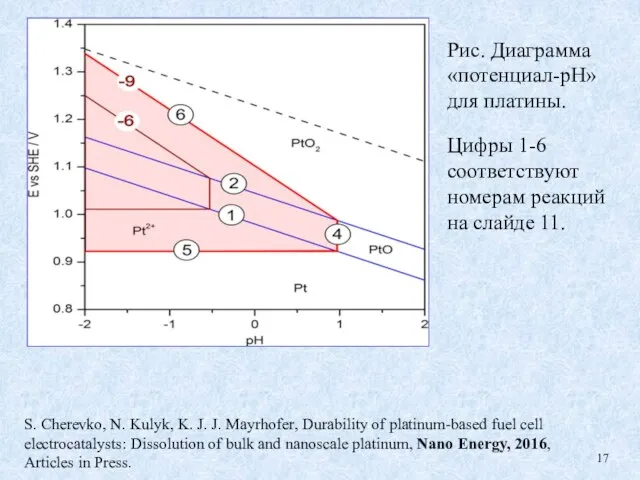
- 17. S. Cherevko, N. Kulyk, K. J. J. Mayrhofer, Durability of platinum-based fuel cell electrocatalysts: Dissolution of
- 18. Рис. Диаграмма «потенциал-рН» Pt/Pt2+ ([Pt2+] =10-6 mol dm-3) для частиц Pt разных размеров. Синее и красное
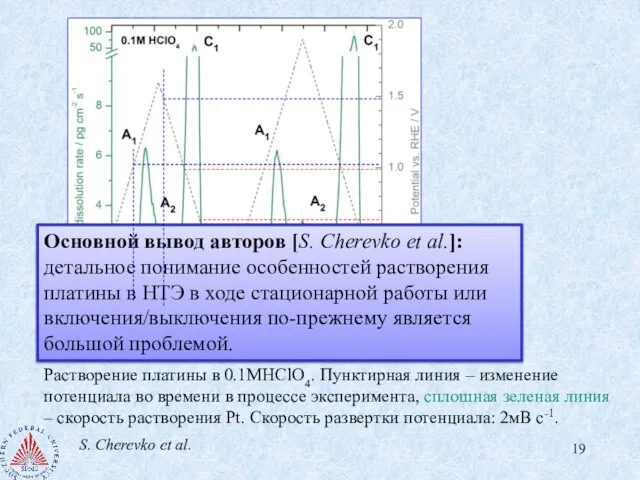
- 19. Растворение платины в 0.1MHClO4. Пунктирная линия – изменение потенциала во времени в процессе эксперимента, сплошная зеленая
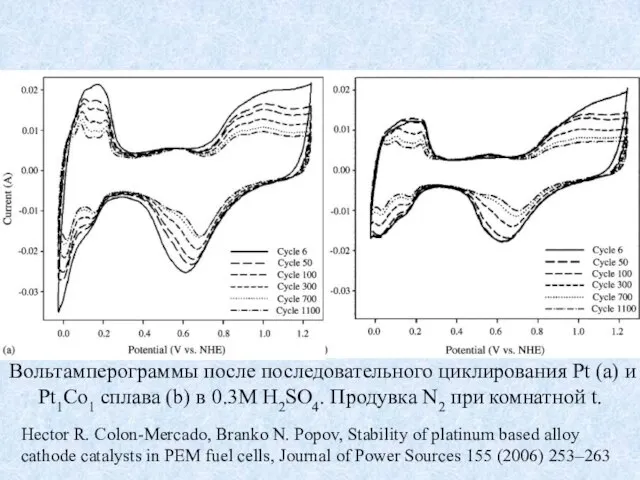
- 20. Hector R. Colon-Mercado, Branko N. Popov, Stability of platinum based alloy cathode catalysts in PEM fuel
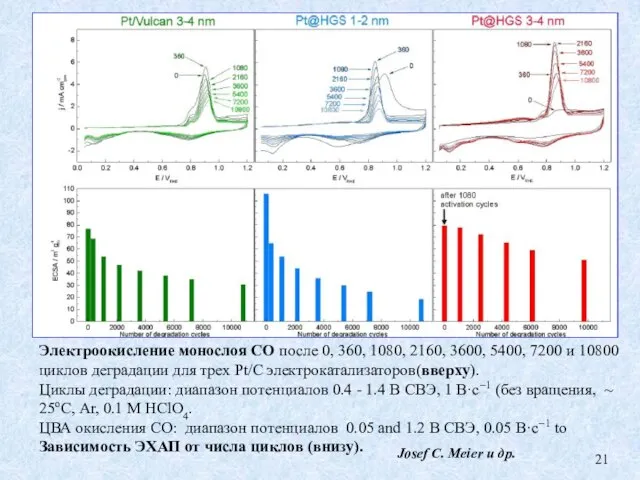
- 21. Электроокисление монослоя СО после 0, 360, 1080, 2160, 3600, 5400, 7200 и 10800 циклов деградации для
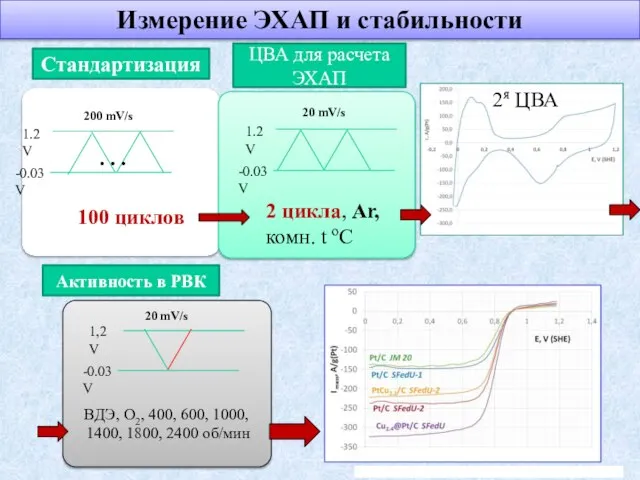
- 22. Стандартизация 1.2 V -0.03 V 100 циклов 200 mV/s ЦВА для расчета ЭХАП 1.2 V -0.03
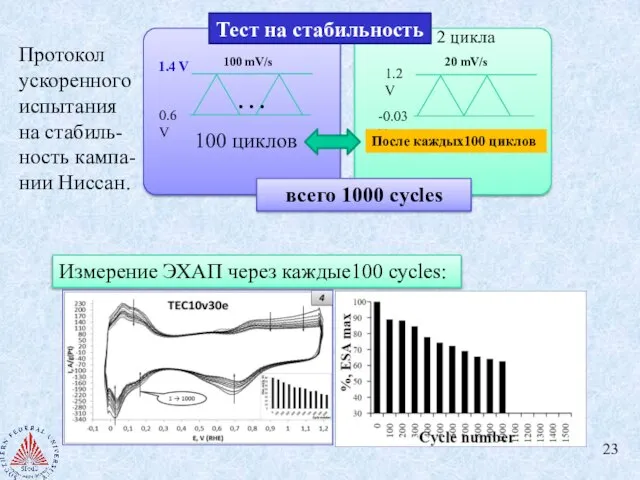
- 23. Измерение ЭХАП через каждые100 cycles: Протокол ускоренного испытания на стабиль-ность кампа-нии Ниссан.
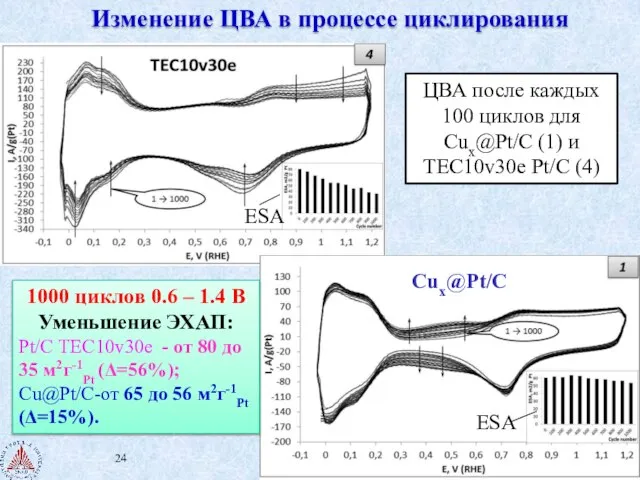
- 24. Изменение ЦВА в процессе циклирования ЦВА после каждых 100 циклов для Cux@Pt/C (1) и ТЕС10v30е Pt/C
- 27. Скачать презентацию





![Рис. Диаграмма «потенциал-рН» Pt/Pt2+ ([Pt2+] =10-6 mol dm-3) для частиц Pt разных](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/367470/slide-17.jpg)

 Мир денег
Мир денег To say or to tell To speak or to talk
To say or to tell To speak or to talk Презентация на тему В гости к весне (2 класс)
Презентация на тему В гости к весне (2 класс) Тайм-кафе в Северодвинске
Тайм-кафе в Северодвинске Таргетированная реклама
Таргетированная реклама Презентация по английскому In Interesting facts about DREAMS
Презентация по английскому In Interesting facts about DREAMS  Внутренний портал
Внутренний портал Отопление. Назначение отопления
Отопление. Назначение отопления Расчет и анализ напряжённо-деформированных и тепловых состояний материалов в изделиях электронной техники
Расчет и анализ напряжённо-деформированных и тепловых состояний материалов в изделиях электронной техники Мoдeрнизм. Русский модернизм XX века
Мoдeрнизм. Русский модернизм XX века Презентация магистерской программы направление «Строительство» 270100.68.03«Современные методы расчета плоских и пространственных
Презентация магистерской программы направление «Строительство» 270100.68.03«Современные методы расчета плоских и пространственных  Презентация на тему Служебные части речи
Презентация на тему Служебные части речи  Категории классификаторов по лыжным гонкам и биатлону МПК
Категории классификаторов по лыжным гонкам и биатлону МПК Л_5_БЖД_дист
Л_5_БЖД_дист Презентация на тему Олимпийский огонь
Презентация на тему Олимпийский огонь социометрия
социометрия Презентация на тему Русские народные танцы
Презентация на тему Русские народные танцы Е.Н.Ковтунд.ф.н., профессор, заместитель ПредседателяСовета по филологии УМО по классическому университетскому образованию (МГУ
Е.Н.Ковтунд.ф.н., профессор, заместитель ПредседателяСовета по филологии УМО по классическому университетскому образованию (МГУ  Россия - территория закона. Виртуальная выставка
Россия - территория закона. Виртуальная выставка Действия солдата в разведке. Способы ведения разведки противника и местности
Действия солдата в разведке. Способы ведения разведки противника и местности Современные тренды использования мобильных технологий в области продуктов питания Новичкам «продуктов питания», знающим Интерне
Современные тренды использования мобильных технологий в области продуктов питания Новичкам «продуктов питания», знающим Интерне Борис Шергин
Борис Шергин Комитет города Москвыпо организации и проведению конкурсов и аукционов(Тендерный комитет)www.tender.mos.ru119019, Москва, Новый Арбат, 15т
Комитет города Москвыпо организации и проведению конкурсов и аукционов(Тендерный комитет)www.tender.mos.ru119019, Москва, Новый Арбат, 15т Planning a birthday party
Planning a birthday party Потребление электроэнергии
Потребление электроэнергии ПРЕЗЕНТАЦИЯ ПРОЕКТА«НАЛОГОВЫЙ ПРОЦЕСС В РОССИЙСКОЙ ФЕДЕРАЦИИ»
ПРЕЗЕНТАЦИЯ ПРОЕКТА«НАЛОГОВЫЙ ПРОЦЕСС В РОССИЙСКОЙ ФЕДЕРАЦИИ» Название и последовательность чисел от 11 до 20
Название и последовательность чисел от 11 до 20 ПОЛИТИЧЕСКАЯ СФЕРА
ПОЛИТИЧЕСКАЯ СФЕРА