Содержание
- 2. Разминка: определите вид химической связи HNO3 Cl2 KHSO4 H2O NaOH CaO Cu
- 3. NH3 + HCl → [NH4]Cl Донорно-акцепторный механизм образования связи + _ .. Н ∙ + ∙
- 4. Исследовательский урок химии в 11 классе Комплексные соединения. Строение. Классификация и номенклатура.
- 5. Цели урока: повторить виды химической связи сформировать понятие о составе и строении комплексных соединений, познакомиться с
- 6. Решите задачу Молярная масса соединения равна 329 г/моль. Массовая доля К, С, Fe и N соответственно
- 7. Решение Дано: Запишем элементы по возрастанию электроотрицательности Ответ:
- 8. Проблема 1 -Что это за соединение? К какому классу оно относится? K3FeC6N6 3КСN · Fe(СN)3
- 9. Лабораторный опыт 1). Внесите кристаллы исследуемого вещества в пламя спиртовки. Отметьте цвет пламени и сделайте вывод.
- 10. Проблема 2 -Как может быть построен ион, содержащий железо? И как построено это соединение в целом?
- 11. N H3 + H Cl → [NH4] Cl + _ .. + _ Ион аммония –
- 12. Строение комплексного соединения Комплексообразователь К3 [Fe (CN) 6 ] ____ __________________ внешняя сфера внутренняя сфера лиганд
- 13. А. Вернер Л.А.Чугаев
- 14. «Только с появлением теории Вернера химия комплексных соединений утратила характер лабиринта или темного леса, в котором
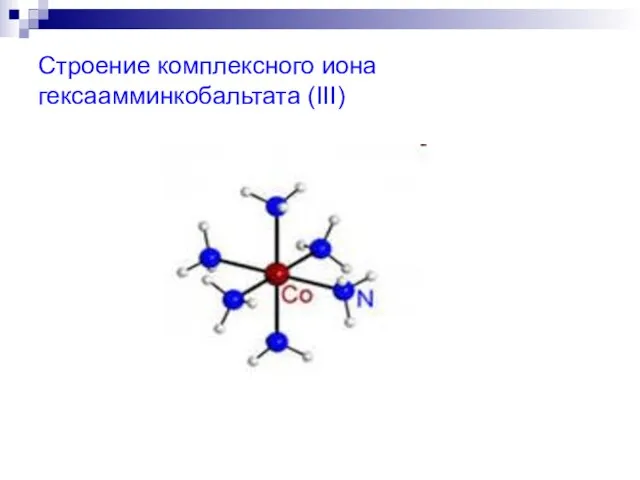
- 15. Строение комплексного иона гексаамминкобальтата (III)
- 16. Классификация. В зависимости от природы лиганда различают: аквакомплексы [Сr (Н2О)6] Сl3; аммиакаты [ Сu (NН3)4] SО4;
- 17. Номенклатура Н2О – «аква-» NН3 – «аммин-» Сl- – «хлоро-» NО2- – «нитро-» СN- – «циано-»
- 18. Упражнение в номенклатуре. 1. Назовите вещества: - тетрагидроксоалюминат натрия - перхлорат хлоронитротетраамминкобальта (III) - сульфат тетраамминмеди
- 19. Назовите исследуемое вещество. К3[Fe (CN) 6 ] Гексацианоферрат (III) калия
- 20. Самостоятельная работа. Напишите формулы веществ: I вариант I I вариант Тетрагидроксокупрата (II) натрия Гексанитрокобальтата (III) калия
- 21. I вариант I I вариант 1. Тетрагидроксокупрат (II) натрия Гексанитрокобальтат (III) калия 2. [ Рt(NН3)3Сl]Сl К[
- 23. Скачать презентацию

![NH3 + HCl → [NH4]Cl Донорно-акцепторный механизм образования связи + _ ..](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405988/slide-2.jpg)







![N H3 + H Cl → [NH4] Cl + _ .. +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405988/slide-10.jpg)
![Строение комплексного соединения Комплексообразователь К3 [Fe (CN) 6 ] ____ __________________ внешняя](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405988/slide-11.jpg)


![Классификация. В зависимости от природы лиганда различают: аквакомплексы [Сr (Н2О)6] Сl3; аммиакаты](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405988/slide-15.jpg)


![Назовите исследуемое вещество. К3[Fe (CN) 6 ] Гексацианоферрат (III) калия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405988/slide-18.jpg)


 Money, Banking, and Financial Institutions
Money, Banking, and Financial Institutions Немой кинематограф. Вклад Александра Петровича Довженко
Немой кинематограф. Вклад Александра Петровича Довженко Проектирование и экспертиза образовательных систем
Проектирование и экспертиза образовательных систем Грибы-паразиты и меры борьбы с ними
Грибы-паразиты и меры борьбы с ними Права людини
Права людини Дизайн
Дизайн Управление собственностью. Стратегический менеджмент
Управление собственностью. Стратегический менеджмент культуры клеток
культуры клеток Перспективы ядерной энергетики
Перспективы ядерной энергетики Геометрические тела и окружающий мир
Геометрические тела и окружающий мир Творчество Евгения Рачёва
Творчество Евгения Рачёва Презентация на тему Промышленные загрязнения
Презентация на тему Промышленные загрязнения  Аналитика: Управленческая отчетность руководителя
Аналитика: Управленческая отчетность руководителя Здравствуй, школа!
Здравствуй, школа! Строевая подготовка
Строевая подготовка Мониторинг здоровья у занимающихся физической культурой − путь к успеху
Мониторинг здоровья у занимающихся физической культурой − путь к успеху Palkin_G_A_novaya
Palkin_G_A_novaya Пушкин "У лукоморья дуб зеленый"
Пушкин "У лукоморья дуб зеленый" Структура комплекса энтомофагов опыленной сливово-злаковой тли (Hyalopterus pruni) в условиях Беларуси
Структура комплекса энтомофагов опыленной сливово-злаковой тли (Hyalopterus pruni) в условиях Беларуси Основы финансовых вычислений
Основы финансовых вычислений Обучение работе с Microsoft Excel
Обучение работе с Microsoft Excel Буллинг в школе
Буллинг в школе Сокращение дробей
Сокращение дробей НАШИ БЛИЖАЙШИЕ СОСЕДИ
НАШИ БЛИЖАЙШИЕ СОСЕДИ Квалификационные требования к специалистам и проектным организациям в
Квалификационные требования к специалистам и проектным организациям в  Презентация на тему Стили речи
Презентация на тему Стили речи Косметическая линейка ватной продукции и влажных салфеток
Косметическая линейка ватной продукции и влажных салфеток Галактики. Многообразие галактик
Галактики. Многообразие галактик