РАЗРАБОТКА ЭЛЕКТРОФОРЕТИЧЕСКОГО И ХРОМАТОГРАФИЧЕСКОГО СПОСОБОВ ОПРЕДЕЛЕНИЯ ПОЛИФЕНОЛОВ И КОФЕИНА В РАЗЛИЧНЫХ СОРТАХ ЗЕЛЕНОГО И
Содержание
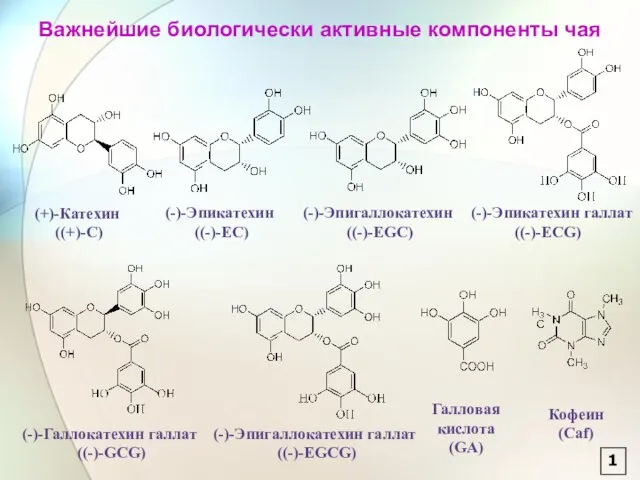
- 2. Важнейшие биологически активные компоненты чая 1
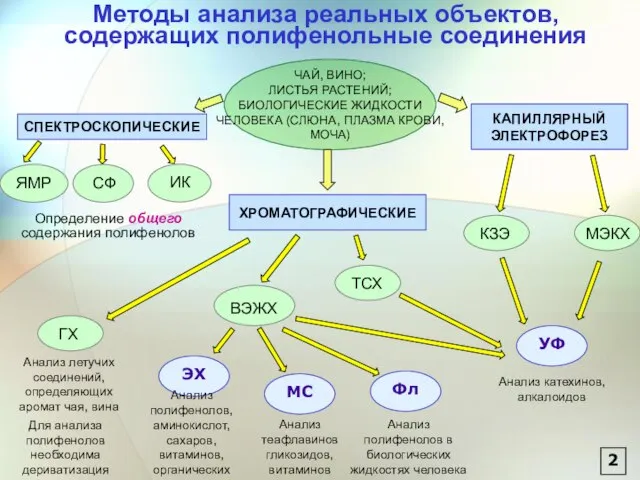
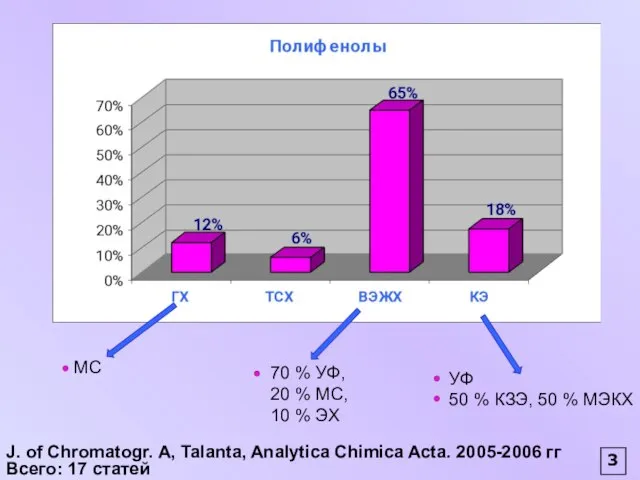
- 3. Методы анализа реальных объектов, содержащих полифенольные соединения Определение общего содержания полифенолов УФ Анализ катехинов, алкалоидов ЭХ
- 4. J. of Chromatogr. А, Talanta, Analytica Chimica Acta. 2005-2006 гг Всего: 17 статей 3
- 5. 4 МЕТОД КАПИЛЛЯРНОГО ЭЛЕКТРОФОРЕЗА
- 6. Поставленные задачи: Получение спектрофотометрических характеристик полифенолов и кофеина Оптимизация условий разделения модельной смеси полифенолов в режиме
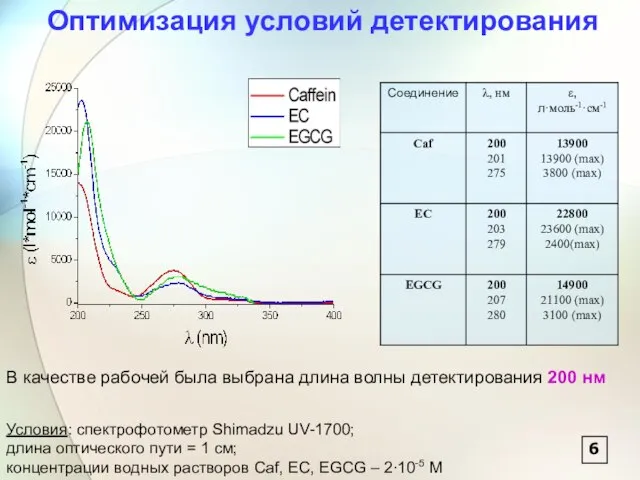
- 7. Оптимизация условий детектирования В качестве рабочей была выбрана длина волны детектирования 200 нм 6 Условия: спектрофотометр
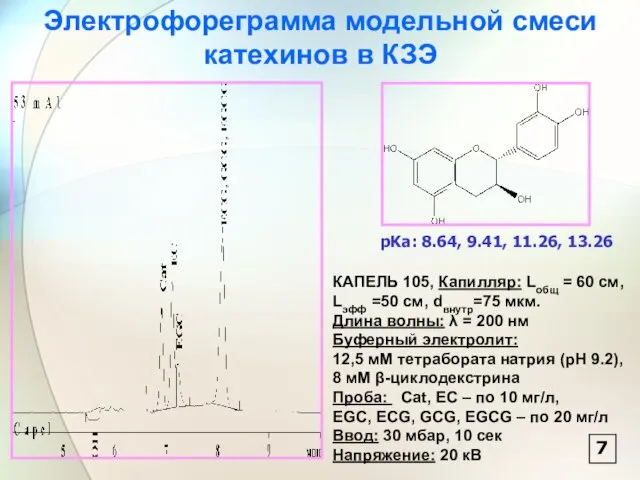
- 8. Электрофореграмма модельной смеси катехинов в КЗЭ КАПЕЛЬ 105, Капилляр: Lобщ = 60 см, Lэфф =50 см,
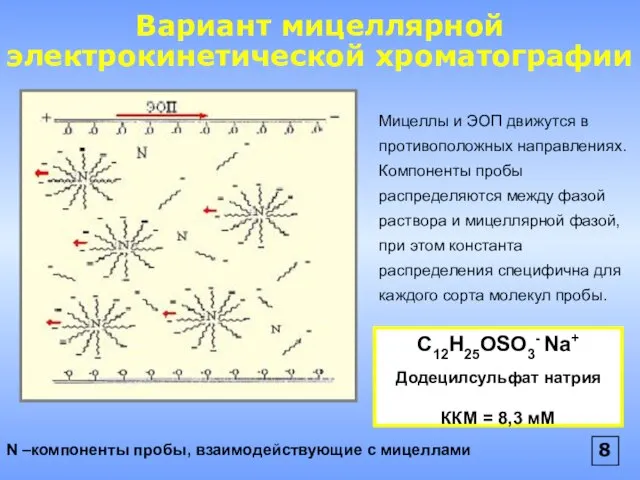
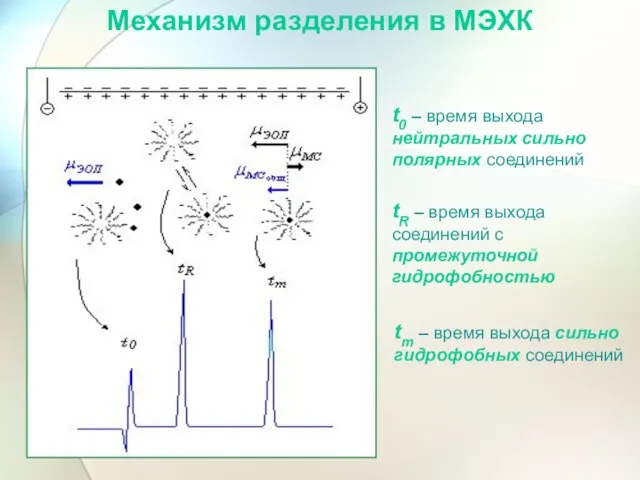
- 9. Вариант мицеллярной электрокинетической хроматографии N –компоненты пробы, взаимодействующие с мицеллами Мицеллы и ЭОП движутся в противоположных
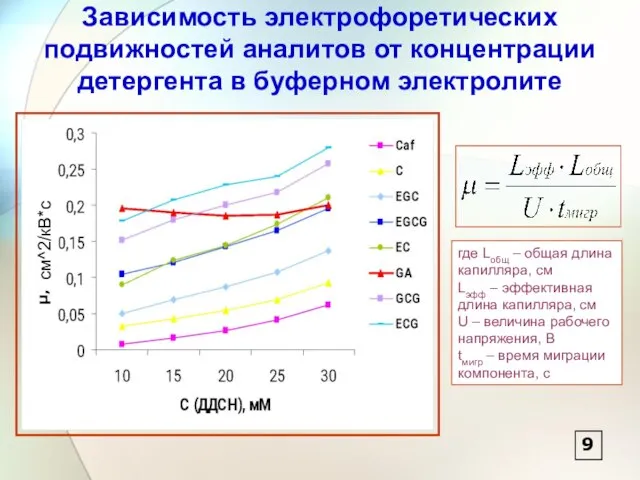
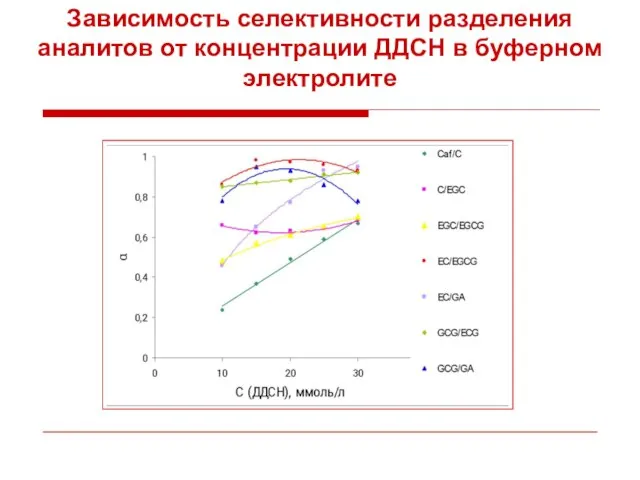
- 10. Зависимость электрофоретических подвижностей аналитов от концентрации детергента в буферном электролите где Lобщ – общая длина капилляра,
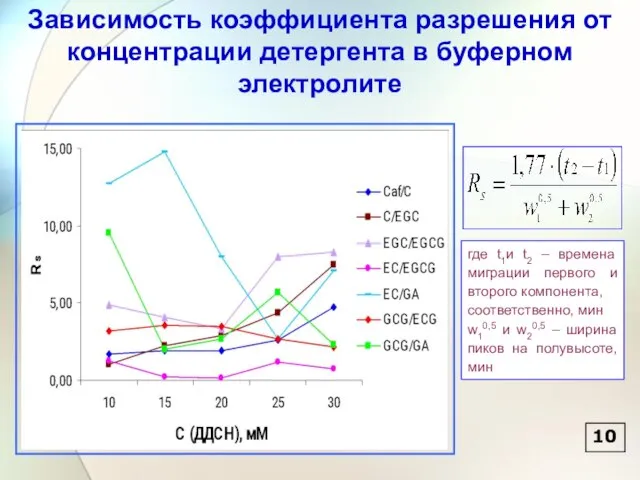
- 11. Зависимость коэффициента разрешения от концентрации детергента в буферном электролите где t1и t2 – времена миграции первого
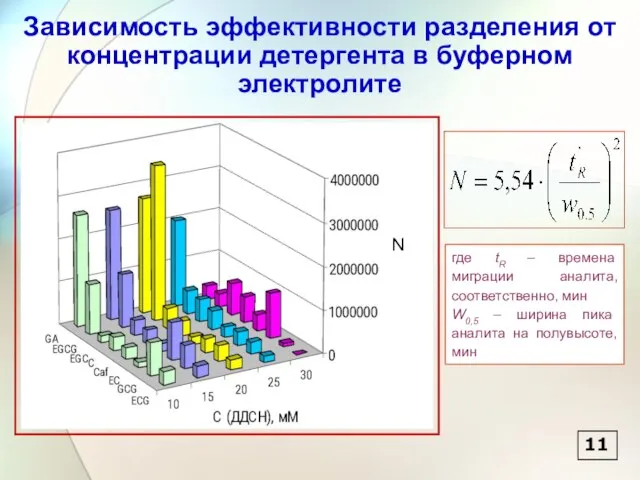
- 12. Зависимость эффективности разделения от концентрации детергента в буферном электролите 11 где tR – времена миграции аналита,
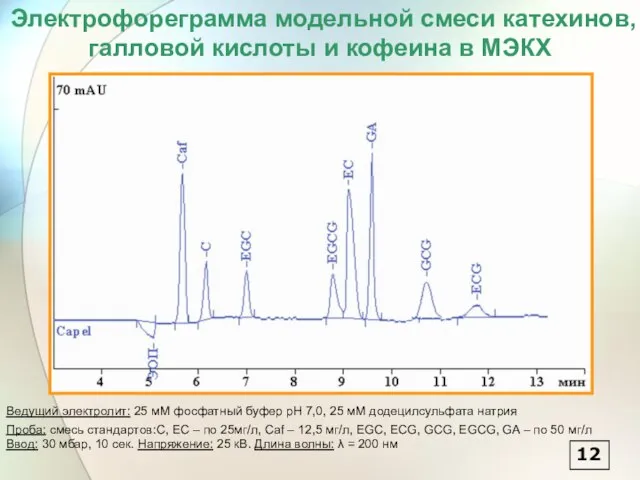
- 13. Электрофореграмма модельной смеси катехинов, галловой кислоты и кофеина в МЭКХ Ведущий электролит: 25 мМ фосфатный буфер
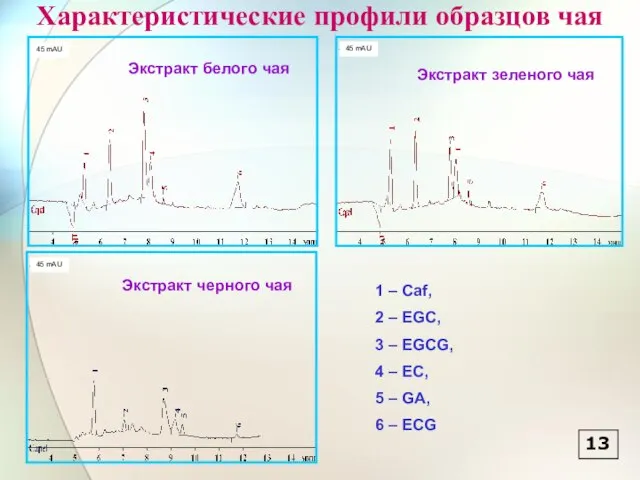
- 14. Характеристические профили образцов чая 1 – Caf, 2 – EGC, 3 – EGCG, 4 – EC,
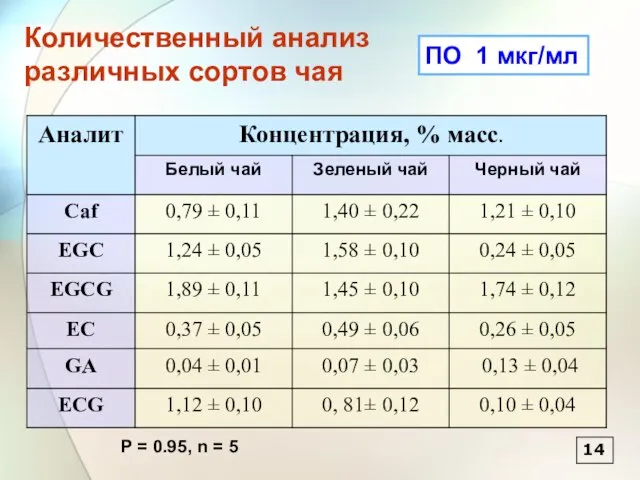
- 15. 14 ПО 1 мкг/мл P = 0.95, n = 5 Количественный анализ различных сортов чая
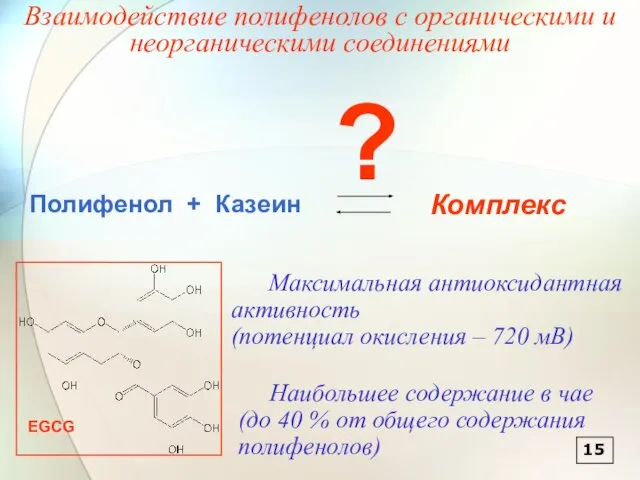
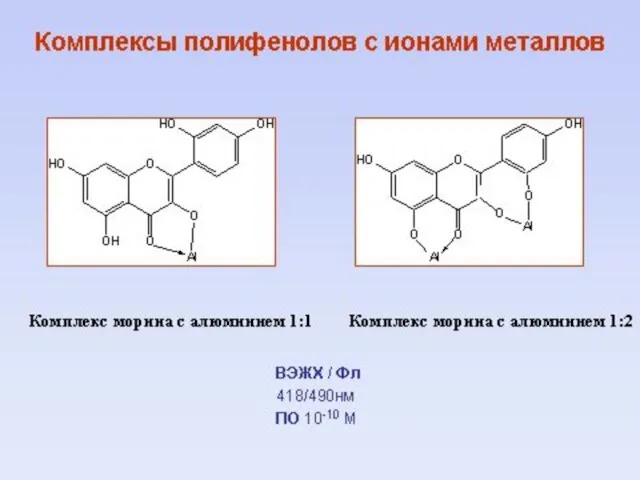
- 16. 15 Взаимодействие полифенолов с органическими и неорганическими соединениями
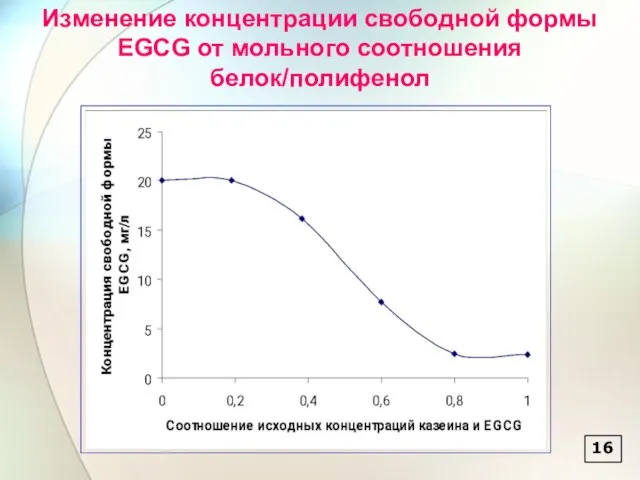
- 17. 16 Изменение концентрации свободной формы EGCG от мольного соотношения белок/полифенол
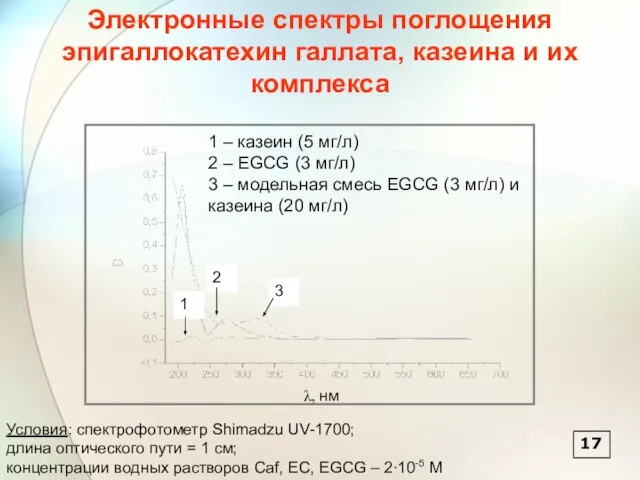
- 18. 1 2 3 1 – казеин (5 мг/л) 2 – EGCG (3 мг/л) 3 – модельная
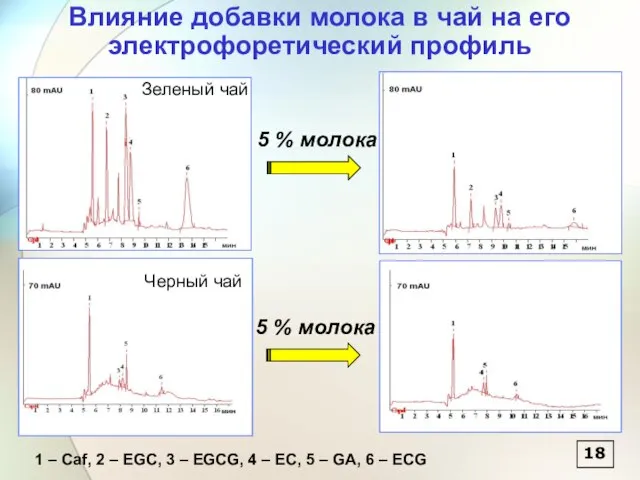
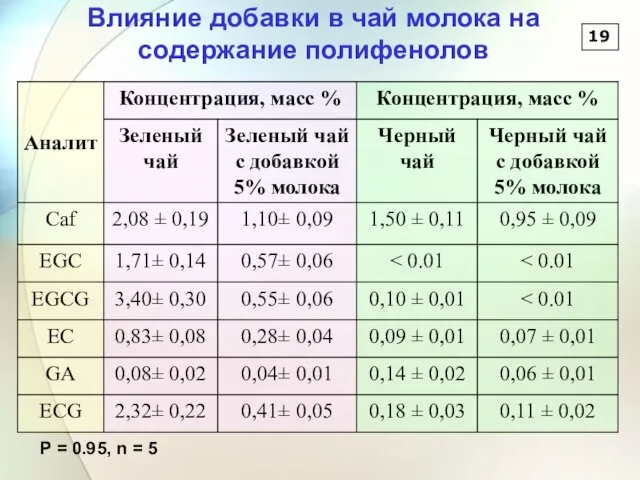
- 19. 18 5 % молока 5 % молока Зеленый чай Черный чай Влияние добавки молока в чай
- 20. 19 Влияние добавки в чай молока на содержание полифенолов P = 0.95, n = 5
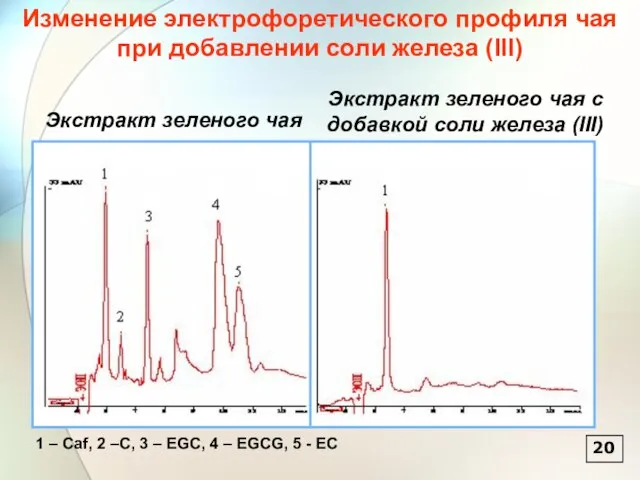
- 21. 20 Изменение электрофоретического профиля чая при добавлении соли железа (III)
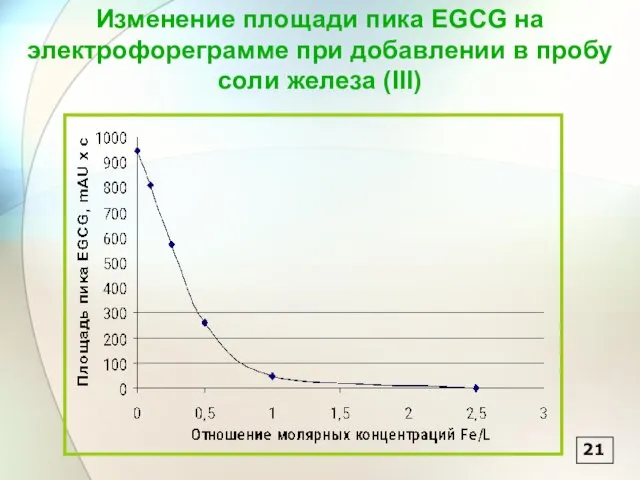
- 22. 21 Изменение площади пика EGCG на электрофореграмме при добавлении в пробу соли железа (III)
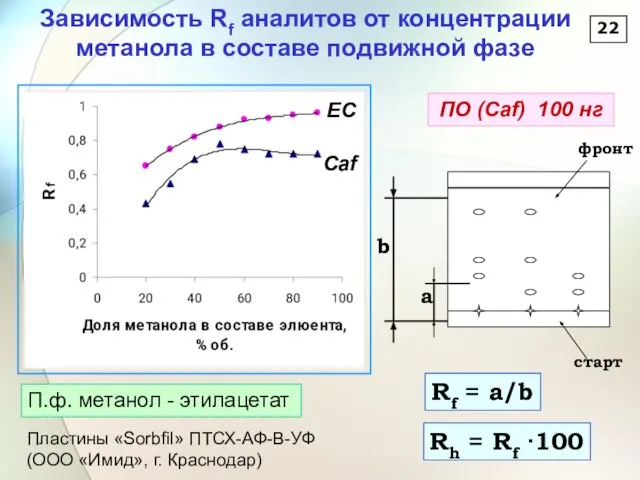
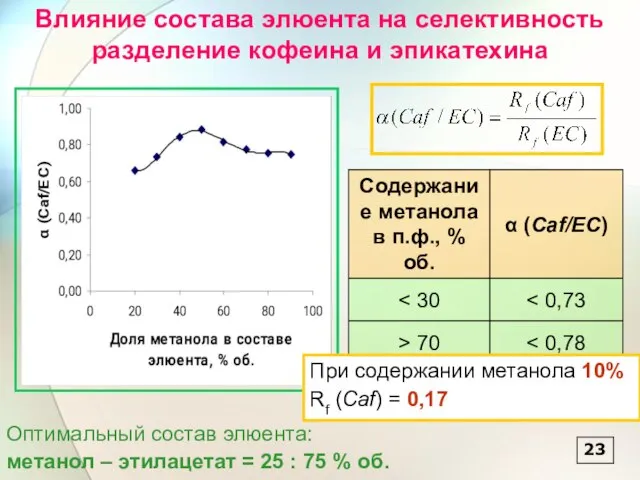
- 23. Зависимость Rf аналитов от концентрации метанола в составе подвижной фазе 22 Rf = a/b Rh =
- 24. 23 Влияние состава элюента на селективность разделение кофеина и эпикатехина При содержании метанола 10% Rf (Caf)
- 25. (1 – 7) – стандартные растворы кофеина, 8 – проба чая, 9 – проба чая с
- 26. Колонка: Supelco C18; 150 ×4 мм Элюент: ацетонитрил – 1 % муравьиная кислота 25 Проверка корректности
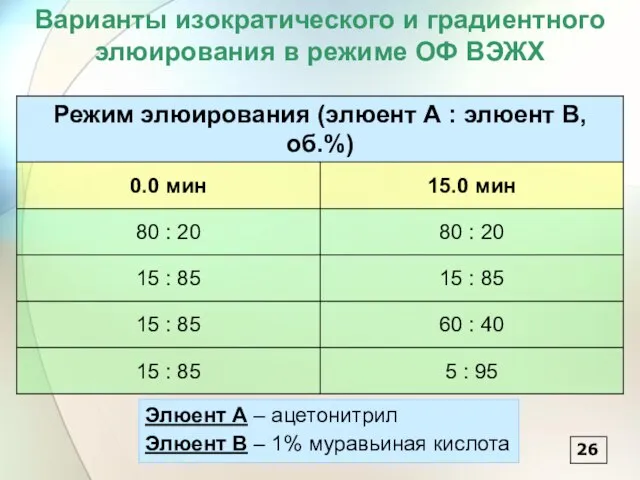
- 27. Варианты изократического и градиентного элюирования в режиме ОФ ВЭЖХ 26 Элюент А – ацетонитрил Элюент В
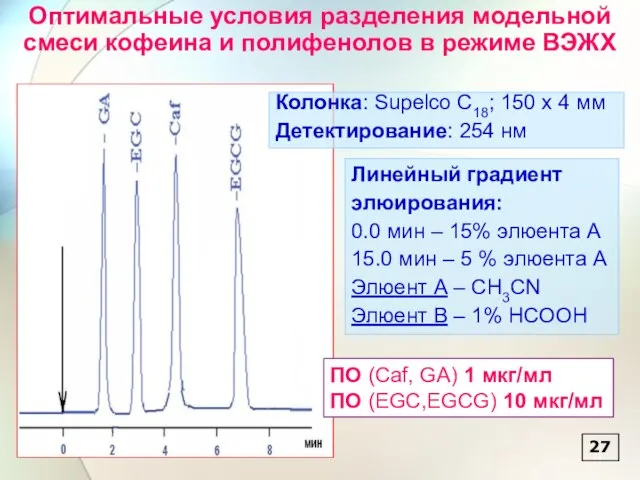
- 28. Оптимальные условия разделения модельной смеси кофеина и полифенолов в режиме ВЭЖХ Линейный градиент элюирования: 0.0 мин
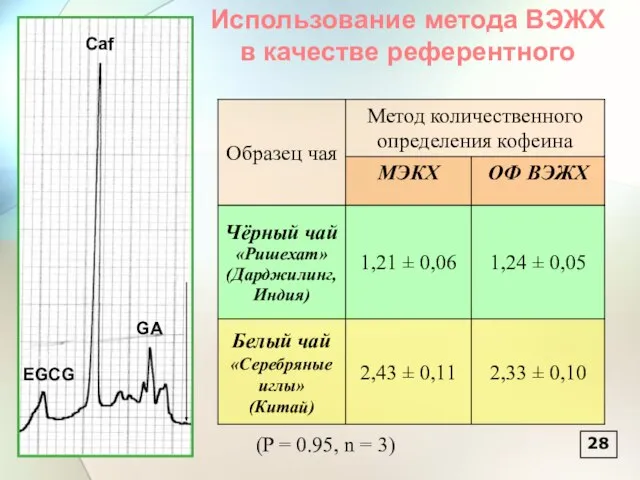
- 29. 28 Caf GA EGCG (P = 0.95, n = 3) Использование метода ВЭЖХ в качестве референтного
- 30. Сопоставление с литературными данными 29 Концентрация выражена в % масс [1] P.L. Fernandez, M.J. Martin, etc.
- 31. Выводы 1. Изучены возможности различных вариантов капиллярного электрофореза с УФ-детектированием (КЗЭ и МЭКХ) для одновременного разделения
- 32. Спасибо за внимание!
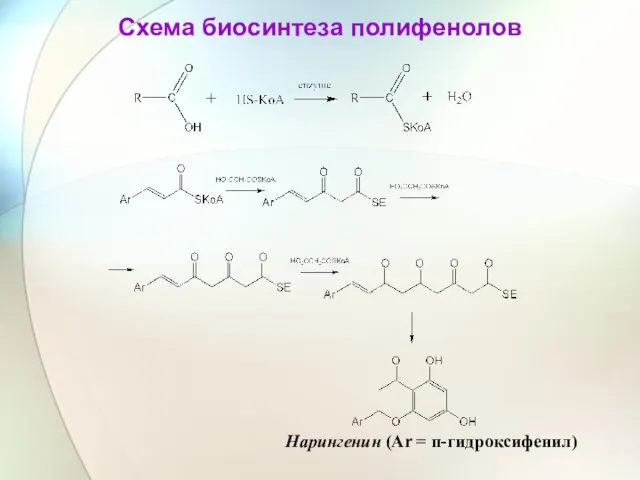
- 33. Схема биосинтеза полифенолов Нарингенин (Ar = п-гидроксифенил)
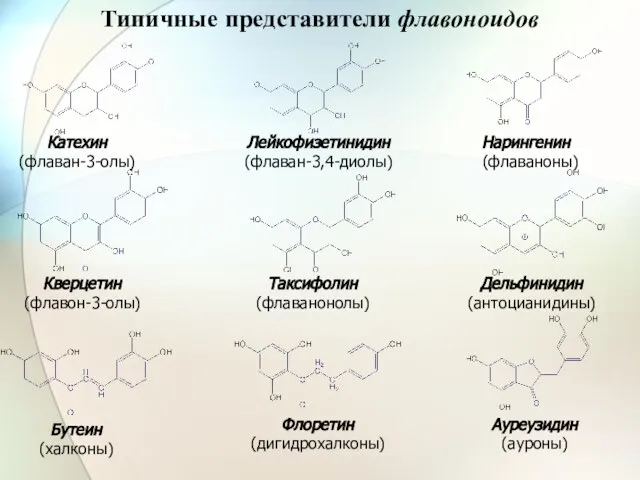
- 34. Ауреузидин (ауроны) Флоретин (дигидрохалконы) Бутеин (халконы) Катехин (флаван-3-олы) Лейкофизетинидин (флаван-3,4-диолы) Нарингенин (флаваноны) Кверцетин (флавон-3-олы) Дельфинидин (антоцианидины)
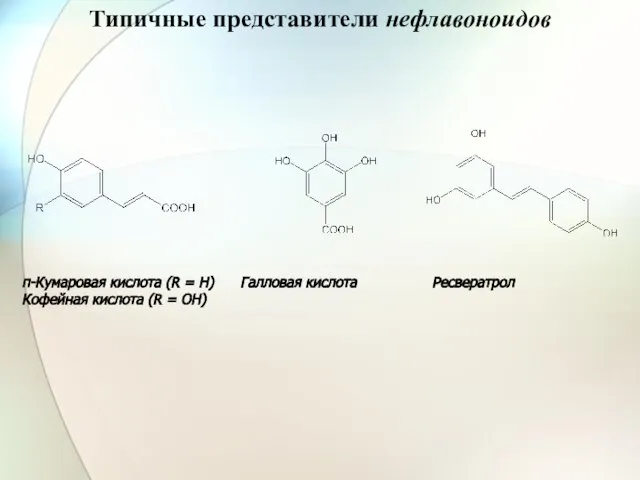
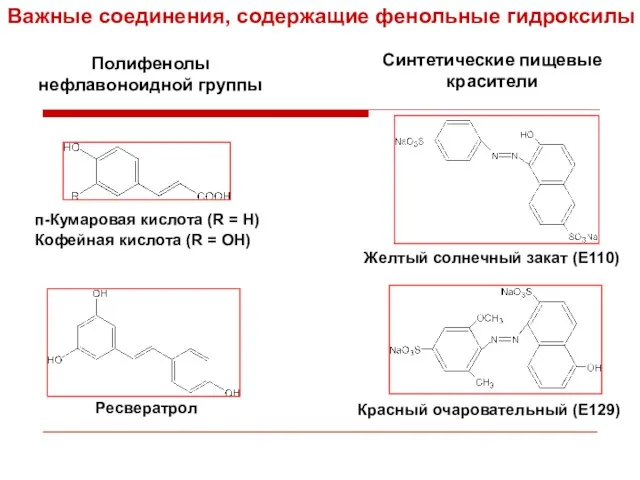
- 35. Типичные представители нефлавоноидов п-Кумаровая кислота (R = H) Галловая кислота Ресвератрол Кофейная кислота (R = OH)
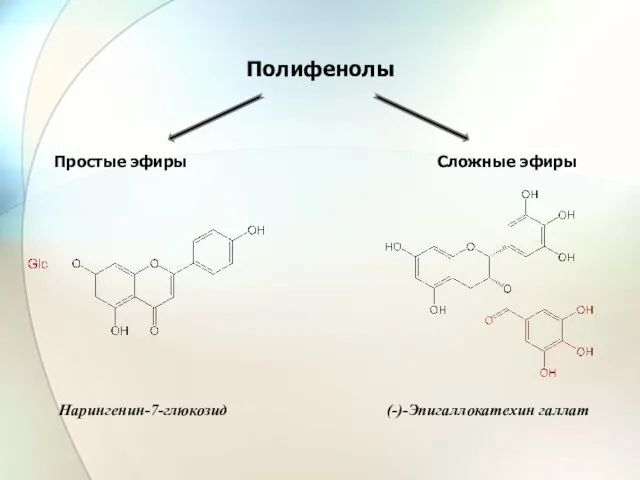
- 36. Полифенолы Сложные эфиры Простые эфиры (-)-Эпигаллокатехин галлат Нарингенин-7-глюкозид
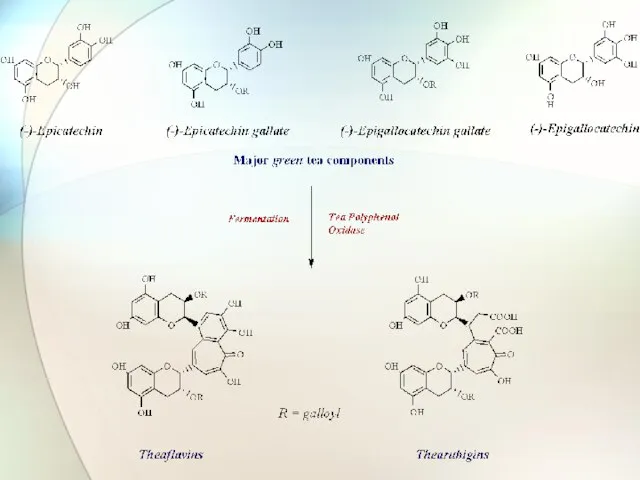
- 37. Компоненты чая Фенольные вещества (до 30 %) Эфирные масла (0,02%) Алкалоиды (1-5 %) Аминокислоты и белки
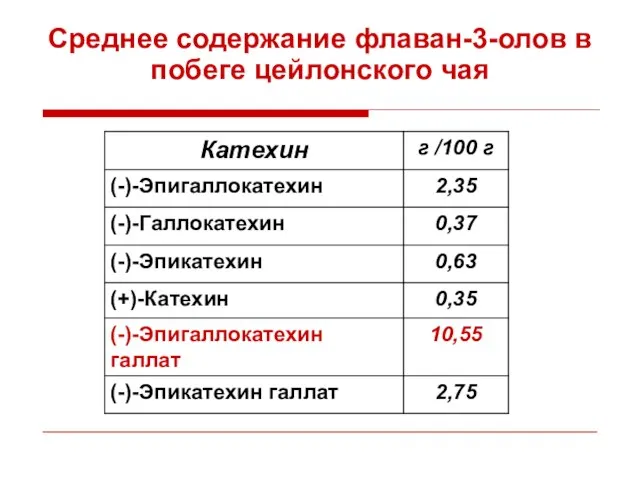
- 38. Среднее содержание флаван-3-олов в побеге цейлонского чая
- 39. п-Кумаровая кислота (R = H) Кофейная кислота (R = OH) Ресвератрол Желтый солнечный закат (Е110) Красный
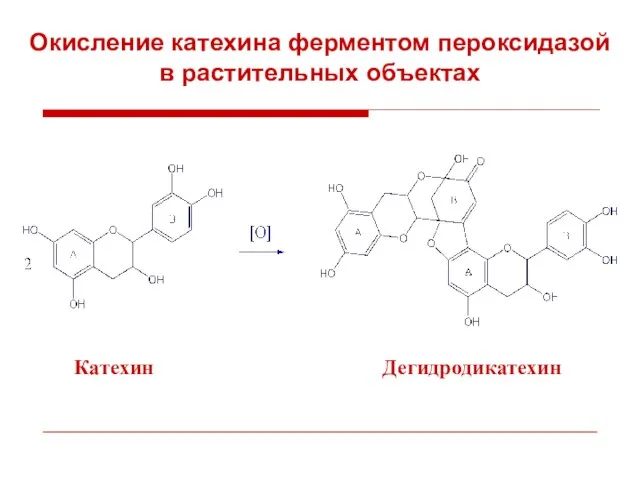
- 40. [О] – ферменты, радикалы, катионы металлов Окисление полифенолов
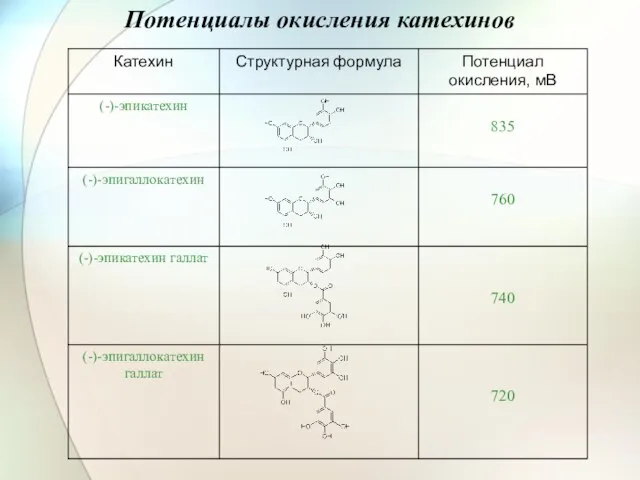
- 41. Потенциалы окисления катехинов
- 42. Катехин Дегидродикатехин Окисление катехина ферментом пероксидазой в растительных объектах
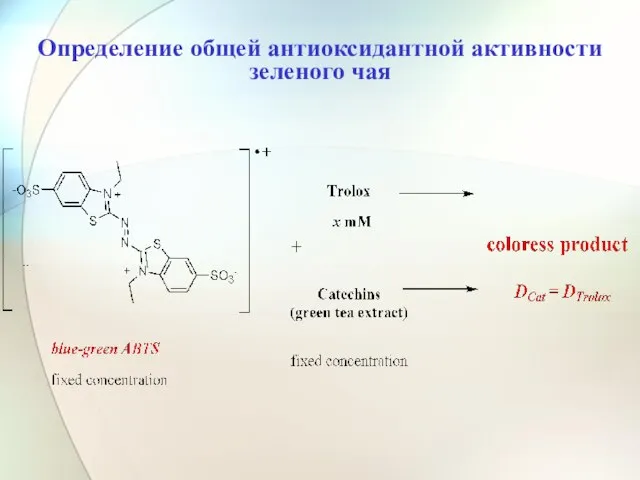
- 44. Определение общей антиоксидантной активности зеленого чая
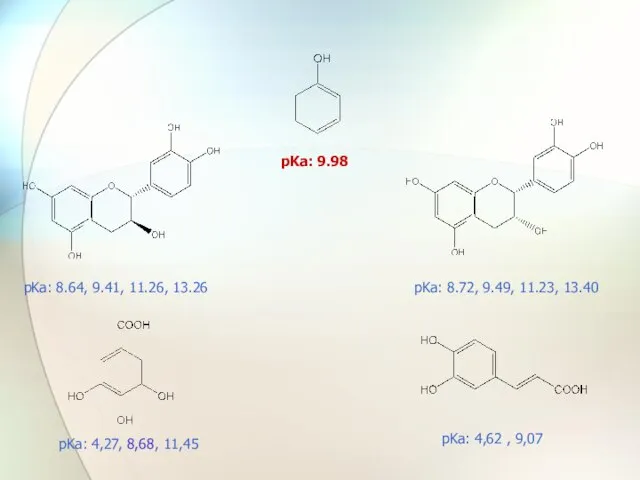
- 45. pKa: 9.98 pKa: 8.64, 9.41, 11.26, 13.26 pKa: 8.72, 9.49, 11.23, 13.40 pKa: 4,27, 8,68, 11,45
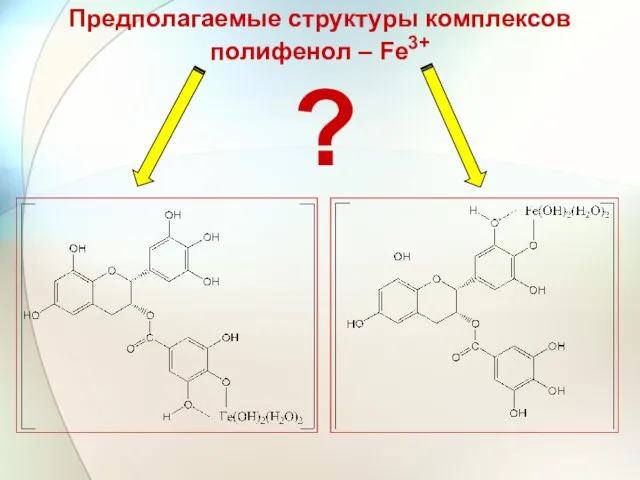
- 47. Предполагаемые структуры комплексов полифенол – Fe3+ ?
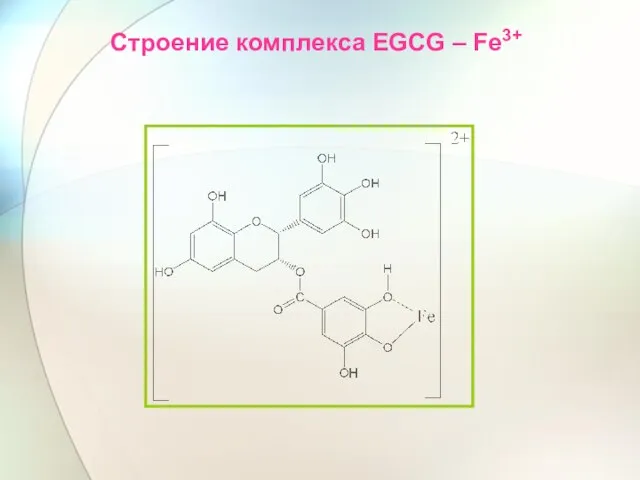
- 48. Строение комплекса EGCG – Fe3+
- 49. Зависимость селективности разделения аналитов от концентрации ДДСН в буферном электролите
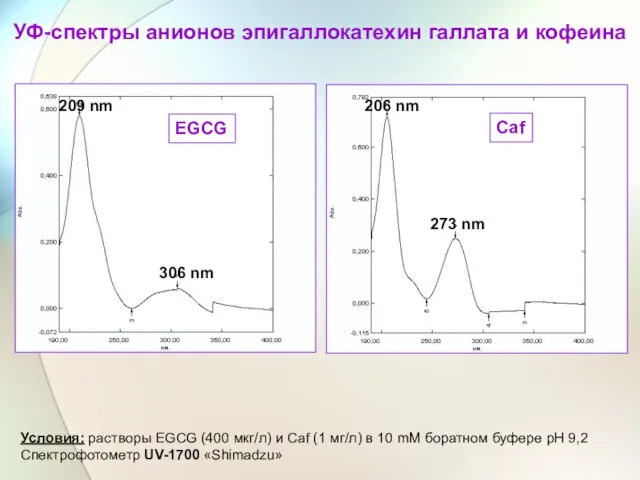
- 50. EGCG Caf 306 nm 209 nm 273 nm 206 nm УФ-спектры анионов эпигаллокатехин галлата и кофеина
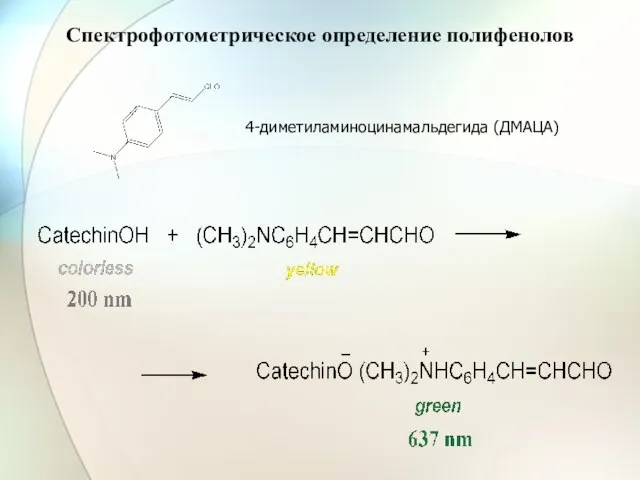
- 51. 4-диметиламиноцинамальдегида (ДМАЦА) Спектрофотометрическое определение полифенолов
- 52. Преимущества ВЭТСХ Экспрессность Возможность параллельно проводить анализ нескольких образцов Легкость смены элюента Высокая эффективность
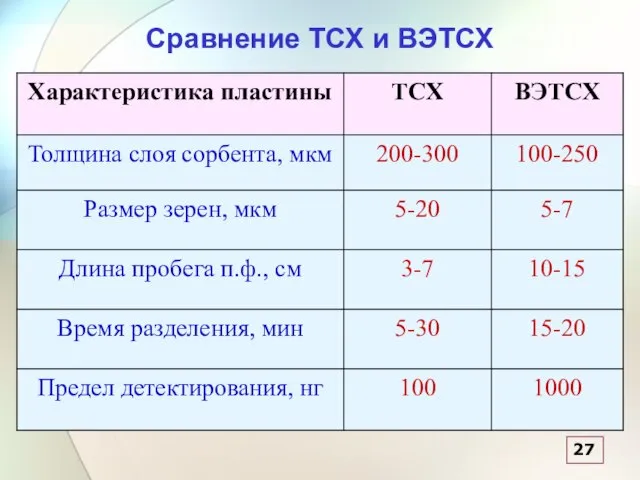
- 53. Сравнение ТСХ и ВЭТСХ 27
- 54. t0 – время выхода нейтральных сильно полярных соединений tR – время выхода соединений с промежуточной гидрофобностью
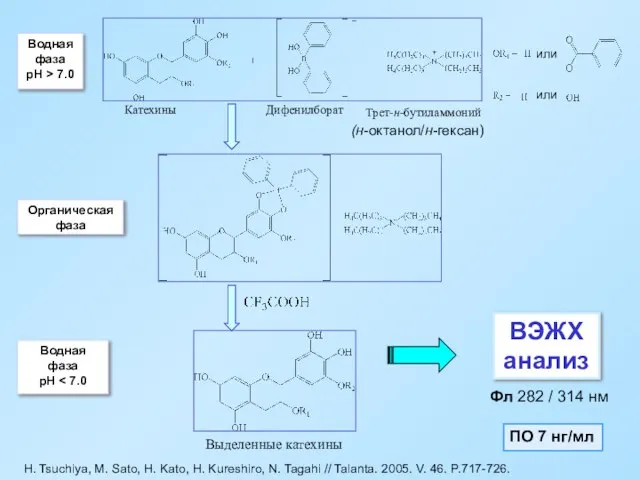
- 55. H. Tsuchiya, M. Sato, H. Kato, H. Kureshiro, N. Tagahi // Talanta. 2005. V. 46. P.717-726.
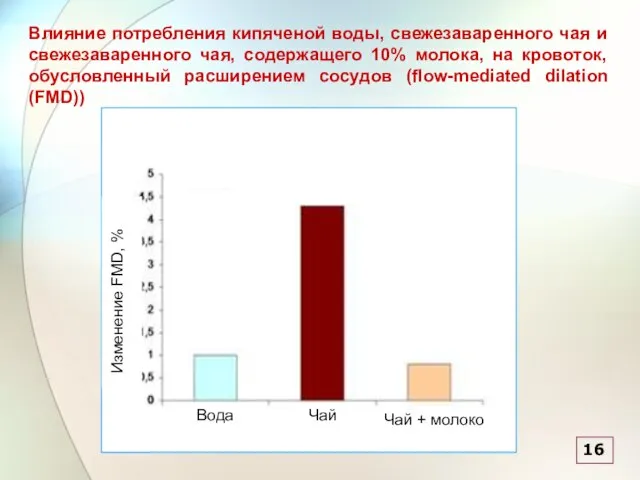
- 56. Влияние потребления кипяченой воды, свежезаваренного чая и свежезаваренного чая, содержащего 10% молока, на кровоток, обусловленный расширением
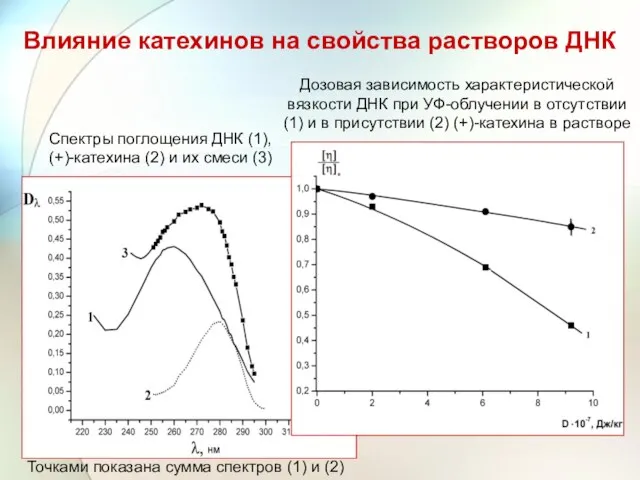
- 57. Влияние катехинов на свойства растворов ДНК Дозовая зависимость характеристической вязкости ДНК при УФ-облучении в отсутствии (1)
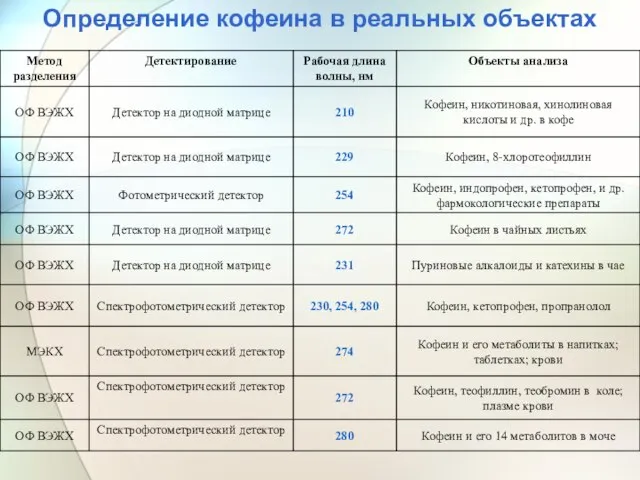
- 58. Определение кофеина в реальных объектах
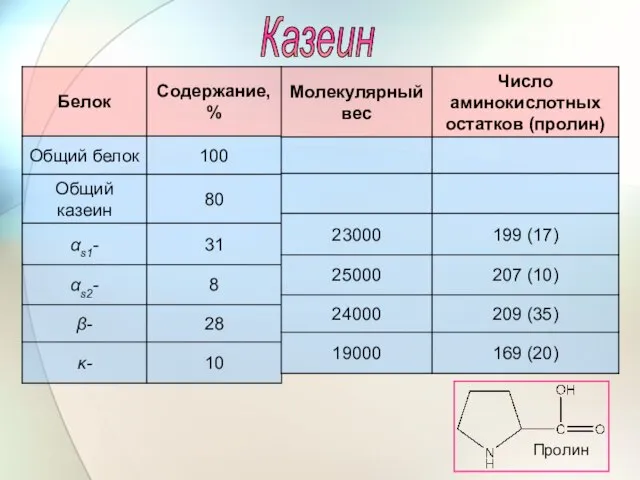
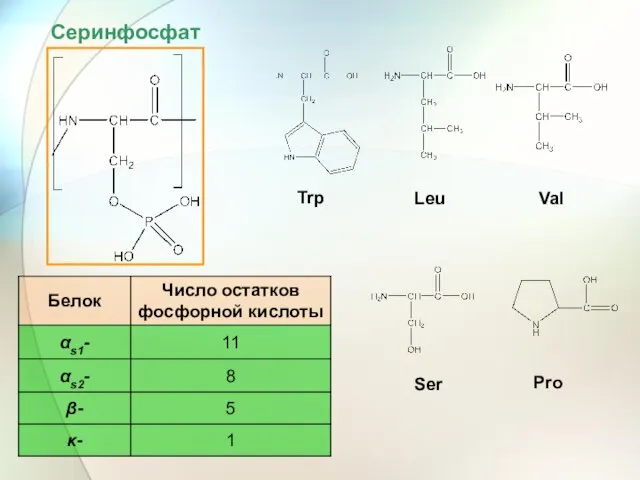
- 59. Казеин Пролин
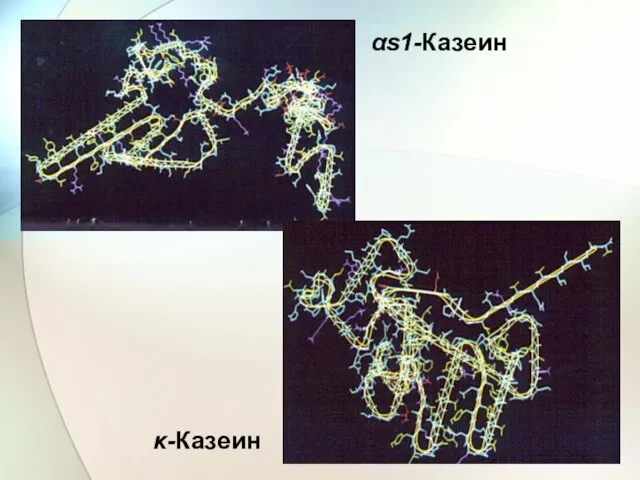
- 60. αs1-Казеин κ-Казеин
- 61. Серинфосфат Trp Leu Val Ser Pro
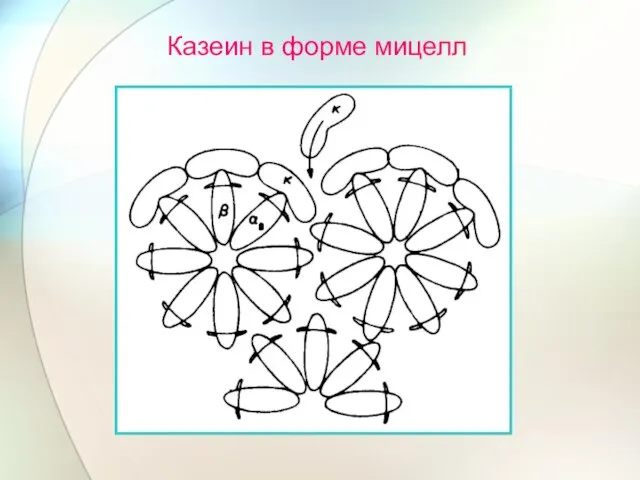
- 62. Казеин в форме мицелл
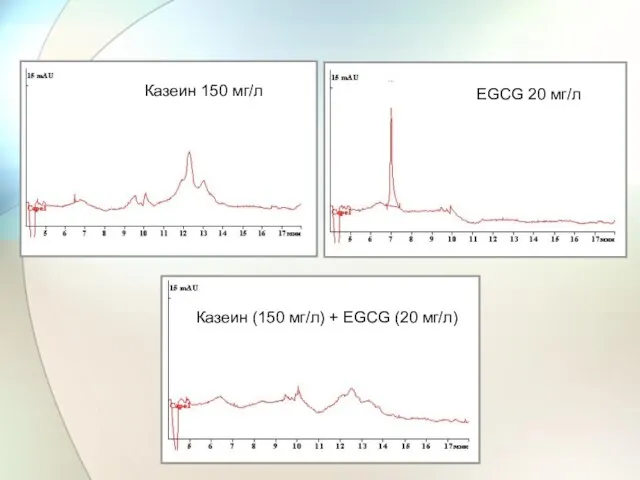
- 63. Казеин 150 мг/л EGCG 20 мг/л Казеин (150 мг/л) + EGCG (20 мг/л)
- 64. (+)-катехин [2R,3S]-2-[3,4-дигидроксифенил]-3,4-дигидро-1[2H]-бензопиран-3,5,7-триол (-)-Эпикатехин [2R,3R]-2-[3,4-дигидроксифенил]-3,4-дигидро-1[2H]-бензопиран-3,5,7-триол (-)-эпигаллокатехин [2R,3R]-2-[3,4,5-тригидроксифенил]-3,4-дигидро-1[2H]-бензопиран-3,5,7-триол (-)-Эпикатехин галлат [2R,3R]-2-[3,4-дигидроксифенил]-3,4-дигидро-1[2H]-бензопиран-3,5,7-триол 3-[3,4,5-тригидроксибензоат (-)-эпигаллокатехин галлат [2R,3R]-2-[3,4,5-тригидроксифенил]-3,4-дигидро-1[2H]-бензопиран-3,5,7-триол 3-[3,4,5-тригидроксибензоат (-)-галлокатехин галлат
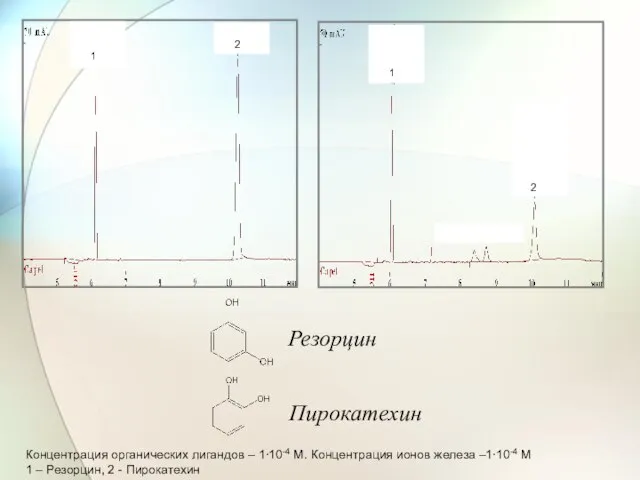
- 65. Концентрация органических лигандов – 1∙10-4 М. Концентрация ионов железа –1∙10-4 М 1 – Резорцин, 2 -
- 67. Оптимальные условия электрофоретического разделения смеси полифенолов и кофеина Система капиллярного электрофореза Капель-105; Капилляр: Lобщ = 60
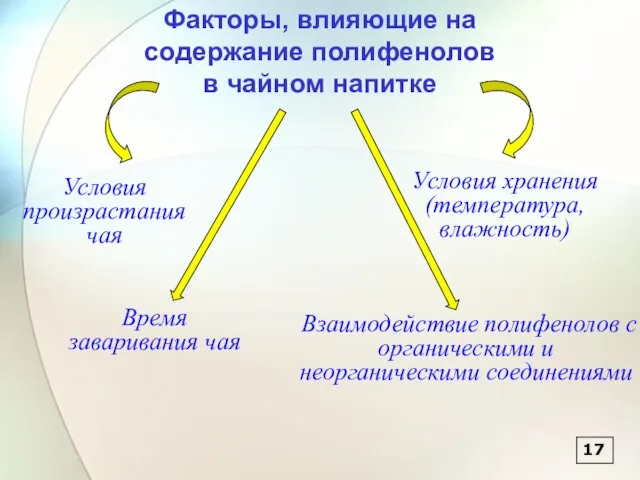
- 68. 17 Факторы, влияющие на содержание полифенолов в чайном напитке Условия произрастания чая Условия хранения (температура, влажность)
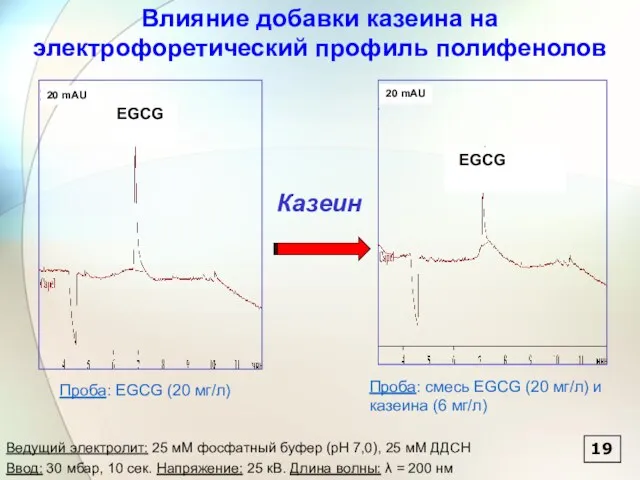
- 69. 19 Казеин Влияние добавки казеина на электрофоретический профиль полифенолов Проба: EGCG (20 мг/л) Проба: смесь EGCG
- 70. Адсорбционная ТСХ Caf EC EGCG ECG Caf Реальный объект H = 0,02 мм α(Caf/EC) = 0,68
- 72. Скачать презентацию




![Сопоставление с литературными данными 29 Концентрация выражена в % масс [1] P.L.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/424687/slide-29.jpg)



![[О] – ферменты, радикалы, катионы металлов Окисление полифенолов](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/424687/slide-39.jpg)

![(+)-катехин [2R,3S]-2-[3,4-дигидроксифенил]-3,4-дигидро-1[2H]-бензопиран-3,5,7-триол (-)-Эпикатехин [2R,3R]-2-[3,4-дигидроксифенил]-3,4-дигидро-1[2H]-бензопиран-3,5,7-триол (-)-эпигаллокатехин [2R,3R]-2-[3,4,5-тригидроксифенил]-3,4-дигидро-1[2H]-бензопиран-3,5,7-триол (-)-Эпикатехин галлат [2R,3R]-2-[3,4-дигидроксифенил]-3,4-дигидро-1[2H]-бензопиран-3,5,7-триол 3-[3,4,5-тригидроксибензоат (-)-эпигаллокатехин галлат](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/424687/slide-63.jpg)
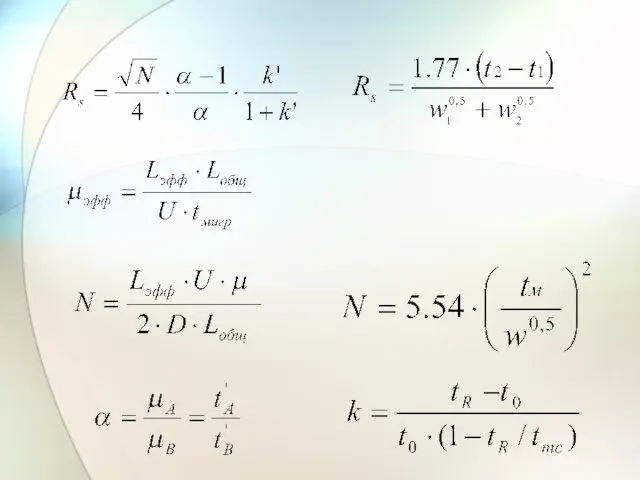


 Основы работы в сети Интернет
Основы работы в сети Интернет Интеграция в начальных классах современной школы
Интеграция в начальных классах современной школы Мозаика "Попугай"
Мозаика "Попугай" Компьютерных Технологий и Систем KTS 2018
Компьютерных Технологий и Систем KTS 2018 Интегрированные занятия учителя логопеда и психологас учащимися с задержкой психического развития.
Интегрированные занятия учителя логопеда и психологас учащимися с задержкой психического развития. khernya1
khernya1 Презентация на тему Электронные музыкальные инструменты
Презентация на тему Электронные музыкальные инструменты Донпроектэлектро - комплексный проектный институт
Донпроектэлектро - комплексный проектный институт Билингвальный профориентационный проект
Билингвальный профориентационный проект Урок по избирательному праву для школьников 7-9 классов
Урок по избирательному праву для школьников 7-9 классов 7 основных принципов многопользовательской активации в ОС Windows 7 © Корпорация Майкрософт (Microsoft Corp.), 2009 г. Все права защищены. ИТ-спец
7 основных принципов многопользовательской активации в ОС Windows 7 © Корпорация Майкрософт (Microsoft Corp.), 2009 г. Все права защищены. ИТ-спец Классификация стилей
Классификация стилей Тема урока: "Гигиена пищеварения. Предупреждение желудочно-кишечных заболеваний"
Тема урока: "Гигиена пищеварения. Предупреждение желудочно-кишечных заболеваний" Спортивная игра волейбол. История возникновения и развития игры. Правила игры
Спортивная игра волейбол. История возникновения и развития игры. Правила игры Исследовательская работа на тему: “Закаливание”
Исследовательская работа на тему: “Закаливание” Наблюдательная астрономия
Наблюдательная астрономия Презентация на тему Наше настроение
Презентация на тему Наше настроение  Конституционное право Российской Федерации как отрасль права. Тема 1
Конституционное право Российской Федерации как отрасль права. Тема 1 Прощать не по-детски
Прощать не по-детски Экспертные оценки: метод мозгового штурма, метод Дельфи
Экспертные оценки: метод мозгового штурма, метод Дельфи Майкл Фарадей
Майкл Фарадей Справка о заключении счетов ф. 0503110, ф. 0503710
Справка о заключении счетов ф. 0503110, ф. 0503710 Логистика- инструмент рыночной экономики
Логистика- инструмент рыночной экономики  Панк
Панк Оплата труда в организации
Оплата труда в организации Животное из Красной книги – воробьиный сычик
Животное из Красной книги – воробьиный сычик Нормативно-правовое обеспечение деятельности учреждений дополнительного образования детей
Нормативно-правовое обеспечение деятельности учреждений дополнительного образования детей Особенности работы с военнослужащими, проходящими службу по контракту, призыву, военнослужащими женского пола
Особенности работы с военнослужащими, проходящими службу по контракту, призыву, военнослужащими женского пола