Слайд 2Вещество – то, из чего состоит физическое тело.

Слайд 3
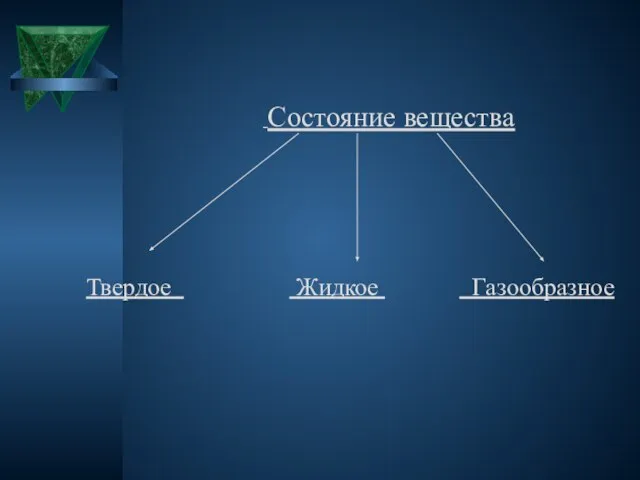
Состояние вещества
Твердое Жидкое Газообразное
Слайд 4
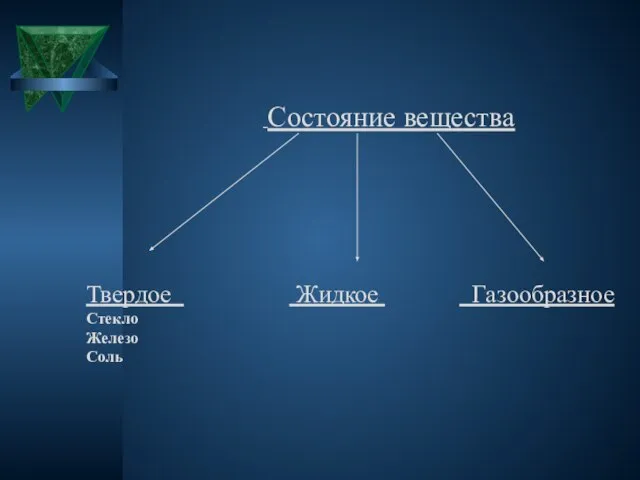
Состояние вещества
Твердое Жидкое Газообразное Стекло
Железо
Соль
Слайд 5
Твердое вещество
Аморфное Кристаллическое
нет определенной tпл определенная tпл
смола хлорид
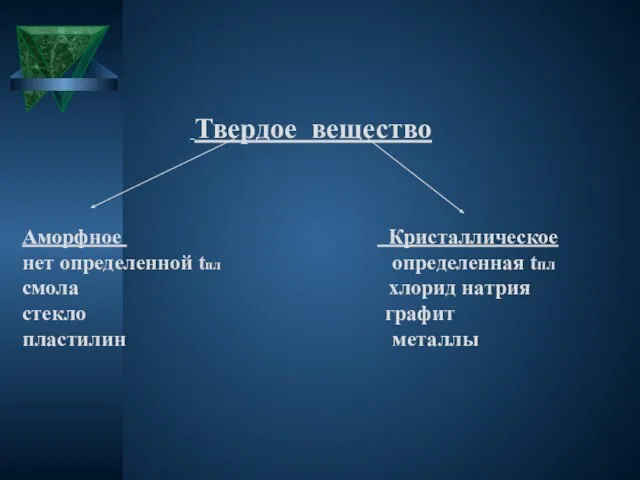
натрия
стекло графит
пластилин металлы
Слайд 6
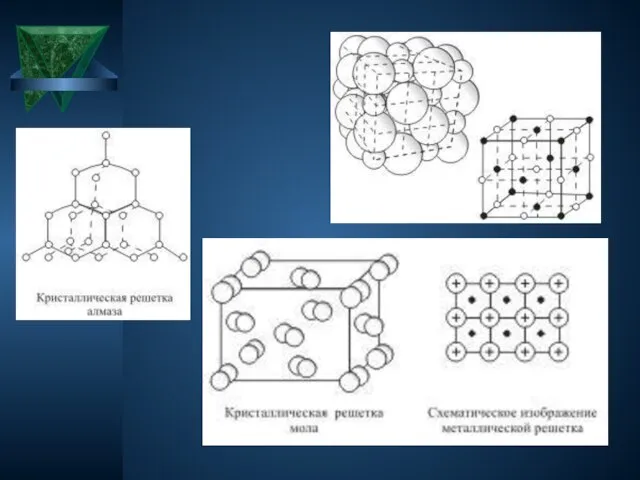
Кристаллические решётки веществ-это упорядоченное расположение частиц (атомов, молекул, ионов) в строго

определённых точках пространства. Точки размещения частиц называют узлами кристаллической решётки.
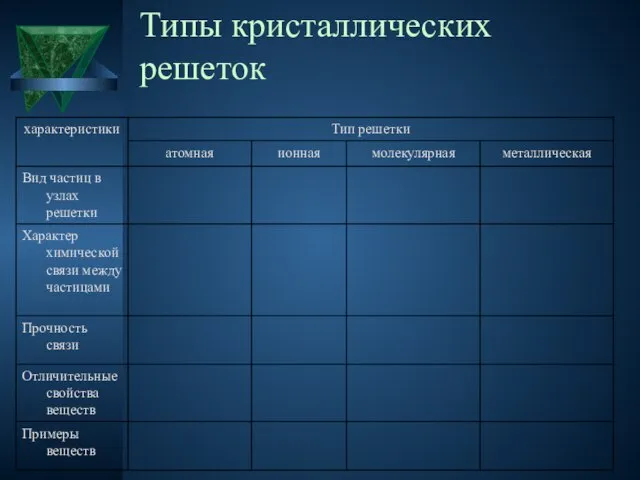
Слайд 8Типы кристаллических решеток
Слайд 9ИОННЫЕ
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества

с ионной связью.
Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов.
Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия. Связи между ионами в кристалле очень прочные и устойчивые. Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
Слайд 10Атомные
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены

очень прочными ковалентными связями.
Выше показана кристаллическая решётка алмаза. В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз - самый твёрдый природный материал.
Слайд 11Молекулярные
Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в

них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные.
Выше представлена кристаллическая решётка I2 Вещества с МКР имеют малую твёрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии
Слайд 12Металлические
Металлическими называют решётки, в узлах которых находятся атомы и ионы металла. Для

металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность
Слайд 14Закон постоянства состава
Жозеф Луи Пруст. 1808 г.
родился 26 сентября 1754 г.

в небольшом городке Анжере в семье аптекаря
1775 г. он был назначен на должность управляющего аптекой больницы Сальпетриер
1777 г. Пруст получил приглашение на кафедру химии и металлургии недавно основанной Королевской семинарии в Вергаре (Испания)
1785 г. король Испании Карл III пригласил Пруста на должность профессора химии Артиллерийской школы в Сеговии
В дальнейшем Пруст руководил кафедрами химии в университете Саламанки (1789), а затем Мадрида (1791–1808).
Слайд 15Закон постоянства состава
Жозеф Луи Пруст. 1808 г.
«Молекулярные химические соединения независимо от

способа их получения имеют постоянный состав и свойства»














 THE CHRISTIAN WORKER
THE CHRISTIAN WORKER 1665678763032__30ro86
1665678763032__30ro86 Агрессия (4 класс)
Агрессия (4 класс) 1.1 + 1.2
1.1 + 1.2 История носового платка
История носового платка Поля листа
Поля листа Вкусное и красивое лакомство для неожиданных гостей
Вкусное и красивое лакомство для неожиданных гостей Добро пожаловать
Добро пожаловать Независимое распределение затрат в управленческом и регламентированном учете
Независимое распределение затрат в управленческом и регламентированном учете Абсолютные показатели оценки риска
Абсолютные показатели оценки риска Кипение
Кипение Страны Северной Европы
Страны Северной Европы Конструкция головы человека и её пропорции (6 класс)
Конструкция головы человека и её пропорции (6 класс) Энтеровирусная инфекция
Энтеровирусная инфекция Конвекция
Конвекция САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКИЕ ТРЕБОВАНИЯ К УСЛОВИЯМИ ОРГАНИЗАЦИИ ОБУЧЕНИЯ В ОБЩЕОБРАЗОВАТЕЛЬНЫХ УЧРЕЖДЕНИЯХ
САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКИЕ ТРЕБОВАНИЯ К УСЛОВИЯМИ ОРГАНИЗАЦИИ ОБУЧЕНИЯ В ОБЩЕОБРАЗОВАТЕЛЬНЫХ УЧРЕЖДЕНИЯХ Ассоциация «МЫ»
Ассоциация «МЫ» Диагностика автомобиля. Диагностирование осветительных приборов
Диагностика автомобиля. Диагностирование осветительных приборов Денис Васильевич Давыдов
Денис Васильевич Давыдов Рекомендую как пособие по медицинской генетике
Рекомендую как пособие по медицинской генетике Любимый семейный завтрак семьи Пьянковых
Любимый семейный завтрак семьи Пьянковых Доброта
Доброта О РЕЗУЛЬТАТАХ ЕГЭ в г. Сочи в 2011 ГОДУ
О РЕЗУЛЬТАТАХ ЕГЭ в г. Сочи в 2011 ГОДУ Психологические закономерности формирования личности в тренировочном процессе.
Психологические закономерности формирования личности в тренировочном процессе. Базовый межшкольный методический центр 26311
Базовый межшкольный методический центр 26311 Сложение и вычитание двузначных чисел 2 класс
Сложение и вычитание двузначных чисел 2 класс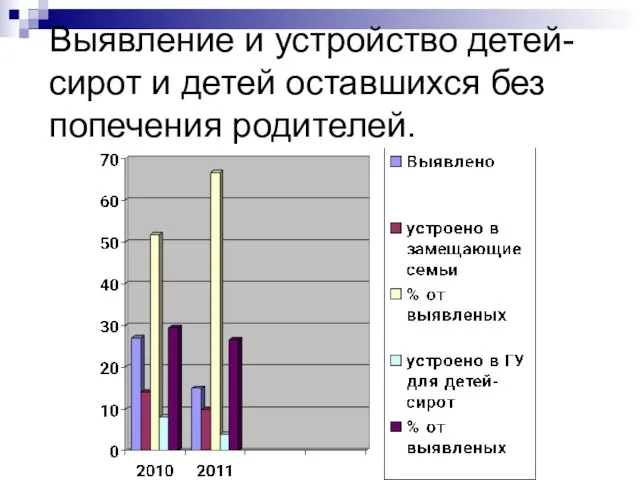 Выявление и устройство детей-сирот и детей оставшихся без попечения родителей.
Выявление и устройство детей-сирот и детей оставшихся без попечения родителей. Создание единого китайского государства
Создание единого китайского государства