Слайд 2Состав оснований. Классификация
1) По количеству гидроксогрупп
Ме(ОН)n где n=1,2,3
↙ ↓ ↘
MeOH
Me(OH)2 Me(OH)3
Число гидроксогрупп определяется степенью окисления металла
(+1) КОН, NaOH, (+2) Ca(OH)2, Ba(OH)2 (+3) Al(OH)3, Fe(OH)3
2)По растворимости в воде
Ме(ОН)n
↙ ↘
Сильные электролиты Слабые электролиты
Растворимые в воде(щелочи) нерастворимые в воде
(Основания активных Ме) ( Основания остальных Ме)
КОН, NaOH, Ca(OH)2, Ba(OH)2 Mg(OH)2, Cu(OH)2,Fe(OH)2
Слайд 4Химические свойства оснований
1)Растворы щелочей изменяют окраску индикаторов(см.таблица4,стр70)
NaOH→Na++OH- KOH→K++OH- Ba(OH)2→(записать ур-ие диссоциации)

Слайд 52)Взаимодействие оснований с кислотами
( общее свойство для растворимых и нерастворимых оснований)
а)

NaOH+HCl→NaCl+H2O –уравнение реакции нейтрализации
б) Cu(OH)2+2HNO3→Cu(NO3)2+2H2O
Слайд 8Свойства нерастворимых оснований

Слайд 9Закрепление: №3(в,д,е), стр162
Домашнее задание:
§39, конспект урока .№3(а,б,г), №5 стр162






 Влияние компьютерной системы с использованием sms-сообщений на контроль АД у больных артериальной гипертонией
Влияние компьютерной системы с использованием sms-сообщений на контроль АД у больных артериальной гипертонией CAREER OR FAMILY
CAREER OR FAMILY  Ремёсла восточных славян
Ремёсла восточных славян Немецкий шоколад торговой марки Lubeca (Германия)
Немецкий шоколад торговой марки Lubeca (Германия) Презентация на тему Технология моделирования в начальной школе
Презентация на тему Технология моделирования в начальной школе Светлое воскресение христово
Светлое воскресение христово М.В. Ломоносов как экономист и статистик
М.В. Ломоносов как экономист и статистик Describing people
Describing people  Дети капитана Гранта
Дети капитана Гранта Багълайыджылар
Багълайыджылар Дидактическое сопровождение и структура занятий с детьми дошкольного возраста.
Дидактическое сопровождение и структура занятий с детьми дошкольного возраста. Презентация на тему Творчество В. П. Крапивина в моем понимании «Какая–то тихая популярность!»
Презентация на тему Творчество В. П. Крапивина в моем понимании «Какая–то тихая популярность!»  Презентация на тему Образ Снегурочки в русском искусстве и литературе
Презентация на тему Образ Снегурочки в русском искусстве и литературе 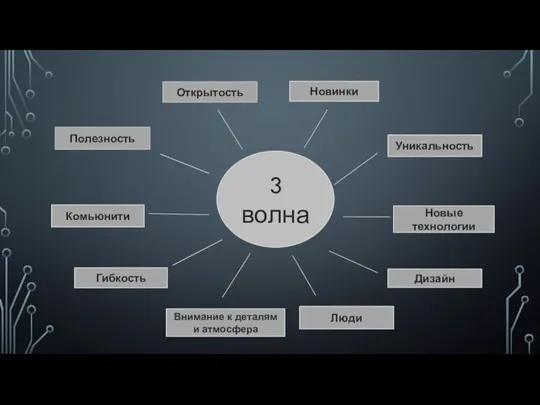 Необходимые навыки для создания компании 3 волны
Необходимые навыки для создания компании 3 волны Презентация на тему Жизнь вельможи
Презентация на тему Жизнь вельможи Презентация на тему Основы безопасности жизнедеятельности 11 класс
Презентация на тему Основы безопасности жизнедеятельности 11 класс  Нормативно-правовые акты, гарантирующие право получения детям с ограниченными возможностями здоровья адекватного их возможностя
Нормативно-правовые акты, гарантирующие право получения детям с ограниченными возможностями здоровья адекватного их возможностя Фундаментальный курс по стрижкам
Фундаментальный курс по стрижкам О путях развития информационно- вычислительных систем в области внегалактических исследований
О путях развития информационно- вычислительных систем в области внегалактических исследований Леса России
Леса России МОУ Андрейковская средняя школаВяземского района Смоленской области«Внедрение инновационных образовательных проектов в практ
МОУ Андрейковская средняя школаВяземского района Смоленской области«Внедрение инновационных образовательных проектов в практ ПСИХОЛОГО-ПЕДАГОГИЧЕСКОЕ СОПРОВОЖДЕНИЕ ВВЕДЕНИЯФГОС НОО
ПСИХОЛОГО-ПЕДАГОГИЧЕСКОЕ СОПРОВОЖДЕНИЕ ВВЕДЕНИЯФГОС НОО Қазіргі замандағы әлемдік діндер
Қазіргі замандағы әлемдік діндер Презентация на тему Ледники
Презентация на тему Ледники  Семинар
Семинар Основы радиосвязи
Основы радиосвязи Exploring space
Exploring space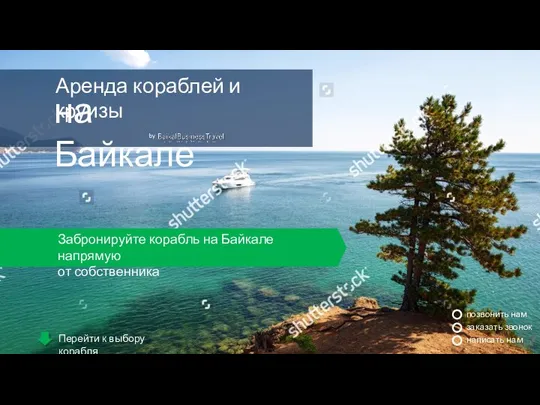 ТЗ на подготовку лендинга для круизов
ТЗ на подготовку лендинга для круизов