Содержание
- 2. Цель создания данной работы – показать возможности использования мультимедийных технологий и интерактивной доски на уроках химии.
- 3. ФОТОГРАФИИ ФРАГМЕНТОВ УРОКОВ С ИСПОЛЬЗОВАНИЕМ ИНТЕРАКТИВНОЙ ДОСКИ 10 класс «Углеводы» 9 класс «Металлы» 6 класс «Металлы
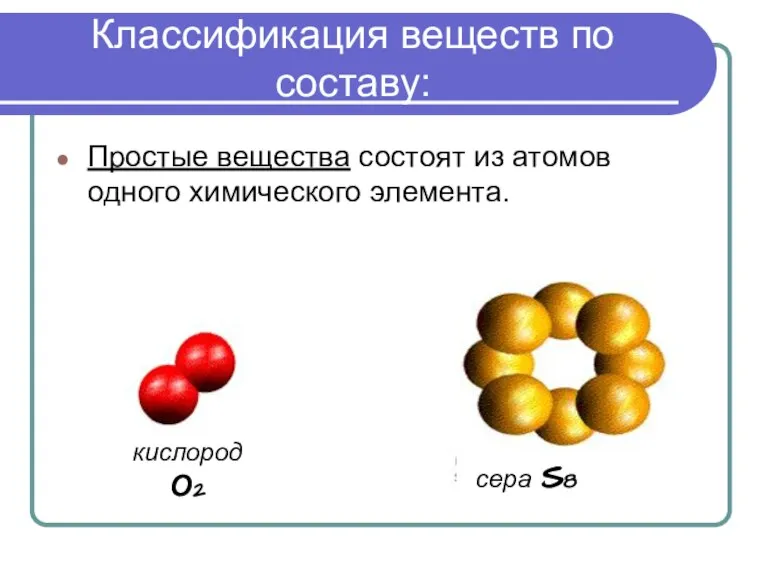
- 4. Классификация веществ по составу: Простые вещества состоят из атомов одного химического элемента. кислород О2 сера S8
- 5. Металлы. Алюминий Al
- 6. Металлы. Вольфрам W
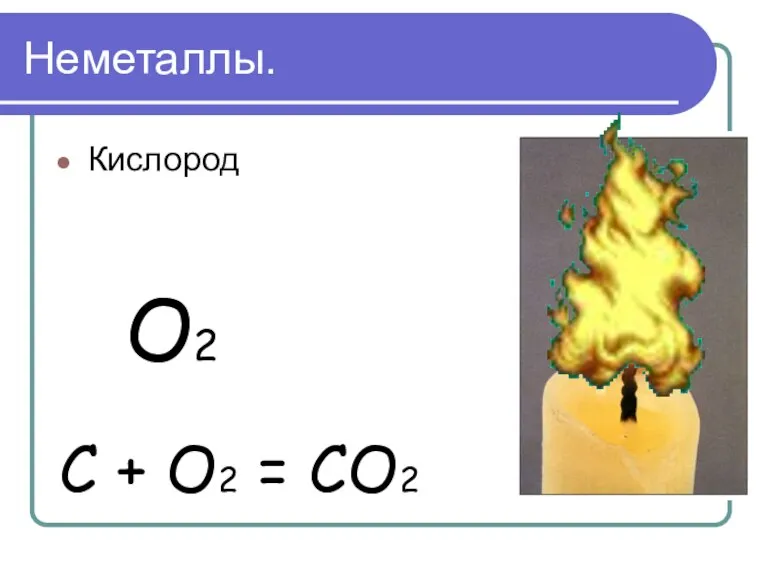
- 7. Неметаллы. Кислород O2 С + O2 = CO2
- 8. Неметаллы. Азот N2
- 9. ГОРЕНИЕ СТАЛЬНОЙ ПРОВОЛОКИ В КИСЛОРОДЕ Признак химической реакции: выделение тепла и света 3Fe+2O2=Fe3O4 Тип реакции: соединения
- 10. ПОЛУЧЕНИЕ КИСЛОРОДА РАЗЛОЖЕНИЕМ ОКСИДА РТУТИ Признак химической реакции: изменение цвета вещества с оранжевого на металлический 2HgO
- 11. ЗАДАНИЕ №4 Жилец из квартиры №26 решил помочь освободиться жильцу из квартиры №29 из его хлорида,
- 12. ЗАДАНИЕ №5 Царь зовет к себе Стрельца - удалого молодца И дает ему поручение государственного значения:
- 13. ЗАДАНИЕ №6 О каких веществах идет речь в отрывке из стихотворения С.Щипачева «Читая Менделеева»? Подчеркните в
- 14. ЗАДАНИЕ №7 Расставьте коэффициенты в уравнениях реакции. Назовите вещества. Укажите тип реакций. 1.Cu + O2 →
- 15. Составьте уравнения реакций по названию веществ. Расставьте коэффициенты. Укажите тип реакций 1. Цинк + хлорид водорода
- 16. ОКСИДЫ ВОДА ОКСИД ВОДОРОДА H2O
- 17. ОКСИДЫ БУРЫЙ ГАЗ ОКСИД АЗОТА (IV) NO2
- 18. ХЛОРИДЫ Поваренная соль ХЛОРИД НАТРИЯ NaCl
- 19. СУЛЬФИДЫ КИНОВАРЬ СУЛЬФИД РТУТИ (II) HgS
- 21. Скачать презентацию
















 Системы лояльности: современные тенденции развития
Системы лояльности: современные тенденции развития Теорема Виета доказательство
Теорема Виета доказательство Словообразовательные гнёзда полисемантичных имён существительных в русском и белорусском языках
Словообразовательные гнёзда полисемантичных имён существительных в русском и белорусском языках СМАЗКИ КАНАТНЫЕ
СМАЗКИ КАНАТНЫЕ Приемы рисования геометрических фигур
Приемы рисования геометрических фигур Metal-Insulator-Semiconductor and Metal-Insulator-Metal Structures
Metal-Insulator-Semiconductor and Metal-Insulator-Metal Structures "Я ЛЮБЛЮ ТЕБЯ,РОССИЯ!" Игра "Звездный час" (для учащихся 3-4классов)
"Я ЛЮБЛЮ ТЕБЯ,РОССИЯ!" Игра "Звездный час" (для учащихся 3-4классов) Три кита в музыке
Три кита в музыке Сбор изображений для тренировки системы распознавания номеров машин
Сбор изображений для тренировки системы распознавания номеров машин Презентация на тему Состав ядра. Ядерные силы (11 класс)
Презентация на тему Состав ядра. Ядерные силы (11 класс) Понятие мотивации. Мотивация по Риссу. Нейрологические уровни Дилтса. Модель ценностей Грейвза
Понятие мотивации. Мотивация по Риссу. Нейрологические уровни Дилтса. Модель ценностей Грейвза Финансовая политика РФ
Финансовая политика РФ Дециметр
Дециметр Материки и океаны
Материки и океаны Конституционное право - ведущая отрасль в правовой системе Российской Федерации. Лекция 1
Конституционное право - ведущая отрасль в правовой системе Российской Федерации. Лекция 1 Александр Родченко
Александр Родченко Спектры.Спектральный анализОткрытый урок
Спектры.Спектральный анализОткрытый урок Лепка фигуры человека
Лепка фигуры человека ОПСиП_ Семенова ПО-3
ОПСиП_ Семенова ПО-3 Градусная сеть на глобусе и географической карте
Градусная сеть на глобусе и географической карте Международный Юридический институт приглашает всех желающих на День Открытых дверей!
Международный Юридический институт приглашает всех желающих на День Открытых дверей! Страхование непредвиденных расходов автовладельцев полис «РЕСОавто ПОМОЩЬ»
Страхование непредвиденных расходов автовладельцев полис «РЕСОавто ПОМОЩЬ» Бюджет доходов и расходов БДР/P&L
Бюджет доходов и расходов БДР/P&L Лексика
Лексика אילו המצאות חדשות הומצאו בישראל ובעולם ?במאה ה?21 -במה תרומתם לאנושות
אילו המצאות חדשות הומצאו בישראל ובעולם ?במאה ה?21 -במה תרומתם לאנושות Главные и второстепенные члены предложения
Главные и второстепенные члены предложения Основные причины ухудшения зрения школьника
Основные причины ухудшения зрения школьника Качество и качества Власти: восприятие населения
Качество и качества Власти: восприятие населения