Содержание
- 2. План: Общая характеристика Общая характеристика VI-Общая характеристика VI-а подгруппы Сера Сероводород и сульфиды Оксиды серы Оксид
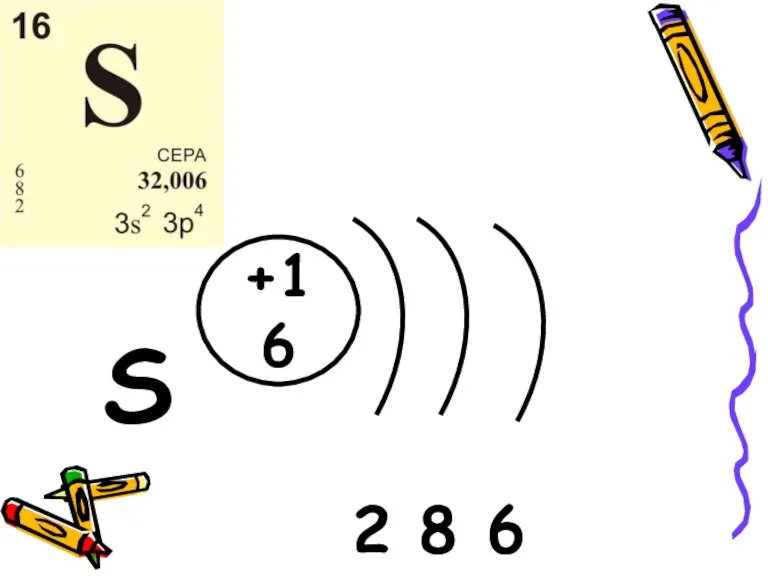
- 3. S 2 8 6 +16
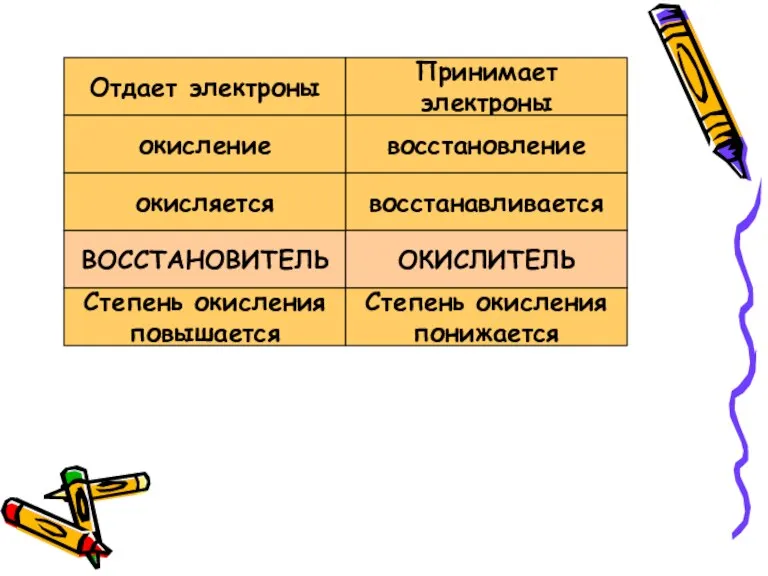
- 4. Отдает электроны Принимает электроны ВОССТАНОВИТЕЛЬ восстанавливается ОКИСЛИТЕЛЬ окисляется восстановление окисление Степень окисления повышается Степень окисления понижается
- 5. Строение атома На внешнем электронном слое у атома серы шесть электронов. Взаимодействуя с менее электроотрицательными элементами
- 6. По отношению к металлам, водороду и менее электроотрицательным неметаллам сера является окислителем со степенью окисления -2.
- 7. По отношению к фтору, кислороду, более электроотрицательным неметаллами, сложным веществам – сера является восстановителем Окислительно-востановительные свойства
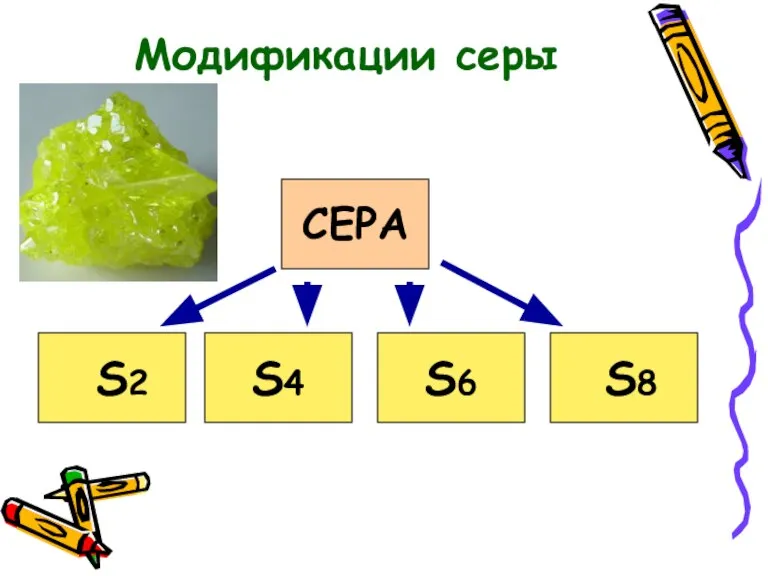
- 8. СЕРА S2 S8 S6 S4 Модификации серы
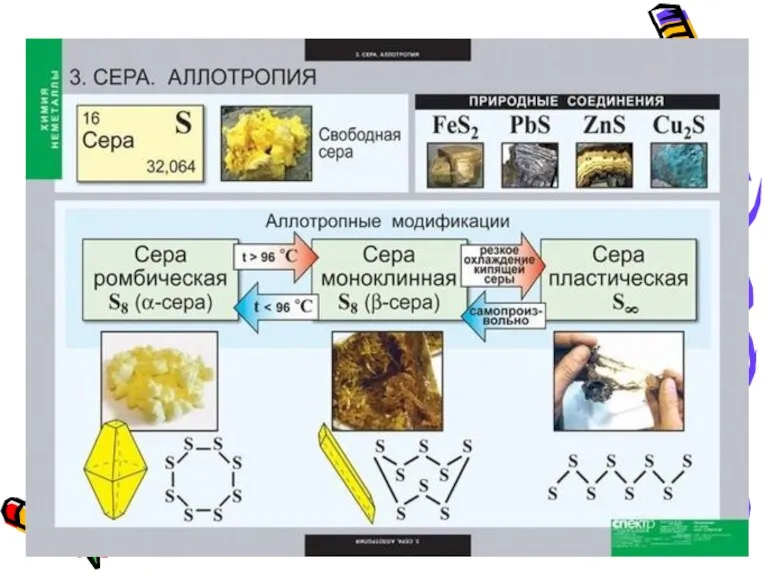
- 10. В обычных условиях это кристаллы так называемой ромбической модификации. Аллотропные модификации серы.
- 11. Известно несколько аллотропных модификаций серы. До температуры 150°C молекула серы имеет циклическую форму. Это кольцо из
- 12. Химическая связь – ковалентная неполярная 2. Кристаллическая решетка – молекулярная Температуры плавления и кипения – низкие
- 13. В воде сера не растворяется (всплывает), растворима в органических растворителях. Физические свойства
- 14. При обычных условиях: Hg + S =HgS Процесс ДЕМЕРКУРИЗАЦИИ Химические свойства
- 15. Сера взаимодействует со многими металлами, образуя сульфиды: S + Fe = FeS Ок-ль 2Al + 3S
- 16. При нагревании сера реагирует с водородом, образуя сероводород: S + Н2 = H2S Химические свойства
- 17. Из неметаллов только азот и йод не соединяются с серой. Сжигание серы в струе кислорода приводит
- 18. Элементарная сера может также проявлять восстановительные свойства: S + 2HNO3 = H2SO4 + 2NO Химические свойства
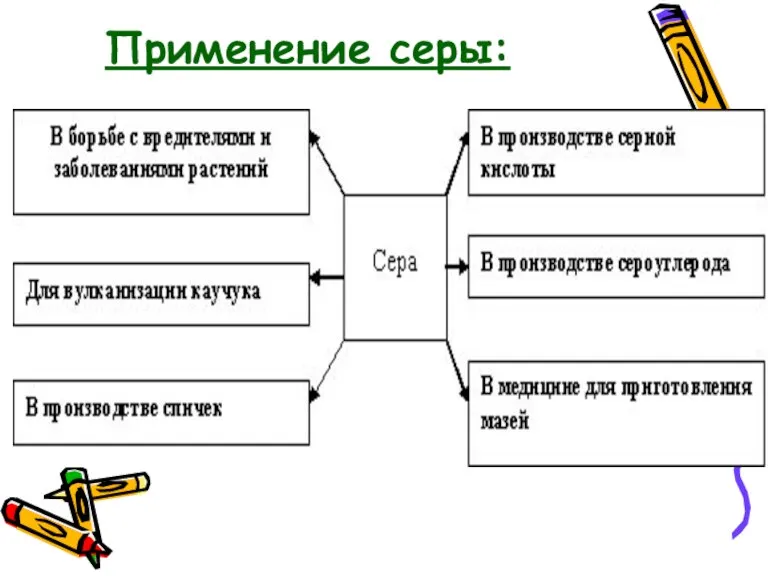
- 20. Применение серы:
- 21. Домашнее задание: § 21 упр. 3
- 23. Скачать презентацию














 Строим город
Строим город Презентация на тему Числовые выражения 6-7 класс
Презентация на тему Числовые выражения 6-7 класс  История теплохода Юнга Камы
История теплохода Юнга Камы ПРОЦЕНТЫ
ПРОЦЕНТЫ Развитие проекта Кадры в сфере туризма на территории ФГБУ Заповедное Прибайкалье.
Развитие проекта Кадры в сфере туризма на территории ФГБУ Заповедное Прибайкалье. Конкурс туристских узлов
Конкурс туристских узлов АМЕРИКАНСКИЙ И БРИТАНСКИЙ АНГЛИЙСКИЙ.
АМЕРИКАНСКИЙ И БРИТАНСКИЙ АНГЛИЙСКИЙ. Коммерческая деятельность
Коммерческая деятельность Организация процесса приготовления и приготовление блюда Утка в вине с инжиром в соусе дегляссе
Организация процесса приготовления и приготовление блюда Утка в вине с инжиром в соусе дегляссе Театральные профессии
Театральные профессии Стратегическое планирование деятельности агрохимических компаний
Стратегическое планирование деятельности агрохимических компаний Презентация на тему Мир глазами географа
Презентация на тему Мир глазами географа Модель профессионального стандарта педагога с позиций системы деятельности
Модель профессионального стандарта педагога с позиций системы деятельности The culture in XIX century
The culture in XIX century Дом 100 м2 на участке от 4 соток в Краснодаре или Адыгеи. Ремонт в подарок
Дом 100 м2 на участке от 4 соток в Краснодаре или Адыгеи. Ремонт в подарок Виды сопряжений в чертежах
Виды сопряжений в чертежах Провалы в земле
Провалы в земле Инновационное развитие России: базовые проблемы Дмитрий Гришанков Рейтинговое Агентство «Эксперт РА»
Инновационное развитие России: базовые проблемы Дмитрий Гришанков Рейтинговое Агентство «Эксперт РА» Ответы на задания к блоку Я конструирую
Ответы на задания к блоку Я конструирую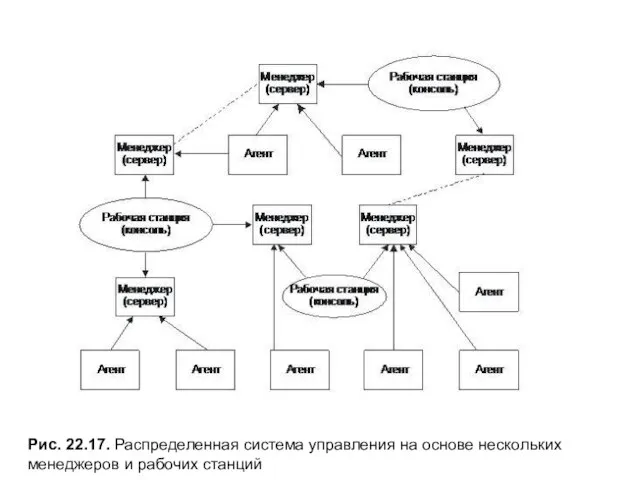 Рис. 22.17. Распределенная система управления на основе нескольких менеджеров и рабочих станций
Рис. 22.17. Распределенная система управления на основе нескольких менеджеров и рабочих станций Северное возрождение. (Часть 1)
Северное возрождение. (Часть 1) Эпикурейцы и стоики
Эпикурейцы и стоики Презентация Microsoft PowerPoint1 (1)
Презентация Microsoft PowerPoint1 (1) Деньги, налогообложение на Руси
Деньги, налогообложение на Руси  Религиозный туризм в Беларуси
Религиозный туризм в Беларуси Первичные сигналы
Первичные сигналы Презентация на тему Класс однодольные. Общая характеристика
Презентация на тему Класс однодольные. Общая характеристика  Data Marketin. Предоставляем в аренду дополнительные места
Data Marketin. Предоставляем в аренду дополнительные места