Содержание
- 2. Физические свойства серной кислоты Серная кислота - бесцветная едкая тяжелая маслообразная жидкость без запаха, плотность 1,84г/см3,
- 3. Концентрированная серная кислота очень бурно реагирует с водой. По этой причине следует всегда разбавлять серную кислоту,
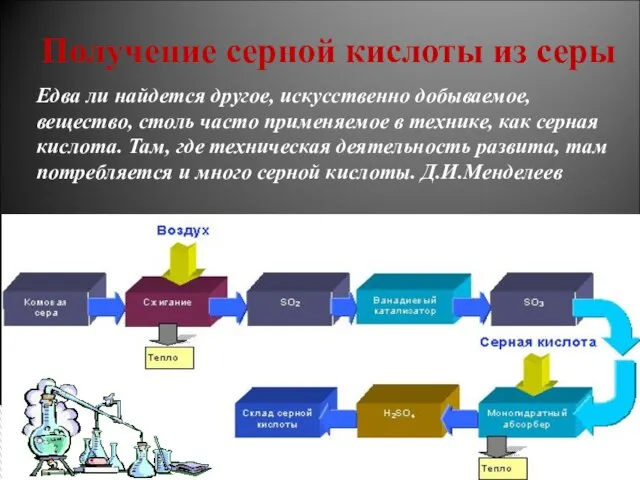
- 4. Получение серной кислоты из серы Едва ли найдется другое, искусственно добываемое, вещество, столь часто применяемое в
- 5. Серная кислота в природе Вулкан Мутновский находится в 80 км от города Петропавловск-Камчатский. В нижней части
- 6. В последнее время серная кислота стала чаще попадать в природу по вине человека в связи с
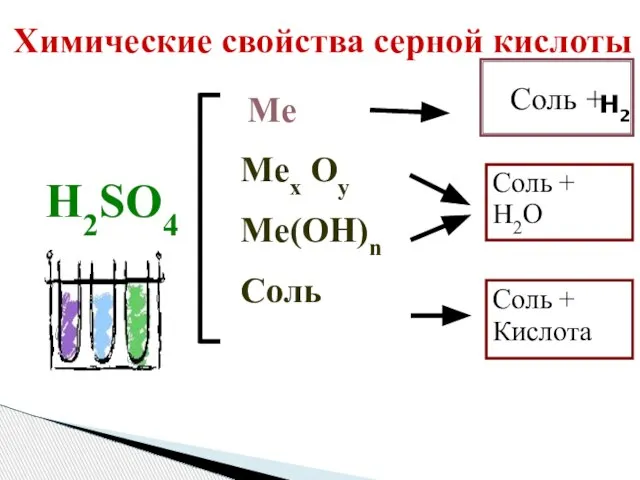
- 7. Химические свойства серной кислоты H2SO4 Mex Oy Me(OH)n Соль Соль + H2O Соль + Кислота Ме
- 8. Химические свойства серной кислоты 1.изменяет окраску индикаторов: http://www.alhimikov.net/video/neorganika/menu.html метилоранж-розовая окраска лакмус-красная окраска 2. взаимодействует с металлами
- 9. Химические свойства серной кислоты 1. Гигроскопичность – способность впитывать воду. 2. С неметаллами C+2H2SO4= CO2↑ +2SO2
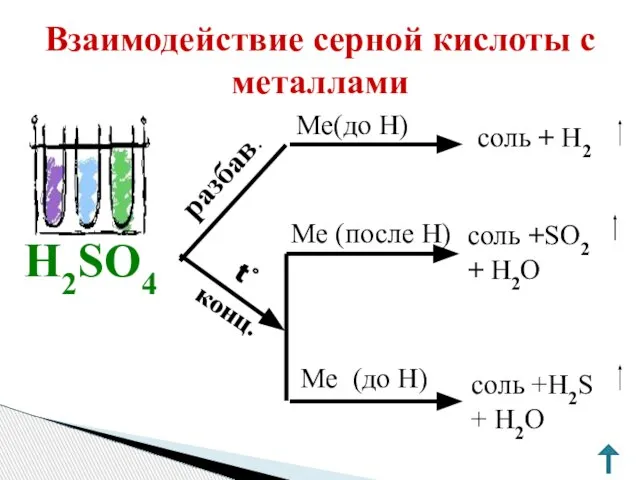
- 10. Взаимодействие серной кислоты с металлами Ме(до Н) Ме (до H) Ме (после Н) H2SO4 соль +H2S
- 11. Применение серной кислоты и её солей В качестве электролита Производство искусственного шёлка Производство минеральных удобрений Производство
- 12. Применение солей серной кислоты
- 13. В двух одинаковых сосудах без этикеток налиты равные объёмы разбавленной и концентрированной серной кислоты. Предложите простейший
- 14. 1.анимация с химическими приборами http://chemworld.narod.ru/main/shutyat.gif 2. http://5ballov.qip.ru/tests/images/21/211_front.jpg 3. картинки на тему серная кислота http://images.yandex.ru/#!/yandsearch?source=wiz&uinfo=sw-1349-sh-650-fw-1124-fh-448-pd-1&p=4&text=картинки на тему
- 16. Скачать презентацию










 Чарующие звуки музыки
Чарующие звуки музыки Диены
Диены В каких стилях русского языка чаще всего встречаются речевые ошибки ? Чаще всего речевые ошибки встречаются в разговорном и Чаще в
В каких стилях русского языка чаще всего встречаются речевые ошибки ? Чаще всего речевые ошибки встречаются в разговорном и Чаще в University of my dream
University of my dream Моя будущая профессия
Моя будущая профессия Синдром дефицита внимания и гиперактвиность
Синдром дефицита внимания и гиперактвиность Презентация на тему Приглашение к чтению Е.И. Чрушина и его творчества
Презентация на тему Приглашение к чтению Е.И. Чрушина и его творчества СОВРЕМЕННЫЕ СИСТЕМЫ ЗАЩИТЫ И АВТОМАТИЗАЦИИ НА МНОГОЦЕПНЫХ ЛИНИЯХ ЭЛЕКТРОПЕРЕДАЧИ СВЕРХВЫСОКОГО НАПРЯЖЕНИЯ Янез Законьшек ЗАО «
СОВРЕМЕННЫЕ СИСТЕМЫ ЗАЩИТЫ И АВТОМАТИЗАЦИИ НА МНОГОЦЕПНЫХ ЛИНИЯХ ЭЛЕКТРОПЕРЕДАЧИ СВЕРХВЫСОКОГО НАПРЯЖЕНИЯ Янез Законьшек ЗАО « Санитарно-эпидемиологические требования к условиям и организации обучения в общеобразовательных учреждениях
Санитарно-эпидемиологические требования к условиям и организации обучения в общеобразовательных учреждениях РасширениеMS Visual Studio 2005с использованиемIntel® C++ IDE Automation
РасширениеMS Visual Studio 2005с использованиемIntel® C++ IDE Automation Растения играют большую роль в жизни животных и человека кислород пища лекарство убежище ткани древесина.
Растения играют большую роль в жизни животных и человека кислород пища лекарство убежище ткани древесина. Переработка попутного нефтяного газа – эффективное использование невозобновляемого источника природных ресурсов РФ
Переработка попутного нефтяного газа – эффективное использование невозобновляемого источника природных ресурсов РФ Банная станция
Банная станция Утилизация теплоты
Утилизация теплоты Бюджетное устройство и бюджетная система
Бюджетное устройство и бюджетная система Глаза животных 3 класс
Глаза животных 3 класс Термическая обработка
Термическая обработка Деловой стиль одежды
Деловой стиль одежды Феварин (флувоксамин) в амбулаторном лечении алкогольной зависимости, осложненной психическими расстройствами
Феварин (флувоксамин) в амбулаторном лечении алкогольной зависимости, осложненной психическими расстройствами Zaadachi_3_klass
Zaadachi_3_klass Охрана атмосферы города от газовых выбросов промышленных предприятий
Охрана атмосферы города от газовых выбросов промышленных предприятий Презентация на тему Косыночные повязки
Презентация на тему Косыночные повязки  Еврейская культура. Еврейские праздники
Еврейская культура. Еврейские праздники Портрет
Портрет ПЛАТФОРМА ВАШЕГО УСПЕХА
ПЛАТФОРМА ВАШЕГО УСПЕХА Процессы приготовления, подготовки к реализации и презентации холодных блюд, кулинарных изделий, закусок
Процессы приготовления, подготовки к реализации и презентации холодных блюд, кулинарных изделий, закусок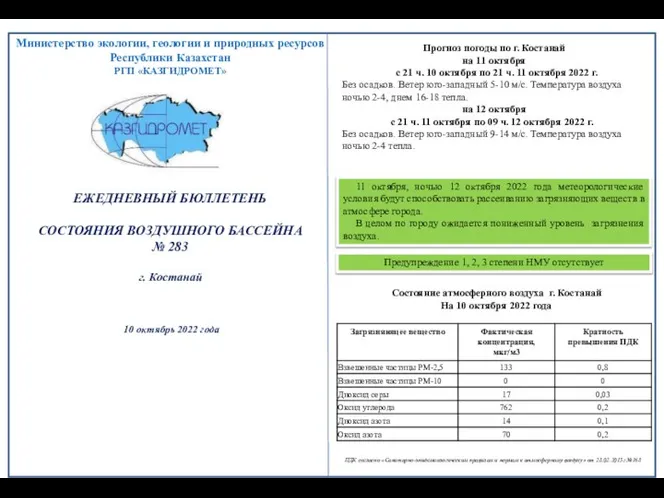 6343f139f10cakostanay-nmu-10-10-22-1
6343f139f10cakostanay-nmu-10-10-22-1 Характеристика аффективно - потребностной сферы школьников, испытывающих трудности в обучении
Характеристика аффективно - потребностной сферы школьников, испытывающих трудности в обучении