Содержание
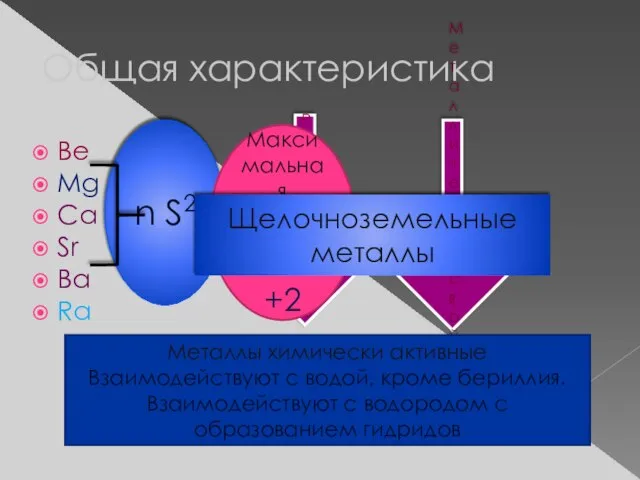
- 2. Общая характеристика Be Mg Ca Sr Ba Ra Радиус атома Металлические свойства n S2 Максимальная степень
- 3. Бериллий Бериллий сходствует с алюминием и магнием…Получил своё название потому, что находится в минерале берилле. Металл
- 4. Распространение в природе Берилл 3Be * Al2O3 *6SiO2 Хризоберилл BeAl2O4 Изумруд Аквамарин Александрит аквамарин александрит изумруд
- 5. Получение В виде простого вещества бериллий получили в 1828году немецкий учёный Фридрих Вёлер и французский химик
- 6. BeF2+Mg=Be+MgF2 В настоящее время бериллий получают, восстанавливая его фторид магнием, либо электролизом расплава смеси хлоридов бериллия
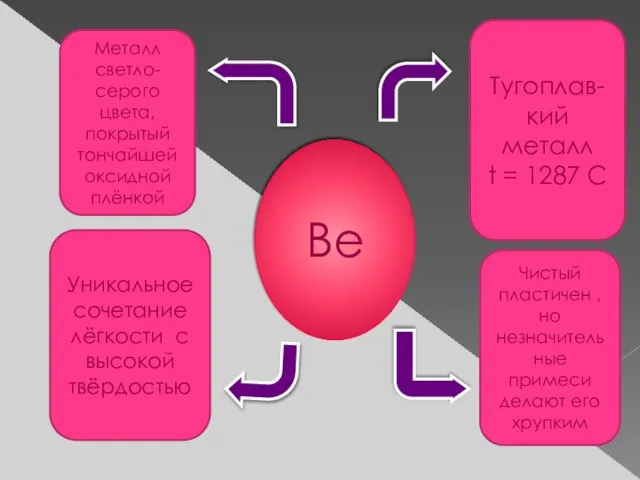
- 7. Be Металл светло-серого цвета, покрытый тончайшей оксидной плёнкой Тугоплав- кий металл t = 1287 C Уникальное
- 8. Химические свойства Обладая высокой химической активностью бериллий вступает в реакции с галогенами, серой и азотом. Вода
- 9. Магний Магний был открыт при анализе воды из минерального источника вблизи города Эпсом в Англии. Горькая
- 10. Поучение Впервые магний был получен в 1808г Гемфри Деви при электролизе влажной магнезии . По его
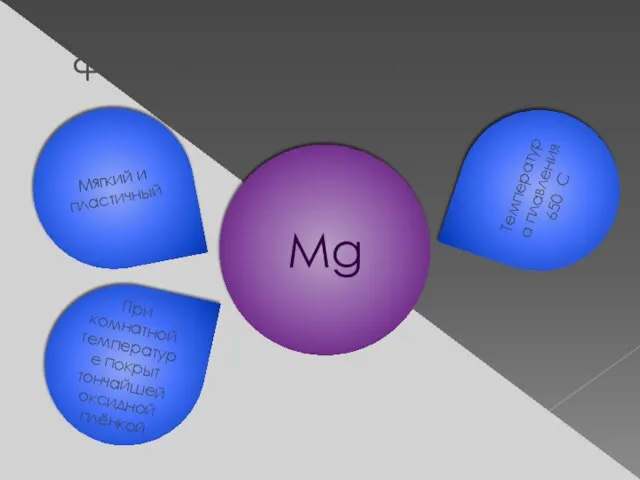
- 11. Физические свойства Мягкий и пластичный При комнатной температуре покрыт тончайшей оксидной плёнкой Температура плавления 650 С
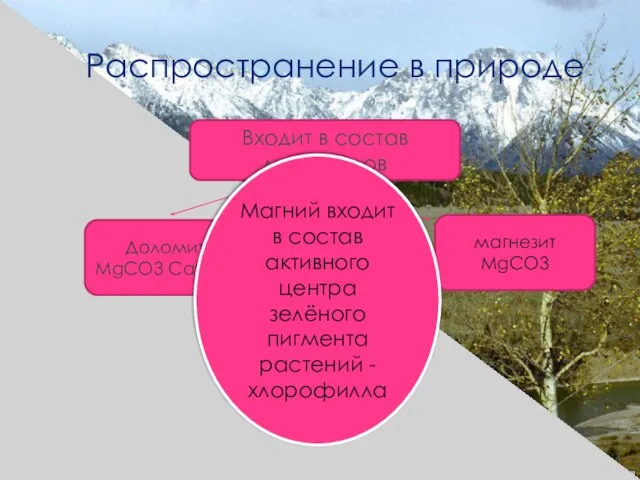
- 12. Распространение в природе Входит в состав минералов магнезит MgCO3 Доломит MgCO3 CaCO3 Магний входит в состав
- 13. Химические свойства Горение на воздухе 2Mg+ O2=2MgO При комнатной температуре не взаимодействует с водой, лишь при
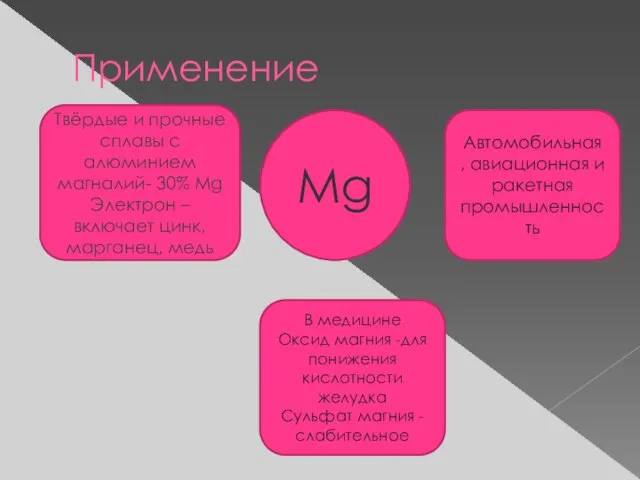
- 14. Применение Mg Твёрдые и прочные сплавы с алюминием магналий- 30% Mg Электрон –включает цинк, марганец, медь
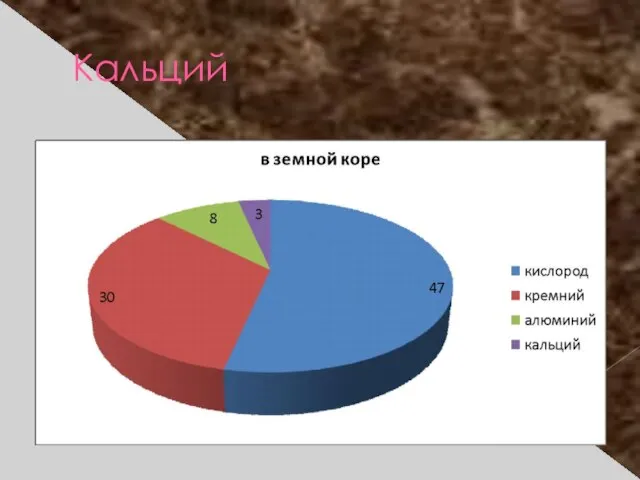
- 15. Кальций
- 16. Распространение в природе Гипс CaSO4 2H2O Флюорит CaF2 апатит Ca5(PO4)3(OH) мел, мрамор, известняк CaCO3
- 17. Получение Металлический кальций был получен в 1808 году при электролизе смеси влажной гашёной извести с оксидом
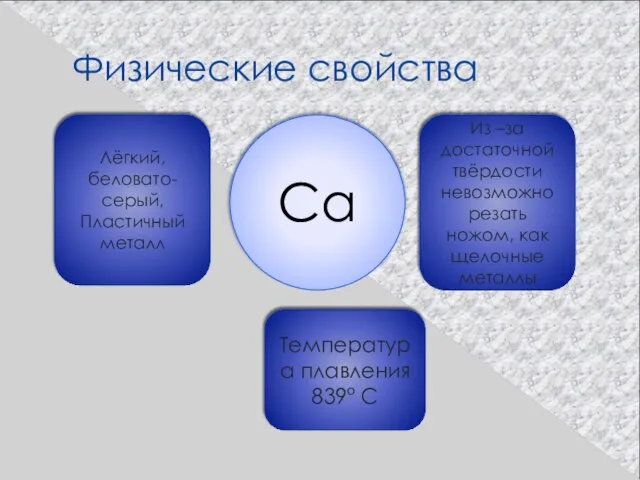
- 18. Физические свойства Ca Лёгкий, беловато-серый, Пластичный металл Из –за достаточной твёрдости невозможно резать ножом, как щелочные
- 19. Химические свойства С простыми веществами Ca+H2=CaH2 Ca+Cl2=CaCl2 3Ca+N2=Ca3N2 Кирпично-красное пламя 2Ca+O2=2CaO
- 20. Химические свойства Со сложными веществами Ca+2NH3=Ca(NH2)2 +H2 Ca+2H2O=Ca(OH)2+H2 Ca+2HCl=CaCl2+H2 любая кислота кроме азотной
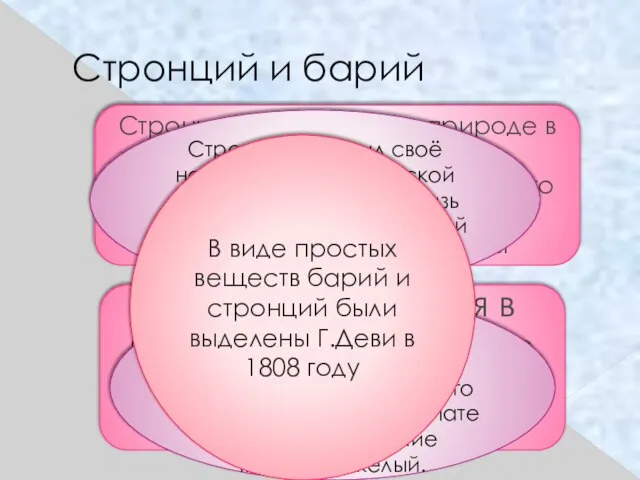
- 21. Стронций и барий Стронций встречается в природе в виде минерала целестина-сульфата стронция образующего красивые розово-красные или
- 22. Применение Соединения кальция, стронция и бария применяют в разных отраслях промышленности и строительстве. Соединения стронция(нитрат, карбонат
- 24. Скачать презентацию













 Поколение молодости REV 7-2014
Поколение молодости REV 7-2014 Взаимодействие агентов в многоагентных системах
Взаимодействие агентов в многоагентных системах ФАКТОГРАФИЧЕСКИЕ БАЗЫ ДАННЫХ НАЦИОНАЛЬНОЙ БИБЛИОТЕКИ БЕЛАРУСИ КАК ИСТОЧНИК ИНФОРМАЦИИ О НАЦИОНАЛЬНЫХ ОБЪЕКТАХ Кузьминич Т. Нац
ФАКТОГРАФИЧЕСКИЕ БАЗЫ ДАННЫХ НАЦИОНАЛЬНОЙ БИБЛИОТЕКИ БЕЛАРУСИ КАК ИСТОЧНИК ИНФОРМАЦИИ О НАЦИОНАЛЬНЫХ ОБЪЕКТАХ Кузьминич Т. Нац Филиппова Елена Константиновна – учитель Филиппова Елена Константиновна – учитель русского языка и литературы Квалификационная
Филиппова Елена Константиновна – учитель Филиппова Елена Константиновна – учитель русского языка и литературы Квалификационная Новости недели. Новосибирск
Новости недели. Новосибирск Художники Сенгилеевского района
Художники Сенгилеевского района ПрезентацияРаздел 2.2
ПрезентацияРаздел 2.2 Международные модели управления персоналом
Международные модели управления персоналом Цели внедрения системы бюджетирования
Цели внедрения системы бюджетирования Деление плоскости на четыре части, в зарисовке
Деление плоскости на четыре части, в зарисовке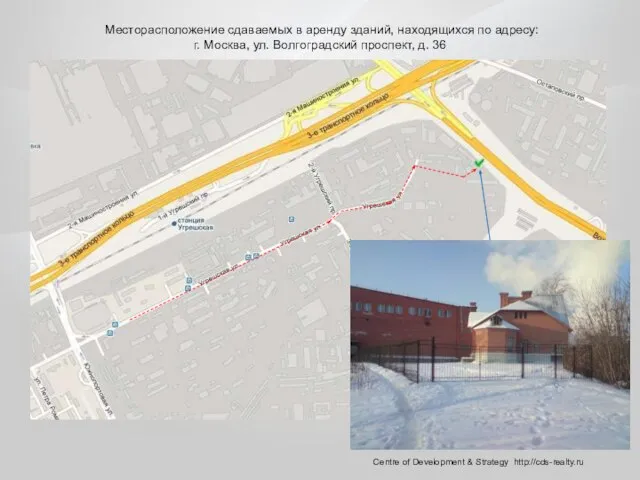 Месторасположение сдаваемых в аренду зданий, находящихся по адресу: г. Москва, ул. Волгоградский проспект, д. 36
Месторасположение сдаваемых в аренду зданий, находящихся по адресу: г. Москва, ул. Волгоградский проспект, д. 36 Филимоновская игрушка. Фотоотчет
Филимоновская игрушка. Фотоотчет Фридрих Шиллер
Фридрих Шиллер Презентация на тему Особые экономические зоны стран мира
Презентация на тему Особые экономические зоны стран мира  Фотоэлектрические модули. (Лекция 5)
Фотоэлектрические модули. (Лекция 5) The Victorian Era 1837 -1901
The Victorian Era 1837 -1901 Династический кризис 1825 г. Выступление декабристов
Династический кризис 1825 г. Выступление декабристов ВЕЛИКАЯ ОТЕЧЕСТВЕННАЯ ВОЙНА СОВЕТСКОГО СОЮЗА.
ВЕЛИКАЯ ОТЕЧЕСТВЕННАЯ ВОЙНА СОВЕТСКОГО СОЮЗА. Электронное взаимодействие между организациями ислужбой занятости населения
Электронное взаимодействие между организациями ислужбой занятости населения Порядок подачи заявления о преступлении
Порядок подачи заявления о преступлении Избушка
Избушка Сказочный мир Шарля Перро
Сказочный мир Шарля Перро ПОП-АРТ
ПОП-АРТ Осенние поделки
Осенние поделки Управление эмоциями
Управление эмоциями КОТЕЛЬНАЯ 4 Х 15 МВт
КОТЕЛЬНАЯ 4 Х 15 МВт Основные этапы разработки ООП
Основные этапы разработки ООП «Свирель серебряного века»
«Свирель серебряного века»