Содержание
- 2. Щелочны́е мета́ллы — элементы главной подгруппы первой группы Периодической Системы. Название связано с тем, что при
- 3. Получение щелочных металлов Щелочные металлы всегда находятся в соединениях в виде положительно заряженных ионов. Так как
- 4. История открытия Литий Натрий Рубидий Калий Цезий Франций
- 5. Физические свойства Щелочные металлы – серебристо-белые вещества, кроме цезия, который имеет золотистый цвет. Мягкие, с низкими
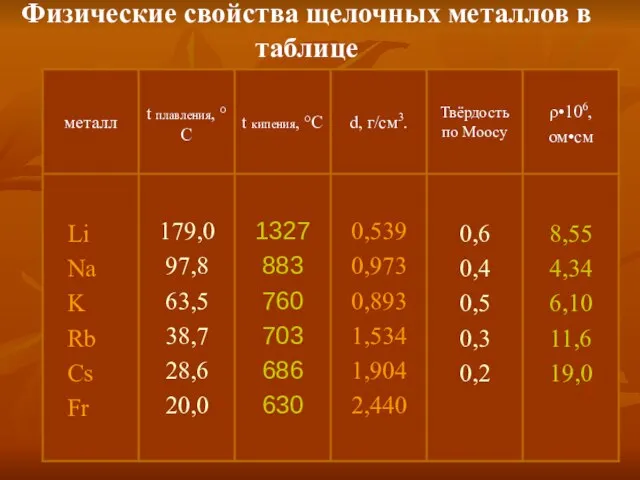
- 6. Физические свойства щелочных металлов в таблице
- 7. Оксиды и гидроксиды щелочных металлов Оксиды Гидроксиды Оксид лития Оксид натрия
- 8. Реагирование с водой Характерная черта щелочных металлов – очень активная, до горения и взрыва, реакция с
- 9. Презентацию подготовили Бернштейн Антон – главный научный редактор Пирожков Виктор – технический редактор Материал собрали: Маслацов
- 10. Литий Литий был открыт в 1817 шведским химиком А. Арфведсоном в минерале петалите; название от греч.
- 11. Натрий Природные соединения Натрия — поваренная соль NaCl, сода Na2CO3 — известны с глубокой древности. Название
- 12. Рубидий Рубидий открыли в 1861 Р. Бунзен и Г. Кирхгоф при спектральном исследовании солей, выделенных из
- 13. Калий Некоторые соединения Калия (например, поташ, добывавшийся из древесной золы) были известны уже в древности; однако
- 14. Цезий Цезий открыт в 1860 Р. В. Бунзеном и Г. Р. Кирхгофом в водах Дюркхеймского минерального
- 15. Франций Существование и главные свойства самого тяжёлого аналога щелочных металлов были предсказаны Д. И. Менделеевым в
- 16. Оксиды Оксиды щелочных металлов – соединения их с О вида Ме2О: О2- О2- Na+ Na+ Li+
- 17. Образование оксидов Оксид лития образуется при реакции лития с кислородом: 4Li + O2=2Li2O (t) Образование остальных
- 18. Гидроксиды Гидроксиды щелочных металлов, кроме Li, термостойки и не разрушаются от температуры. Гидроксиды реагируют с Кислотами
- 19. Образование гидроксидов Обратная реакция: оксид+вода=гидроксид K2O + H2O= 2KOH Гидроксиды щелочных металлов – соединения их с
- 20. Реакции с кислотами 2KOH + H2SO4 = K2SO4 + 2H2O соль +вода Хлорид калия
- 21. Реакции с солями 2NaOH + CuSO4 Cu(OH)2 + Na2SO4 нерастворимое основание + соль Горение щелочных металлов
- 23. Скачать презентацию



















 Дидактическое электронное пособие Получи цветочек от Зайца Цель: обучающиеся должны знать названия и обозначения действий сло
Дидактическое электронное пособие Получи цветочек от Зайца Цель: обучающиеся должны знать названия и обозначения действий сло Права нужны, а обязанности важны
Права нужны, а обязанности важны Подготовила учитель начальных классов МОУ СОШ № 9 Романова Ирина Анатольевна
Подготовила учитель начальных классов МОУ СОШ № 9 Романова Ирина Анатольевна Город сегодня и завтра. Тенденции и перспективы развития современной архитектуры
Город сегодня и завтра. Тенденции и перспективы развития современной архитектуры Телескопы
Телескопы Etude pratique et surprenante de l'Institut Pasteur
Etude pratique et surprenante de l'Institut Pasteur Контроль за продольным перемещением плетей. Особенности содержания бесстыкового железнодорожного пути
Контроль за продольным перемещением плетей. Особенности содержания бесстыкового железнодорожного пути Правовое обеспечение контроля и надзора за деятельностью ОВД. Тема 2
Правовое обеспечение контроля и надзора за деятельностью ОВД. Тема 2 Нарушение международного гуманитарного права во время Первой мировой войны
Нарушение международного гуманитарного права во время Первой мировой войны Психика человека: сущность, структура, функции в жизнедеятельности человека
Психика человека: сущность, структура, функции в жизнедеятельности человека Healthy paradise - Здоровый рай
Healthy paradise - Здоровый рай Административное правотношение, 9 класс
Административное правотношение, 9 класс Основы инженерной графики
Основы инженерной графики Введение в историю
Введение в историю Законнар кайда туа
Законнар кайда туа Презентация на тему Антигитлеровская коалиция 1942-1945
Презентация на тему Антигитлеровская коалиция 1942-1945 Крестьянские избы Дом Сергина 1884 год деревня Мунозеро.
Крестьянские избы Дом Сергина 1884 год деревня Мунозеро. «Нестандартный маркетинг частной школы»
«Нестандартный маркетинг частной школы» Презентация на тему Беседа об этикете поведения детей и взрослых
Презентация на тему Беседа об этикете поведения детей и взрослых Тест по литературе в 6 классе: Иван Сергеевич Тургенев "Муму"
Тест по литературе в 6 классе: Иван Сергеевич Тургенев "Муму" Заседание межведомственного совета по образованию при главе администрации Лужского муниципального района ПОВЕСТКА ДНЯ1. Отчет
Заседание межведомственного совета по образованию при главе администрации Лужского муниципального района ПОВЕСТКА ДНЯ1. Отчет  Knopki3_okonch (1)
Knopki3_okonch (1) Исследование молодежных конфликтов и пути их разрешения
Исследование молодежных конфликтов и пути их разрешения Презентация на тему Опустынивание
Презентация на тему Опустынивание  Большая стирка
Большая стирка Путешествуем с Азбукой
Путешествуем с Азбукой Интегрированная распределенная система информационного обмена результатами тестирования
Интегрированная распределенная система информационного обмена результатами тестирования ПРЕДОСТАВЛЕНИЕ ГОСУДАРСТВЕННОЙ ПОДДЕРЖКИ В СФЕРЕ НАУЧНОЙ, НАУЧНО-ТЕХНИЧЕСКОЙ И ИННОВАЦИОННОЙ ДЕЯТЕЛЬНОСТИ
ПРЕДОСТАВЛЕНИЕ ГОСУДАРСТВЕННОЙ ПОДДЕРЖКИ В СФЕРЕ НАУЧНОЙ, НАУЧНО-ТЕХНИЧЕСКОЙ И ИННОВАЦИОННОЙ ДЕЯТЕЛЬНОСТИ