СИСТЕМА РЕГИСТРАЦИИ НОВЫХ ПРЕПАРАТОВ ДЛЯ IN VITRO ДИАГНОСТИКИ: СРАВНЕНИЕ РОССИЙСКОГО И МИРОВОГО ОПЫТА
Содержание
- 2. «Новый подход» к технической гармонизации Для медицинских изделий существуют три группы Директив, которые содержат исчерпывающие определения
- 3. Директивы устанавливают "существенные требования" к безопасности, проектированию и изготовлению ИМН, которым они должны отвечать при производстве
- 4. За оценку соответствия несут ответственность непосредственно изготовители или их уполномоченные представители, а также, более редко, специальные
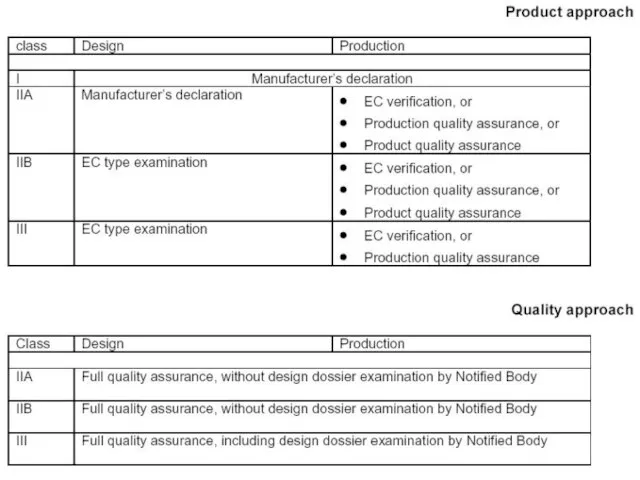
- 5. Директивы содержат процедуры оценки соответствия, которые зависят от типа изделий и типа имеющихся рисков. Кроме случаев
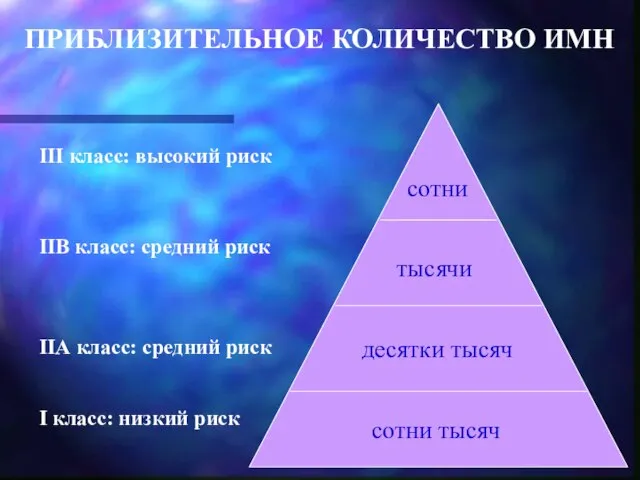
- 6. ПРИБЛИЗИТЕЛЬНОЕ КОЛИЧЕСТВО ИМН III класс: высокий риск IIВ класс: средний риск IIА класс: средний риск I
- 8. EU Directives The Medical Devices Directive (MDD) – применяется для всех медицинских изделий и аксессуаров кроме
- 9. EU Directives The In Vitro Diagnostics Directive (IVDD) – применяется для всех медицинских устройств (приборов) и
- 10. ‘Medical device` means any instrument, apparatus, appliance, material or other article, whether used alone or in
- 11. DIRECTIVE 98/79/EC on in vitro diagnostic medical devices Изделие медицинского назначения (ИМН) для диагностики in vitro
- 12. DIRECTIVE 98/79/EC on in vitro diagnostic medical devices Приложение II Список A - Изделия для определения
- 13. DIRECTIVE 98/79/EC on in vitro diagnostic medical devices Приложение II Список В - Изделия для определения
- 14. ANNEX X CE MARKING OF CONFORMITY The CE conformity marking shall consist of the initials ‘CE’
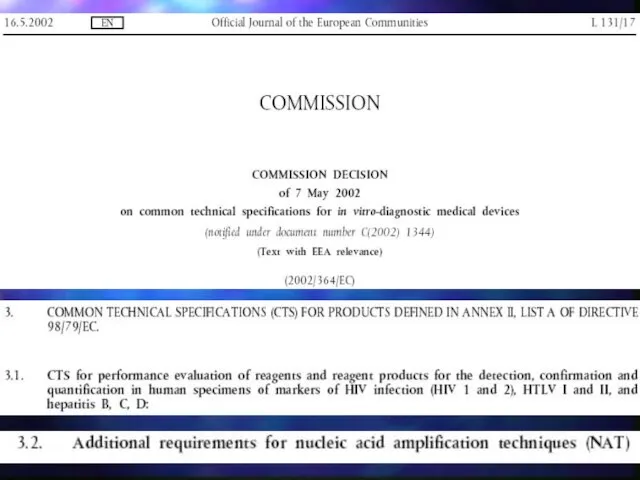
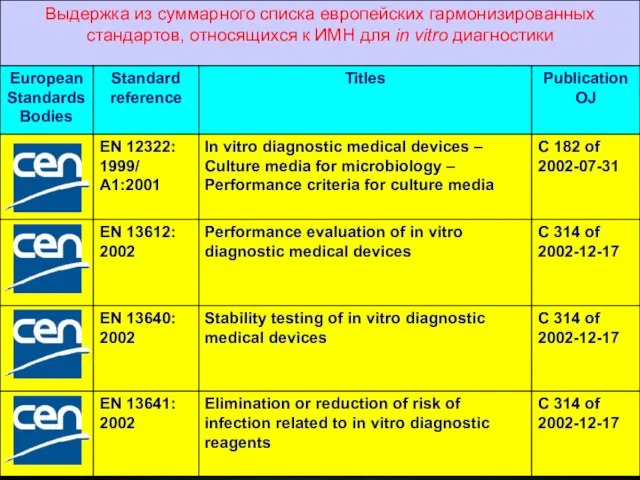
- 15. В отношение ИМН для in vitro диагностики приняты общие технические условия: Common Technical Specifications (CTS), устанавливающие
- 18. [Code of Federal Regulations] [Title 21, Volume 8] CHAPTER I- FOOD AND DRUG ADMINISTRATION, DEPARTMENT OF
- 19. Device Class and Regulatory Controls Class I. General Controls With Exemptions Without Exemptions Class II. General
- 20. Класс I. Общий контроль включает: Регистрацию предприятий (Establishment Registration, по Форме FDA 2891), которые обязаны регистрироваться
- 21. Класс II. Общий контроль и специальный контроль Специальный контроль может включать специальные требования к маркировке, обязательные
- 22. Класс III. Общий контроль и предпродажное одобрение/лицензирование (Premarket Approval) CBER регулирует медицинские изделия, участвующие в сборе,
- 23. The Global Harmonisation Task Force (GHTF) on medical devices (Целевая группа глобальной гармонизации обращения медицинских устройств)
- 24. Несоответствие правил обращения отечественной продукции требованиям международных стандартов - один из главных барьеров в попытках прорваться
- 25. Двухуровневая система технических регламентов и национальных стандартов. Первые обязательны для исполнения, для вторых установлен статус добровольных.
- 26. Национальные стандарты будут содержать дополнительные требования к качеству продукции (вместо ГОСТов, ОСТов, СНиПов, СанПиНов и т.д.)
- 27. Статья 12. Принципы стандартизации Стандартизация осуществляется в соответствии с принципами: добровольного применения стандартов; максимального учета при
- 28. Проект национального стандарта «Правила организации производства и контроля качества лекарственных средств» разработан Ассоциацией инженеров по контролю
- 29. На основе этих проектов в марте 2004 года техническим комитетом по стандартизации ТК 458 был одобрен
- 31. Закон «О медицинских изделиях» существует только в проекте. Сроки разработки технических регламентов и национальных стандартов для
- 32. Санитарно-эпидемиологические правила СП 3.3.2.1288-03 "Надлежащая практика производства медицинских иммунобиологических препаратов" Дата введения 25 июня 2003 г.
- 34. ЛЕКАРСТВЕННОЕ СРЕДСТВО (Medicinal product) Любое вещество или комбинация веществ, предназначенное для лечения или профилактики заболеваний у
- 35. Медицинские иммунобиологические препараты (МИБП) ранее регистрировались обособленно от лекарственных средств. Существовали разные ОСТы и РД. Сейчас
- 36. Медицинские иммунобиологические препараты (МИБП): препараты для лечения, профилактики и диагностики инфекционных и других заболеваний человека, приготовленные,
- 37. Санитарные правила СП 3.3.2.015-94 "Производство и контроль медицинских иммунобиологических препаратов для обеспечения их качества" (утв. постановлением
- 38. Средства in vitro диагностики инфекционных болезней в РФ рассматриваются на практике как лекарственные средства. Однако напрямую
- 39. Федеральный закон от 22 июня 1998 г. № 86-ФЗ «О лекарственных средствах» (с изменениями от 2
- 40. Федеральный закон от 22 июня 1998 г. № 86-ФЗ «О лекарственных средствах» (с изменениями от 2
- 41. Отраслевой стандарт ОСТ 42-510-98 "Правила организации производства и контроля качества лекарственных средств (GMP) (утв. Минздравом РФ
- 42. Отраслевой стандарт ОСТ 91500.05.001.00 "Стандарты качества лекарственных средств. Основные положения" (утвержден приказом Минздрава РФ от 1
- 43. Отраслевой стандарт ОСТ 91500.05.001.00 "Стандарты качества лекарственных средств. Основные положения" (утвержден приказом Минздрава РФ от 1
- 44. Диагностические средства неинвазивного применения по мере развития новых технологий все в большей степени становятся похожими на
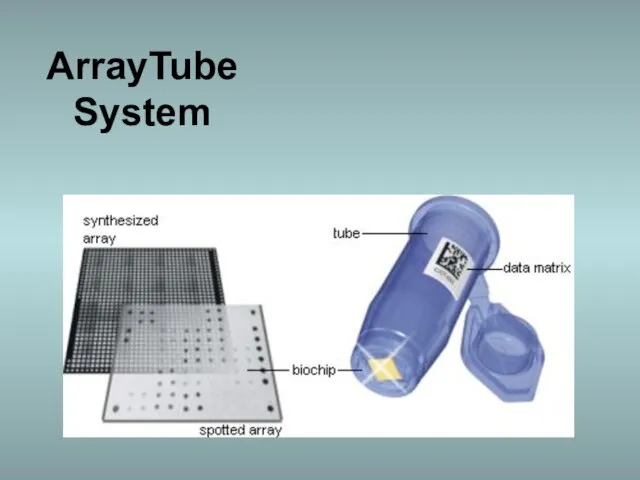
- 45. ArrayTube System
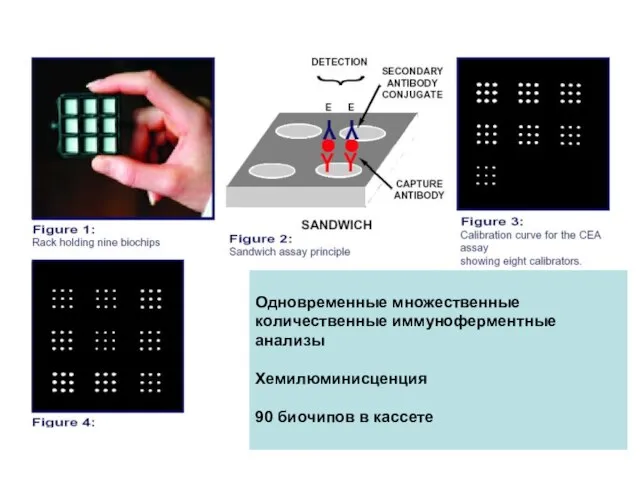
- 47. Одновременные множественные количественные иммуноферментные анализы Хемилюминисценция 90 биочипов в кассете
- 49. Препараты для in vitro диагностики необходимо исключить из лекарственных средств и рассматривать в соответствии с международной
- 50. После редактирования ФСП с сопроводительными письмами следует по маршруту Фармкомитет > ГИСК > Предприятие > ГИСК
- 51. Требования к деталям оформления ФСП в последнее время регулярно и часто видоизменяются, в результате проект ФСП
- 52. Целесообразно отдать функцию утверждения НД в одни руки. ГИСКу им. Л.А. Тарасевича следует придать международно-признанный статус
- 53. Нормативная документация в соответствии с международными стандартами Введение автоматизированной компьютерной системы регистрации (оценки соответствия) НД Установление
- 55. Скачать презентацию












![[Code of Federal Regulations] [Title 21, Volume 8] CHAPTER I- FOOD AND](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/391964/slide-17.jpg)

































 Художественный мир и его компоненты
Художественный мир и его компоненты Оформление и дизайн
Оформление и дизайн prezentatsia_menedzhment (1)
prezentatsia_menedzhment (1) Презентация на тему Военные профессии в стихах и картинках
Презентация на тему Военные профессии в стихах и картинках Личность. Темперамент. Характер. Презентация
Личность. Темперамент. Характер. Презентация Ley de Propiedad Horizontal (LPH)
Ley de Propiedad Horizontal (LPH) Презентация на тему Повышение конкурентоспособности предприятия
Презентация на тему Повышение конкурентоспособности предприятия Как организовать школьный пресс-центр
Как организовать школьный пресс-центр Гондурас
Гондурас Тема 5. Международные морские перевозки грузов
Тема 5. Международные морские перевозки грузов Деньги их функции и виды
Деньги их функции и виды Жестокое обращение с ребенком
Жестокое обращение с ребенком РЕГУЛИРОВАНИЕ КАЧЕСТВА УСЛУГ В ОБЛАСТИ ЭЛЕКТРОЭНЕРГИИ В ИТАЛИИ
РЕГУЛИРОВАНИЕ КАЧЕСТВА УСЛУГ В ОБЛАСТИ ЭЛЕКТРОЭНЕРГИИ В ИТАЛИИ DER VOGEL
DER VOGEL 20.02.2012 года в старшей группе»Смородинка» прошел конкурс «Все дело в шляпе!»
20.02.2012 года в старшей группе»Смородинка» прошел конкурс «Все дело в шляпе!» Экономическое устройство России
Экономическое устройство России «Спасибо за жизнь!»
«Спасибо за жизнь!» Презентация на тему Петровские реформы
Презентация на тему Петровские реформы Эмпирическая методология. Научный метод и исследовательское мышление
Эмпирическая методология. Научный метод и исследовательское мышление О РАЗРАБОТКЕ СТАНДАРТОВ, ОБЕСПЕЧИВАЮЩИХ РЕАЛИЗАЦИЮ ПОСТАНОВЛЕНИЯ ПРАВИТЕЛЬСТВА РФ ОТ 31 ДЕКАБРЯ 2009 Г. № 1222
О РАЗРАБОТКЕ СТАНДАРТОВ, ОБЕСПЕЧИВАЮЩИХ РЕАЛИЗАЦИЮ ПОСТАНОВЛЕНИЯ ПРАВИТЕЛЬСТВА РФ ОТ 31 ДЕКАБРЯ 2009 Г. № 1222 Ведущая свадебных церемоний. Свадебная ведущая
Ведущая свадебных церемоний. Свадебная ведущая Как животные готовятся к зиме?
Как животные готовятся к зиме? Судебное разбирательство в первой инстанции
Судебное разбирательство в первой инстанции Показатели развития общей моторики малыша
Показатели развития общей моторики малыша Улица Панфилова
Улица Панфилова Киномания. Блиц
Киномания. Блиц Электронный университет КГЭУ - виртуальная образовательная среда
Электронный университет КГЭУ - виртуальная образовательная среда Семейство кошачьих
Семейство кошачьих