Содержание
- 2. Химические реакции протекают с разными скоростями. Очень быстро проходят реакции в водных растворах, практически мгновенно.
- 3. Скорость гомогенной реакции определяется как изменение концентрации одного из веществ в единицу времени: если объем системы
- 4. Факторов влияющие на скорость химической реакции. Природа реагирующих веществ Температура Концентрация реагирующих веществ Катализатор Площадь соприкосновения
- 5. Природа реагирующих веществ
- 6. Попробуй сам Налейте в две пробирки соляную и уксусную кислоты. В каждую пробирку добавьте кусочек цинка.
- 7. Выполни эксперимент. В 2 пробирки налей те уксусной кислоты и добавьте несколько гранул цинка. Одну пробирку
- 8. Температура При повышении температуры в большинстве случаев скорость химической реакции значительно увеличивается. В прошлом веке голландский
- 9. Выполни эксперимент. В 1 пробирку налей раствор НСl. Во 2 пробирку концетр. НСl. В каждую пробирку
- 10. Концентрация реагирующих веществ Закон действующих масс. Математически зависимость скорости от концентрации для реакции: 2А+В=АВ выражается следующим
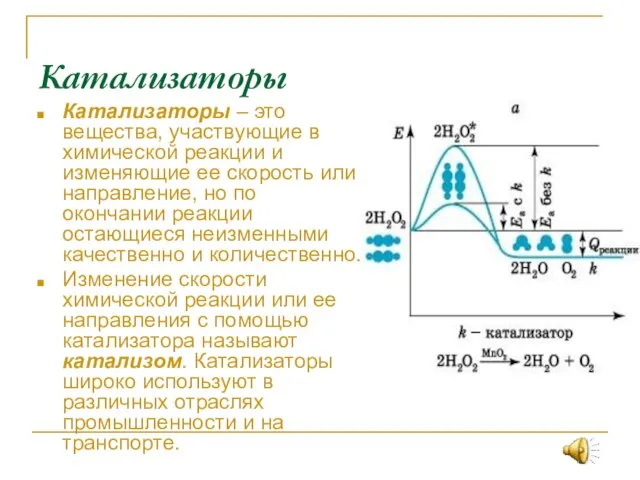
- 11. Катализаторы Катализаторы – это вещества, участвующие в химической реакции и изменяющие ее скорость или направление, но
- 12. Попробуй сам В 2 пробирки налить по 2 мл раствора медного купороса и добавить гранулы алюминия.
- 14. Скачать презентацию










 Красная шапочка
Красная шапочка Справка об отсутствии неисполненной обязанности по уплате налогов, сборов, страховых взносов, пеней
Справка об отсутствии неисполненной обязанности по уплате налогов, сборов, страховых взносов, пеней Классификация полимеров
Классификация полимеров Презентация на тему Плоскостопие
Презентация на тему Плоскостопие  Моделирование объектов городской среды в трехмерном редакторе Blender
Моделирование объектов городской среды в трехмерном редакторе Blender SEO оптимизация за сайтове на малкия и среден бизнес
SEO оптимизация за сайтове на малкия и среден бизнес Конкурскультурно-образовательных инициатив
Конкурскультурно-образовательных инициатив Blue colour
Blue colour Организация перевозки внешнеторговых грузов автомобильным транспортом Дисциплина: Логистика во ВЭД Преподаватель: профессор к
Организация перевозки внешнеторговых грузов автомобильным транспортом Дисциплина: Логистика во ВЭД Преподаватель: профессор к Центр тестирования ВФСК ГТО Калининского района Санкт-Петербург
Центр тестирования ВФСК ГТО Калининского района Санкт-Петербург … просто выбирая лучшее. 10 причин:
… просто выбирая лучшее. 10 причин: Условия и порядок использования земель для градостроительной деятельности
Условия и порядок использования земель для градостроительной деятельности Проект внутреннего социального туризма
Проект внутреннего социального туризма Никто не забыт! Ничто не забыто!
Никто не забыт! Ничто не забыто! Путешествие в царство грибов
Путешествие в царство грибов Презентация на тему Древнейший человек
Презентация на тему Древнейший человек ТЕМА:ПОЛИСАХАРИДЫ. КРАХМАЛ И ЦЕЛЛЮЛОЗА.
ТЕМА:ПОЛИСАХАРИДЫ. КРАХМАЛ И ЦЕЛЛЮЛОЗА. Музыкальные фантазии
Музыкальные фантазии Никола Пуссен - презентация по МХК
Никола Пуссен - презентация по МХК Сервисы предоставления мощностей, как часть аутсорсинговых сервисов. Управление операциями ИКТ
Сервисы предоставления мощностей, как часть аутсорсинговых сервисов. Управление операциями ИКТ Излучения
Излучения Prince Edward
Prince Edward  Тема №3 Организация, вооружение и боевая техника мотострелкового (танкового) батальона, артиллерийских подразделений дивизиона
Тема №3 Организация, вооружение и боевая техника мотострелкового (танкового) батальона, артиллерийских подразделений дивизиона Кафедра информационных технологий топливно-энергетического комплекса
Кафедра информационных технологий топливно-энергетического комплекса Концепция развития парка Песчанка город Всеволожск
Концепция развития парка Песчанка город Всеволожск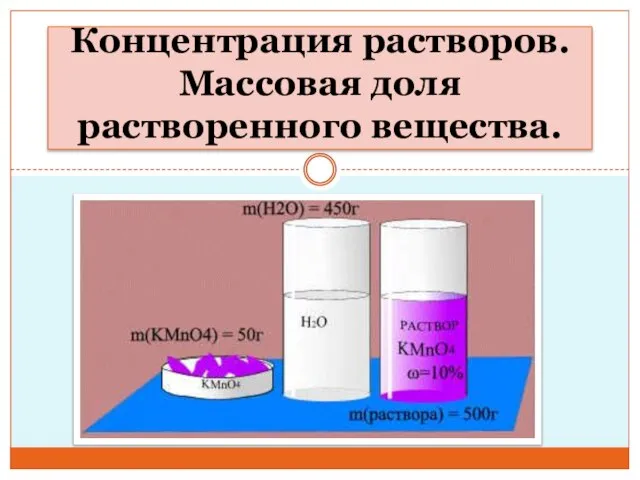 Концентрация растворов. Массовая доля вещества
Концентрация растворов. Массовая доля вещества Пчелы и продукты пчеловодства
Пчелы и продукты пчеловодства Времена года в живописи
Времена года в живописи