Слайд 2Цель : уметь составлять формулы неорганических соединений изученных классов; определять валентность и

степень окисления элемента в соединениях; называть соединения изученных классов
Слайд 3Вещества, состоящие из двух элементов, называются бинарными соединениями.
Валентность – число химических связей,

которое атом может образовать с другими атомами. Валентность равна числу неспаренных электронов в атоме. Валентность обозначается римскими цифрами.
Степень окисления – число электронов, смещенных к атому (-n) или от атома (+n).
Слайд 4Алгоритм (1) составления формул бинарных соединений
Определить более электроотрицательный элемент по ряду

электроотрицательности. Неметалл всегда электроотрицательнее металла.
Более электроотрицательный элемент пишется в формуле правее, менее элекроотрицательный – левее.
Над более элекроотрицательным элементом ставится его степень окисления, равная № группы – 8.
Над менее электроотрицательным элементом ставится его степень окисления, указанная в названии вещества, или равна + номер группы.
Модули степеней окисления сносятся крест-накрест.
Полученные индексы сокращаются, если это нужно.
Слайд 5 Пример:
Даны Si и О.
О – более электроотрицателен.
SiO
Степень окисления кислорода равна 6-8=-2

( SiO-2)
4. Степень окисления кремния равна +4 (Si +4O-2)
5. Si 2+4O4-2 ( сокращаем индексы)
6. Si O2
Слайд 6Алгоритм (2) определения степени окисления элементов в бинарных соединениях
Выбрать более электроотрицательный элемент

и найти его степень окисления, как номер группы – 8. Написать над ним степень окисления.
Умножить степень окисления на индекс у этого элемента. Полученное число со знаком «минус» подписать под этим элементом.
Такое же число со знаком «+» подписать под другим элементом.
Разделить это число на индекс другого элемента. Полученную степень окисления написать над элементом.
Слайд 7Пример:
Дано: SO3.
Более электроотрицателен кислород (О).
Его степень окисления равна 6-8 = -2.

SO-2 3
SO3-2 -6
S +6O3-2 -6
S+6+6O3-2 -6
Слайд 8Правила систематической номенклатуры бинарных соединений
Определить степень окисления элементов в соединении.
Взять латинский корень
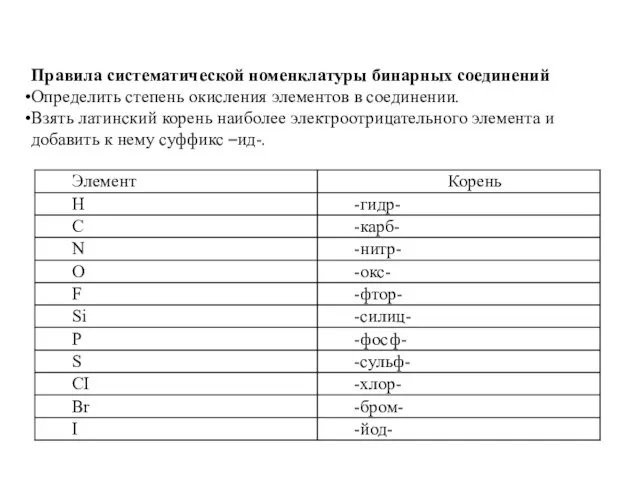
наиболее электроотрицательного элемента и добавить к нему суффикс –ид-.







 Методы и формы работы в программе дополнительного образования
Методы и формы работы в программе дополнительного образования Синдром одержимости
Синдром одержимости Лек 3 харак кулин продукции
Лек 3 харак кулин продукции Символизм и модерн как стилистические направления начала XX века
Символизм и модерн как стилистические направления начала XX века Бухгалтерская (финансовая) отчетность. Отчет об изменениях капитала. Лекция 5
Бухгалтерская (финансовая) отчетность. Отчет об изменениях капитала. Лекция 5 Поддержка стандарта OpenGIS в СУБД ЛИНТЕР
Поддержка стандарта OpenGIS в СУБД ЛИНТЕР № 1 Введение в дисциплину
№ 1 Введение в дисциплину Как сохранить здоровье ребенка? 7 класс
Как сохранить здоровье ребенка? 7 класс Warp Knitted Safety Jacket Fabric
Warp Knitted Safety Jacket Fabric Родительское собраниепо теме"Школа-дом-одна семья"
Родительское собраниепо теме"Школа-дом-одна семья" ТЕМА: ОБОРУДОВАНИЕ ДЛЯ ПРИЕМКИ ПРОДУКЦИИ
ТЕМА: ОБОРУДОВАНИЕ ДЛЯ ПРИЕМКИ ПРОДУКЦИИ Ledeco – профессиональный партнер в сфере реализации инженерно-строительных проектов
Ledeco – профессиональный партнер в сфере реализации инженерно-строительных проектов Тест по экономике
Тест по экономике МОУ Лицей №74
МОУ Лицей №74 Разработка модели управления Разработка модели управленияпроцессом полоролевого воспитания детей дошкольного и младшего шк
Разработка модели управления Разработка модели управленияпроцессом полоролевого воспитания детей дошкольного и младшего шк Проверочная работа по теме: «Функциональное устройство компьютера» (Запишите на листочках свои имя и фамилию,номер варианта и за
Проверочная работа по теме: «Функциональное устройство компьютера» (Запишите на листочках свои имя и фамилию,номер варианта и за Итоги проведения конкурсных процедур и приемки государственных контрактов, выполненных в рамках ФЦПРО на 2011-2015 годы в 2011 году
Итоги проведения конкурсных процедур и приемки государственных контрактов, выполненных в рамках ФЦПРО на 2011-2015 годы в 2011 году Способы разделения смесей
Способы разделения смесей Характерные черты информационного общества
Характерные черты информационного общества Школьная профилактически - образовательная программа «УРОКИ ЗДОРОВЬЯ»
Школьная профилактически - образовательная программа «УРОКИ ЗДОРОВЬЯ» Инклюзивное образование
Инклюзивное образование ВНИМАНИЕ!!!
ВНИМАНИЕ!!! Повторение изученного по фонетике и орфоэпии
Повторение изученного по фонетике и орфоэпии OKD_chistaya_linia
OKD_chistaya_linia Культура через призму психоанализа: Фрейд, Юнг, Фромм
Культура через призму психоанализа: Фрейд, Юнг, Фромм Поручение Президента РФ
Поручение Президента РФ Презентация на тему Money деньги
Презентация на тему Money деньги  Украинцы в Красноярском крае
Украинцы в Красноярском крае