Содержание
- 2. 2. РЕАКЦИИ ЗАМЕЩЕНИЯ АЛКАНОВ. Механизм реакций 2.1 Галогенирование Общая cхема: R-H + X2 R-X + HX
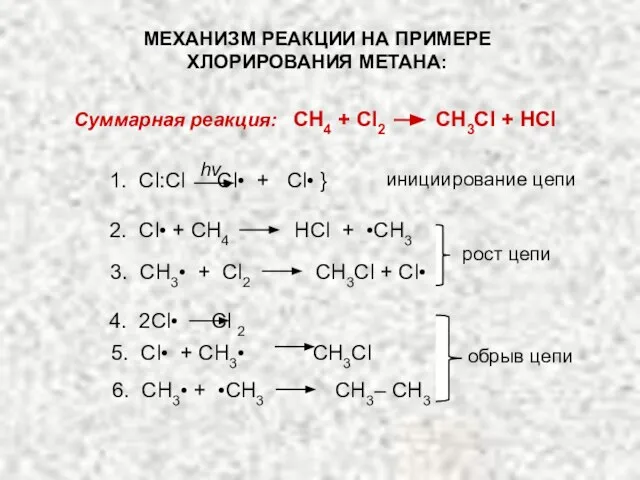
- 3. МЕХАНИЗМ РЕАКЦИИ НА ПРИМЕРЕ ХЛОРИРОВАНИЯ МЕТАНА: Суммарная реакция: CH4 + Cl2 CH3Cl + HCl 1. Cl:Cl
- 4. Хлорирование метана – цепная реакция, т.е. реакция, включающая ряд стадий, каждая из которых гене-рирует реакционноспособную частицу,
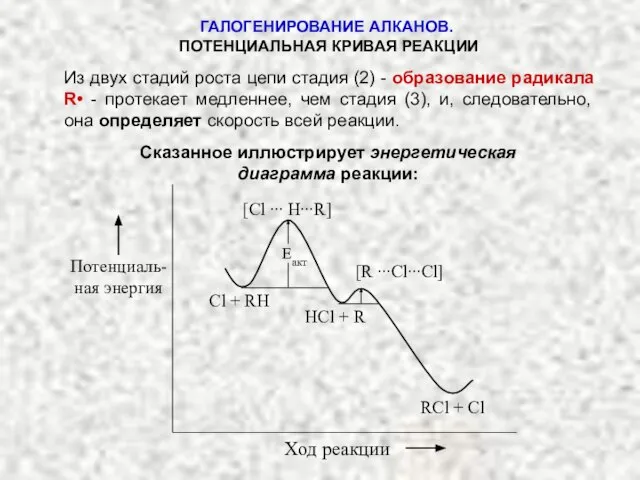
- 5. ГАЛОГЕНИРОВАНИЕ АЛКАНОВ. ПОТЕНЦИАЛЬНАЯ КРИВАЯ РЕАКЦИИ Из двух стадий роста цепи стадия (2) - образование радикала R•
- 6. ОРИЕНТАЦИЯ ПРИ ГАЛОГЕНИРОВАНИИ: Проблема ориентации возникает всякий раз, когда реагент может атаковать различные по реакционной способности
- 7. ОРИЕНТАЦИЯ ПРИ ГАЛОГЕНИРОВАНИИ: Поскольку скоростьопределяющей стадией является стадия образования промежуточного алкильного радикала R•, направление реакции, т.
- 8. Как общее правило можно принять: ОРИЕНТАЦИЯ ПРИ ГАЛОГЕНИРОВАНИИ: «Реакция идет тем легче, чем легче образуются характеризующие
- 9. Ряд изменения устойчивости радикалов: третичный > вторичный > первичный Отсюда следует, что легче всего замещение атомов
- 10. Примечание: Сказанное не означает, однако, что количество изо-пропилхлорида, образующегося в реакции хлорирования пропана будет в 3
- 11. 2. Нитрование алканов разб. HNO3 при нагревании ( Коновалов 1888г.) 1. HO-NO2 HO• + •NO2 t0
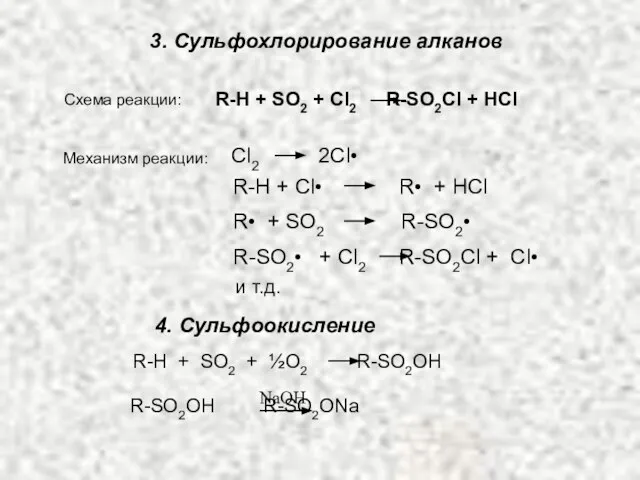
- 12. 3. Сульфохлорирование алканов Схема реакции: R-H + SO2 + Cl2 R-SO2Cl + HCl Сl2 2Cl• R-H
- 13. РЕАКЦИЯ СУЛЬФОХЛОРИРОВАНИЯ Реакция сульфохлорирования алканов впервые была использована в Германии в 1939-1940 гг. для получения заменителей
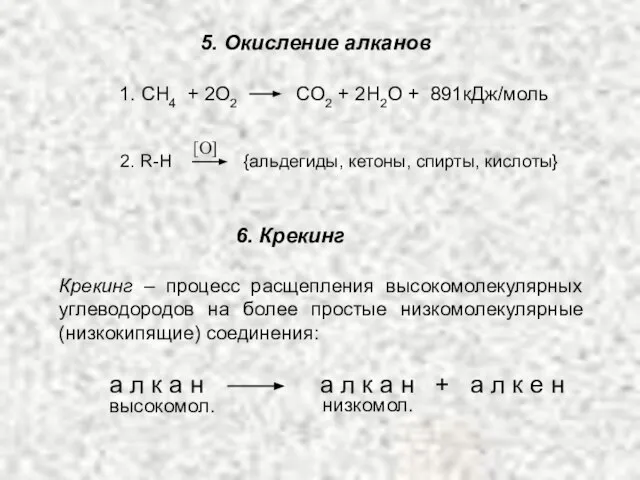
- 14. 5. Окисление алканов 1. СH4 + 2O2 CO2 + 2H2O + 891кДж/моль [O] 2. R-H {альдегиды,
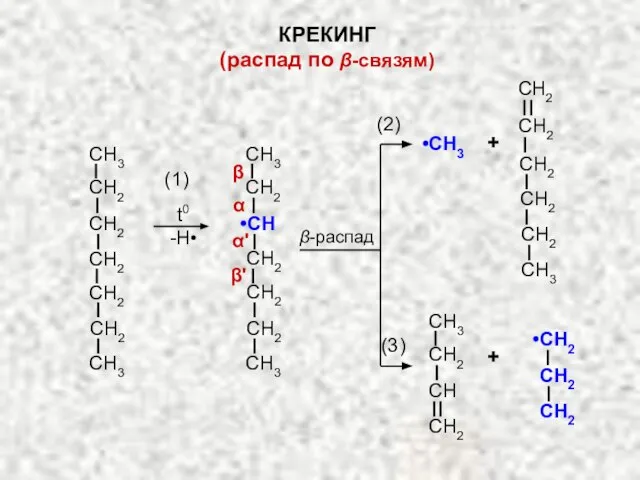
- 15. t0 -H• β-распад •CH3 + + (1) (2) (3) КРЕКИНГ (распад по β-связям)
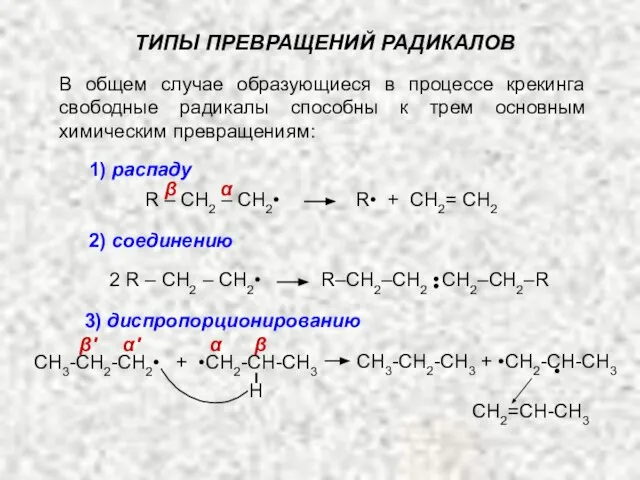
- 16. В общем случае образующиеся в процессе крекинга свободные радикалы способны к трем основным химическим превращениям: ТИПЫ
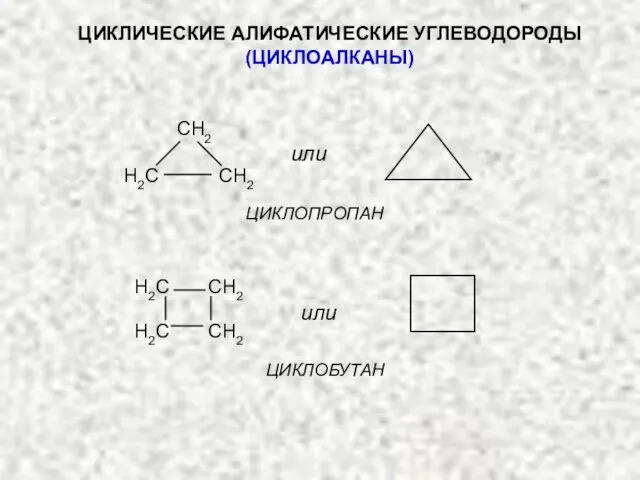
- 17. ЦИКЛИЧЕСКИЕ АЛИФАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (ЦИКЛОАЛКАНЫ) или H2C CH2 H2C CH2 или ЦИКЛОПРОПАН ЦИКЛОБУТАН
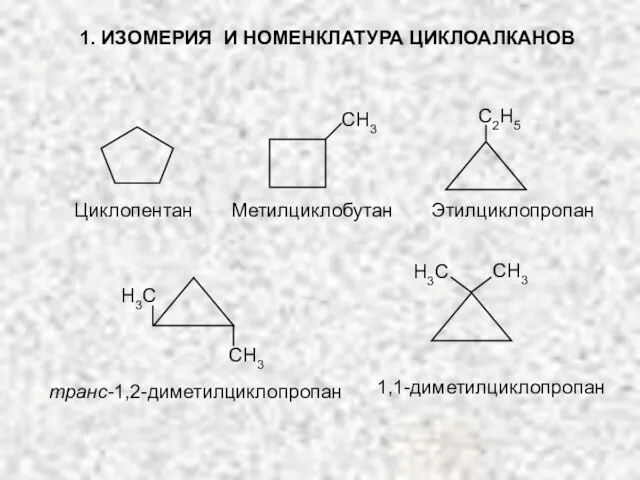
- 18. 1. ИЗОМЕРИЯ И НОМЕНКЛАТУРА ЦИКЛОАЛКАНОВ СH3 С2H5 Циклопентан Метилциклобутан Этилциклопропан СH3 H3С H3С СH3 транс-1,2-диметилциклопропан 1,1-диметилциклопропан
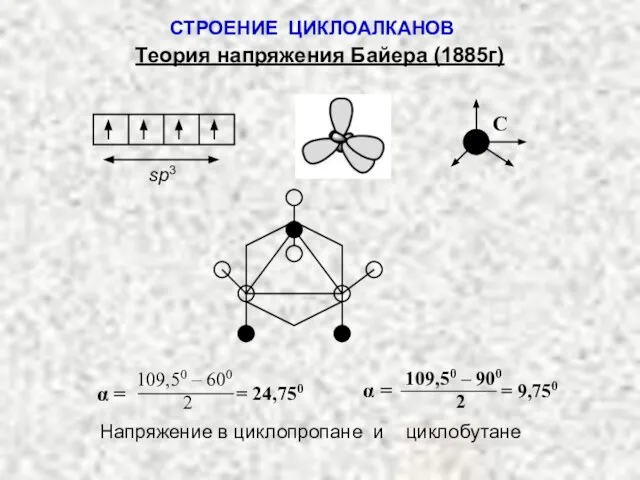
- 19. СТРОЕНИЕ ЦИКЛОАЛКАНОВ Теория напряжения Байера (1885г) sp3 C 109,50 – 600 2 α = = 24,750
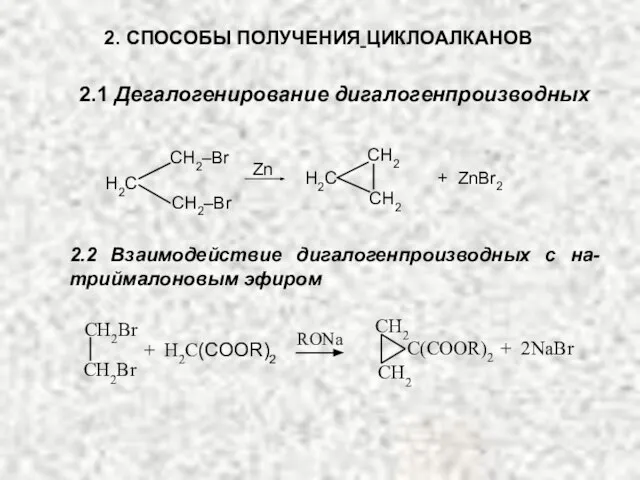
- 20. 2. СПОСОБЫ ПОЛУЧЕНИЯ ЦИКЛОАЛКАНОВ 2.1 Дегалогенирование дигалогенпроизводных H2С СH2–Br СH2–Br H2С СH2 СH2 Zn + ZnBr2
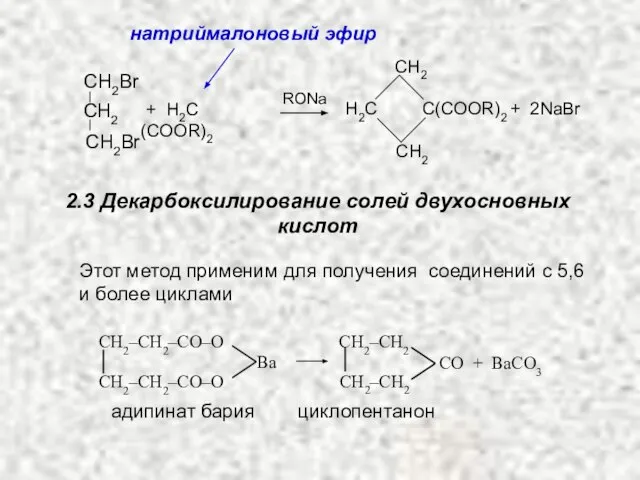
- 21. СH2 СH2 H2С С(COOR)2 + 2NaBr + H2С(COOR)2 RONa СH2Br СH2Br СH2 натриймалоновый эфир 2.3 Декарбоксилирование
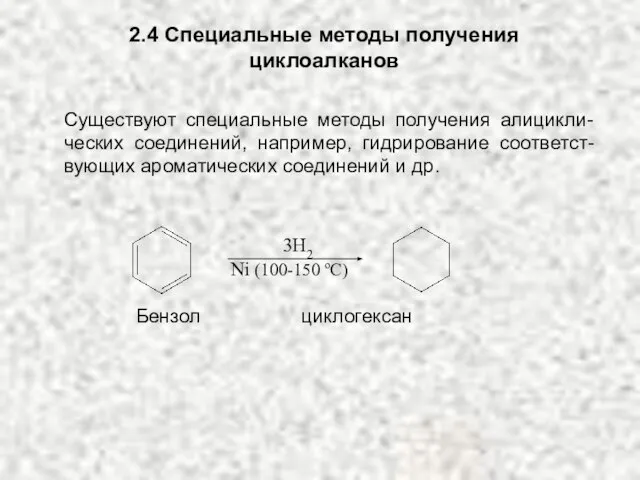
- 22. 2.4 Специальные методы получения циклоалканов 3H2 Ni (100-150 oC) Существуют специальные методы получения алицикли-ческих соединений, например,
- 23. 3. ФИЗИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ Циклические соединения обычно имеют более высокую температуру кипения и плавления и большую
- 24. 3. ХИМИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ Химические свойства циклоалканов зависят от величины цикла. Соединения с малым размером (3-,4-членные)
- 25. Гидрирование СH2–СН2 СH2–СН2 CH2 + H2 СН3–СН2–СН2-CH2–СН3 Pd 300 oC Пятичленный цикл разрывается только при высоких
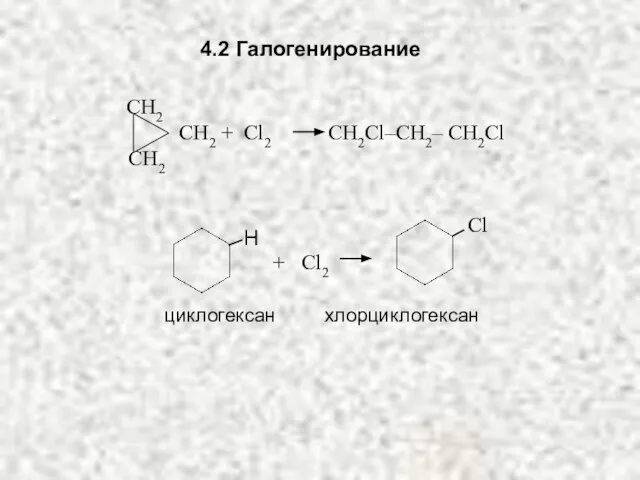
- 26. 4.2 Галогенирование СH2 СH2 СН2 + Cl2 CH2Cl–CH2– CH2Cl Сl H + Cl2 циклогексан хлорциклогексан
- 27. 4.3 Действие галогеноводородов СH2 СH2 СН–R + HBr R–CHBr–CH2– CH3 Циклопропан и его гомологи реагируют с
- 28. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ. ПРИМЕНЕНИЕ Циклопропан – газообразное вещество с т.кип. –34 оС получают в промышленном масштабе обработкой
- 30. Скачать презентацию














 New Year Merry Christmas
New Year Merry Christmas Компания DominiSoft www.dominisoft.ru Компания “БУКА” www.buka.ru www.bukasoft.ru
Компания DominiSoft www.dominisoft.ru Компания “БУКА” www.buka.ru www.bukasoft.ru ЗДОРОВЬЕСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ, КАК ВЗАИМОДЕЙСТВИЕ УЧЕНИКА И УЧИТЕЛЯ.
ЗДОРОВЬЕСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ, КАК ВЗАИМОДЕЙСТВИЕ УЧЕНИКА И УЧИТЕЛЯ. Презентация на тему природа коми края
Презентация на тему природа коми края Синдром эмоционального выгорания
Синдром эмоционального выгорания Система образования и проблемы её структуры
Система образования и проблемы её структуры Волейбол. 5-7 классы
Волейбол. 5-7 классы Война — жесточе нету слова,Война — печальней нету слова. Война — святее нету слова В тоске и славе этих лет.И на устах у нас иного
Война — жесточе нету слова,Война — печальней нету слова. Война — святее нету слова В тоске и славе этих лет.И на устах у нас иного Евгений Львович Шварц (1896-1958)
Евгений Львович Шварц (1896-1958) Водоёмы нашей местности
Водоёмы нашей местности Фармакоэпидемиологические и фармакоэкономические аспекты нежелательных реакций лекарственных препаратов – неявная проблема и
Фармакоэпидемиологические и фармакоэкономические аспекты нежелательных реакций лекарственных препаратов – неявная проблема и  Зиянкестердің экономикалық шекті. Зиянын табиғи жауларының тиімділігінің деңгейін анықтау. (Лекция 15)
Зиянкестердің экономикалық шекті. Зиянын табиғи жауларының тиімділігінің деңгейін анықтау. (Лекция 15) Séjour d’études linguistiques Découverte de la Provence
Séjour d’études linguistiques Découverte de la Provence Символи України. Національний український одяг
Символи України. Національний український одяг Законы развития теории судебной экспертизы
Законы развития теории судебной экспертизы Командный проект. Бизнес-задача
Командный проект. Бизнес-задача Взаимодействие с заинтересованными сторонами при подготовке интегрированных отчетов
Взаимодействие с заинтересованными сторонами при подготовке интегрированных отчетов Экономить - значит зарабатывать! Плакат для рабочих
Экономить - значит зарабатывать! Плакат для рабочих Что такое деятельность
Что такое деятельность Микеланджело
Микеланджело  Лучший центр. Белорецк. Скалодром
Лучший центр. Белорецк. Скалодром Здоровьесберегающие технологии в образовательном процессе. Подготовил: зам.директора по УВР Павлов В.В.
Здоровьесберегающие технологии в образовательном процессе. Подготовил: зам.директора по УВР Павлов В.В. Лекция 5. Проблема психологического контроля и управления спортивной деятельностью
Лекция 5. Проблема психологического контроля и управления спортивной деятельностью Опорные схемы и рисунки в помощь учащимся
Опорные схемы и рисунки в помощь учащимся Топология компьютерных сетей
Топология компьютерных сетей Процессоры фирм Intel и AMD
Процессоры фирм Intel и AMD Стили в одежде
Стили в одежде «1С:Предприятие 8. Управление водоканалом»
«1С:Предприятие 8. Управление водоканалом»