Слайд 2Цели урока:
1)Познакомить учащихся с понятием соли, изучить основные классификации солей;
2)Изучить основные химические

свойства солей;
3)Продолжить формирование умений составлять уравнения химических реакций;
4)Продолжить воспитывать культуру работы с реактивами;
Слайд 3Что такое соли?
Соли – это класс химических соединений, состоящих из ионов

металла и ионов кислотного остатка.
(Например: NaCl, NH4NO3, AgY)
Солями называют электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+) и анионы кислотных остатков.
(Например: K3PO4 = 3K+ + PO43- )
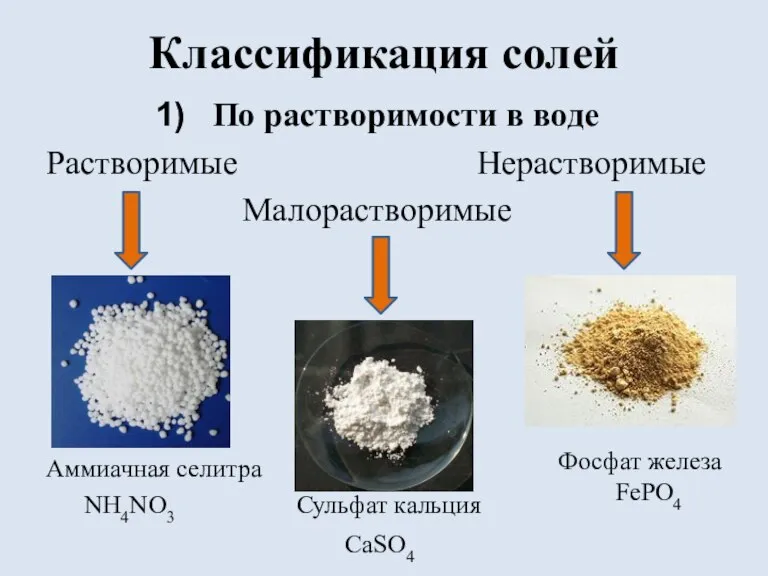
Слайд 4Классификация солей
По растворимости в воде
Растворимые Нерастворимые
Малорастворимые
Аммиачная селитра
NH4NO3 Сульфат кальция
Фосфат железа
Слайд 5Классификация солей
2) По наличию или отсутствию кислорода
Кислородсодержащие Бескислородные
Например: Например:
Na2SO4
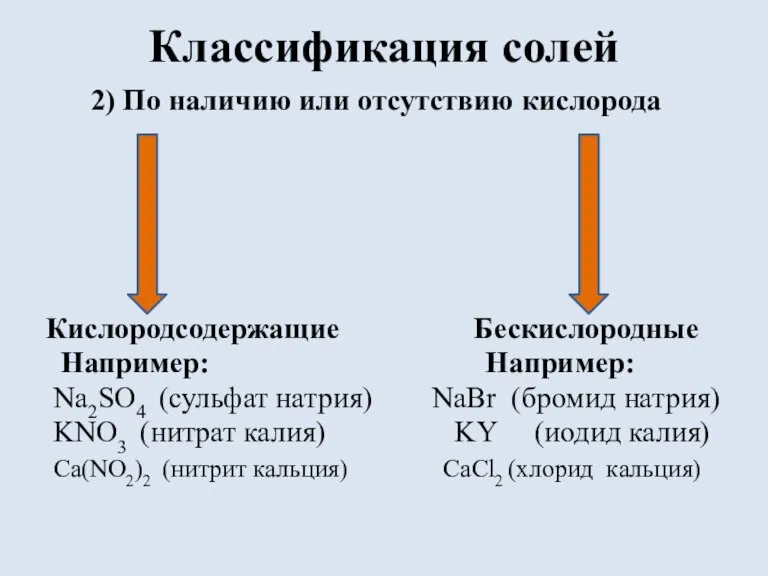
(сульфат натрия) NaBr (бромид натрия)
KNO3 (нитрат калия) KY (иодид калия)
Ca(NO2)2 (нитрит кальция) CaCl2 (хлорид кальция)
Слайд 6Разновидности солей
Соли бывают:
Средние соли – это продукты полного замещения атомов водорода в

кислоте на металл.
Например: Na2CO3 (карбонат натрия)
CuSO4 (сульфат меди)
Диссоциация средних солей:
Na2CO3 = 2Na+ + CO32-
Слайд 7Разновидности солей
2) Кислые соли – это продукты неполного замещения атомов водорода

в кислоте на металл.
Например:
NaHCO3 (гидрокарбонат натрия)
Mg(HSO4)2 (гидросульфат магния)
Диссоциация кислых солей:
Ca(HSO4)2 = Ca2+ + 2HSO4-
Слайд 8Разновидности солей
3) Основные соли – это продукты неполного замещения гидроксогрупп в

основании на кислотный остаток.
Например:
(CuOH)2CO3 (гидроксокарбонат меди (II))
AlOHCl2 (гидроксохлорид алюминия)
Диссоциация основных солей:
AlOHCl2 = AlOH2+ + 2Cl-
Слайд 9Типичные реакции средних солей
Соль + кислота = другая соль + другая кислота
Например:
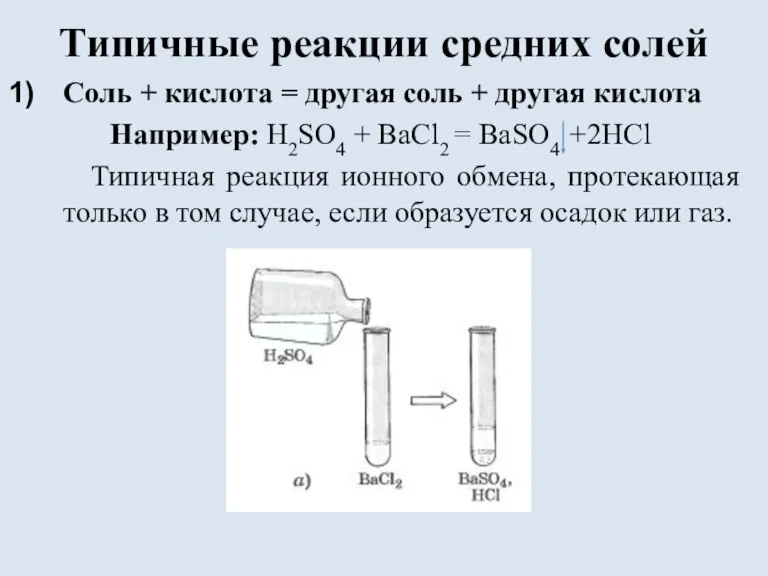
H2SO4 + BaCl2 = BaSO4 +2HCl
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.
Слайд 10Типичные реакции средних солей
2) Соль + щелочь = другая соль + другое
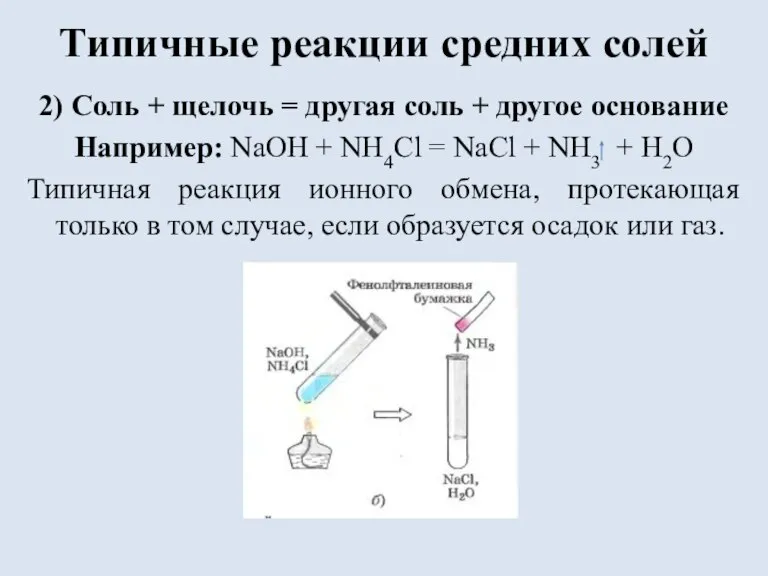
основание
Например: NaOH + NH4Cl = NaCl + NH3 + H2O
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.
Слайд 11Типичные реакции средних солей
3) Соль1 + соль2 = соль3 + соль4

Например: Na2SO4 + BaCl2 = BaSO4 +2NaCl
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок.
Слайд 12Типичные реакции средних солей
4) Соль + металл = другая соль + другой

металл
Например: CuSO4(p-p) + Fe = FeSO4 (p-p) + Cu
Правила: а) Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений;
б) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
в) металлы не должны взаимодействовать с водой, поэтому металлы главных подгрупп I и II группы ПС Д.И.Менделеева не вытесняют другие металлы из растворов солей.
Слайд 13Обобщение темы
Тест «Как я запомнил тему»:
1) Выберите формулу соли:
а) HCl б) Ca(OH)2
в) Na2SO4 г)

MgО
2) Какая из приведенных солей растворима в воде:
а) AgCl б) MgS
в) FePO4 г) CuSO4
3) Какая из приведенных солей бескислородная:
а) CаSO4 б) KBr
в) NH4NO3 г) Na2CO3
Слайд 14.
4) К какому типу солей относится данная соль - AlOHCl2:
а) средняя б) основная
в)

кислая г) ни к одной из этих
5) Какая реакция не является типичной реакцией для средних солей:
а) соль + металл б) соль + кислота
в) соль + оксид г) соль + щелочь
Слайд 16Домашнее задание:
§ 41 Упр. 2, 3.
















 История Тарской средней общеобразовательной школы №3
История Тарской средней общеобразовательной школы №3 Взаимодействие учителя-логопеда и педагога-психолога в процессе коррекции речевых нарушений.
Взаимодействие учителя-логопеда и педагога-психолога в процессе коррекции речевых нарушений. «Конфликт и пути его решения»(внеклассное мероприятие 3 класс)
«Конфликт и пути его решения»(внеклассное мероприятие 3 класс) Kultūra kā process un dialogs
Kultūra kā process un dialogs ФТО консалтинговая компания
ФТО консалтинговая компания Пропозиция как содержательный аспект предложения
Пропозиция как содержательный аспект предложения Подготовка к ГИА Компрессия текста
Подготовка к ГИА Компрессия текста Характеристика видов рекламы по рекламодателю
Характеристика видов рекламы по рекламодателю Я тебяunderstand!!!
Я тебяunderstand!!! Организация технического обслуживания и эксплуатации электрооборудования цеха ОАО ДЗРД
Организация технического обслуживания и эксплуатации электрооборудования цеха ОАО ДЗРД ПРОЕКТИРОВАНИЕ ИНФОРМАЦИОННОЙ СРЕДЫ ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ
ПРОЕКТИРОВАНИЕ ИНФОРМАЦИОННОЙ СРЕДЫ ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ Трансляція — перехід від нуклеїнових кислот до білків
Трансляція — перехід від нуклеїнових кислот до білків Ордена и награды царской России
Ордена и награды царской России Социальные сети для HR
Социальные сети для HR Презентация на тему Как вести себя, если вы стали заложником террористов
Презентация на тему Как вести себя, если вы стали заложником террористов  (Опыт анализа повести Н.В. Гоголя «Шинель» в 10 классе.)
(Опыт анализа повести Н.В. Гоголя «Шинель» в 10 классе.) 2022-08-22-hw-0-e0a5a6d6929cbccd3b7908a660a9ef04
2022-08-22-hw-0-e0a5a6d6929cbccd3b7908a660a9ef04 Трансгенные животные и растения
Трансгенные животные и растения Презентация на тему Приставки при- и пре
Презентация на тему Приставки при- и пре  Аренда, продажа объекта недвижимости от собственника, г. Санкт-Петербург, ул. Салова 46
Аренда, продажа объекта недвижимости от собственника, г. Санкт-Петербург, ул. Салова 46 Методы решения творческих задач
Методы решения творческих задач Урок математики в 1 классе
Урок математики в 1 классе  Вашингтон- столица США
Вашингтон- столица США The Way InTo The sea
The Way InTo The sea Религия ислам
Религия ислам Таблицы истинности.Логические схемы
Таблицы истинности.Логические схемы Признаки живых организмов
Признаки живых организмов Сочинение по картине И.И.Левитана
Сочинение по картине И.И.Левитана