Содержание
- 2. Определения и классификация Номенклатура Физические свойства Способы получения Химические свойства соли
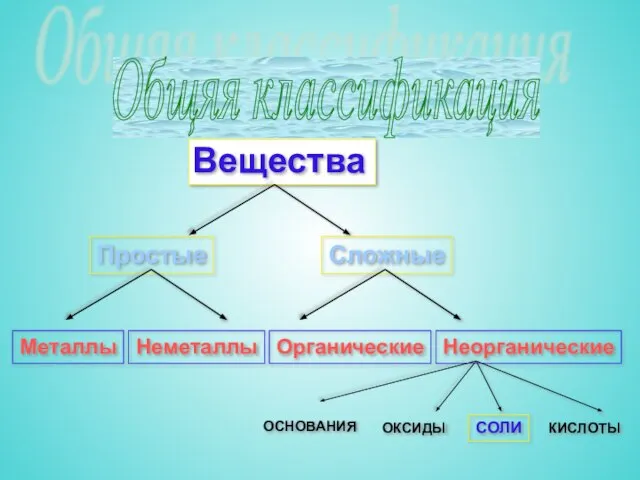
- 3. Общяя классификация Простые Сложные Металлы Неметаллы Органические Неорганические ОСНОВАНИЯ ОКСИДЫ СОЛИ КИСЛОТЫ
- 4. Классификация солей соли средние кислые основные двойные смешанные комплексные гидратные
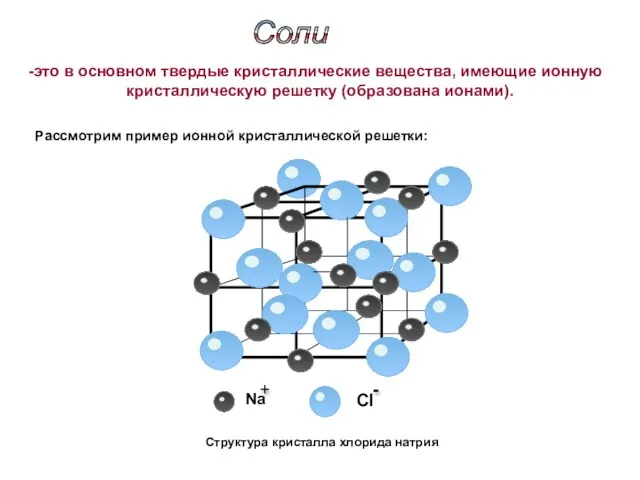
- 5. Структура кристалла хлорида натрия Соли это в основном твердые кристаллические вещества, имеющие ионную кристаллическую решетку (образована
- 6. Определения типов солей Соли состоят из атомов металла и атомов кислотного остатка. Основные типы солей это:
- 7. Примеры солей Средние соли: Ca(NO3)2; K2SO4; Al(NO3)3. Кислые соли: KHSO4; MgHPO4; NaSO3. Основные соли: LiOHPO4; CaOHP2O
- 8. а) К основным солям б) К смешанным солям в) К комплексным солям г) К двойным солям
- 9. Номенклатура солей Название солей образуется из названия аниона, за которым следует название катиона. Для солей бескислородных
- 10. Как правильно назвать соль: KCl? а) Хлор калия б) Хлорид калия в) Хлорат калия г) Хлорит
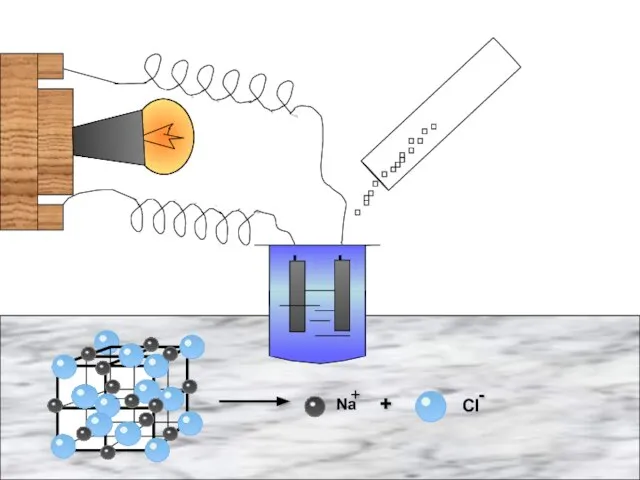
- 11. Физические свойства солей Основное свойство солей- это то, что они являются электролитами. Электролиты- это вещества, растворы
- 12. +
- 13. Способы получения солей Соли получают разнообразными способами. Вот примеры некоторых из них: а) Взаимодействием двух простых
- 14. Химические свойства солей Соли обладают общими химическими свойствами за счет сходного иона. Пример: Взаимодействие солей с
- 15. С каким из металлов будет взаимодействовать соль MgS? а) Ca б) Mn в) Zn г) Ni
- 16. Гидролиз солей Существуют четыре типа гидролиза: Соль образована ионом сильного основания и ионом слабой кислоты. 2)Соль
- 17. План составления гидролиза: 1) Проверить соль на растворимость по таблице растворимости. 2) Определить, есть ли в
- 18. Первый тип гидролиза Пример:
- 19. Второй тип гидролиза Пример:
- 20. Третий тип гидролиза В этом случае гидролиз необратим. Примеры:
- 21. Четвертый тип гидролиза NaCl Растворимые соли, образованные сильной кислотой и сильным основанием, в воде не гидролизируются.
- 22. Факторы, влияющие на гидролиз 1) Повышение температуры приводит к смещению равновесия в сторону продуктов реакции. 2)Увеличение
- 23. КОНЕЦ! P.S. Надеюсь, Вам понравилось.
- 24. ВЕРНО
- 25. Не верно
- 26. Не верно
- 27. ВЕРНО
- 28. ВЕРНО
- 30. Скачать презентацию
























 Tesla
Tesla Оригами новогодняя ёлка
Оригами новогодняя ёлка Презентация на тему Решение задач по теме Колебания и волны
Презентация на тему Решение задач по теме Колебания и волны  Budowa roślin
Budowa roślin Презентация на тему Россия при Петре I
Презентация на тему Россия при Петре I  Пакетные предложения. Разработан для хоккея спроектирован для детей. Окно №2
Пакетные предложения. Разработан для хоккея спроектирован для детей. Окно №2 Презентация на тему Как сочинить волшебную сказку
Презентация на тему Как сочинить волшебную сказку  Развитие магистральных сетей: задачи энергостроительного комплекса
Развитие магистральных сетей: задачи энергостроительного комплекса Решение задач. Идеальный газ
Решение задач. Идеальный газ Непривычная динамика ценна рынке жилья:впервые за 20 летАналитический центр w w w . I R N . r u Март 2011 г.
Непривычная динамика ценна рынке жилья:впервые за 20 летАналитический центр w w w . I R N . r u Март 2011 г. o Центр корпоративного обучения « Оксфорд Класс » создан в 2007 г. в партнерстве с языковой школой Оксфорд Класс, г. Киев,Украина, год о
o Центр корпоративного обучения « Оксфорд Класс » создан в 2007 г. в партнерстве с языковой школой Оксфорд Класс, г. Киев,Украина, год о Скульптура АНТИЧНОСТИ
Скульптура АНТИЧНОСТИ Сервировка сладкого стола. Праздничный этикет
Сервировка сладкого стола. Праздничный этикет Чтобы зубы были здоровыми
Чтобы зубы были здоровыми Тема занятия: «Учет кассовых операций»
Тема занятия: «Учет кассовых операций» Требования к современному уроку
Требования к современному уроку Научно-методическое обеспечение деятельности школьных библиотекарей
Научно-методическое обеспечение деятельности школьных библиотекарей Муниципальное бюджетное общеобразовательное учреждение гимназия № 52 Октябрьского района города Росто
Муниципальное бюджетное общеобразовательное учреждение гимназия № 52 Октябрьского района города Росто России первая любовь
России первая любовь Графические интерфейсыпакет Tkinter
Графические интерфейсыпакет Tkinter Презентация на тему Мир
Презентация на тему Мир Операции с грузами по прибытию на станцию назначения
Операции с грузами по прибытию на станцию назначения Презентация на тему Познавательные процессы 8 класс
Презентация на тему Познавательные процессы 8 класс Русская народная музыка
Русская народная музыка Портрет первоклассника
Портрет первоклассника Организация структуры базы данных
Организация структуры базы данных Теория обучения в информационном обществе
Теория обучения в информационном обществе Особенности правового режима использования олимпийской и паралимпийской символики
Особенности правового режима использования олимпийской и паралимпийской символики