Содержание
- 2. Содержание Строение атома азота. Образование молекулы аммиака. Строение молекулы аммиака. Физические свойства. Способы получения аммиака. Химические
- 3. Строение атома азота N Азот 14,0067 2 5 7 2s22p3 N 7N II период V группа
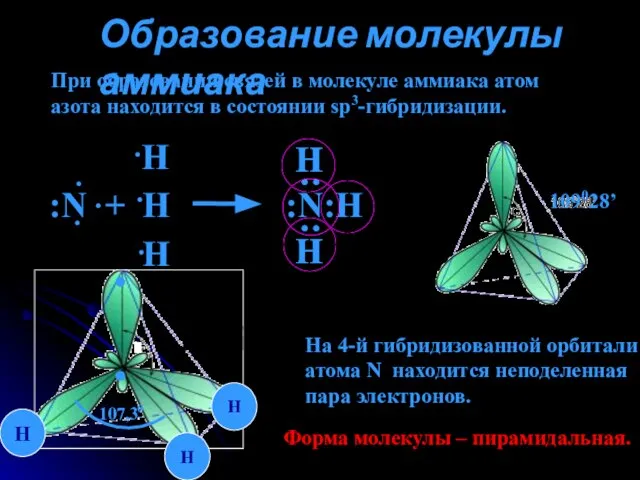
- 4. Образование молекулы аммиака При образовании связей в молекуле аммиака атом азота находится в состоянии sp3-гибридизации. 109028’
- 5. Строение молекул аммиака Между молекулами аммиака образуются водородные связи: Связи N-H полярные, молекула имеет пирамидальную форму,
- 6. Физические свойства аммиака Бесцветный газ с резким запахом. Почти в два раза легче воздуха: При охлаждении
- 7. Способы получения аммиака В промышленности: N2 + 3H2 2NH3 Реакция проводится при нагревании, под давлением, в
- 8. Химические свойства аммиака NH3 – низшая степень окисления азота. -3 1. Аммиак - восстановитель Реакция горения
- 9. II. Основные свойства аммиака: При растворении аммиака в воде образуется гидрат аммиака, который диссоциирует: NH3 +
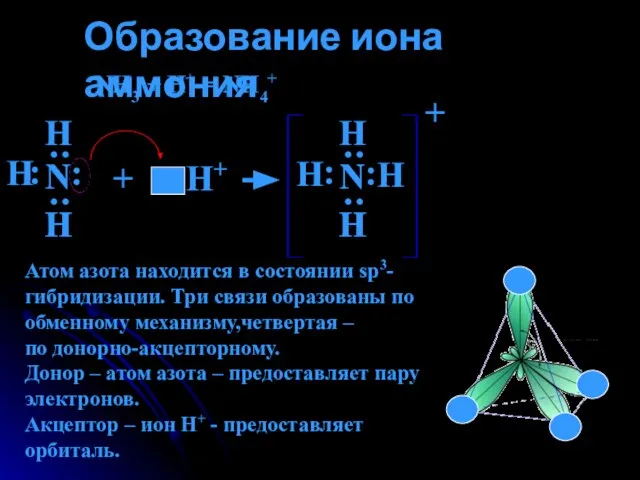
- 10. Образование иона аммония NH3 + H+ = NH4+ Н : : Н Н : : Н
- 11. Соли аммония Ион аммония по размерам и заряду близок к ионам щелочных металлов, поэтому соли аммония
- 12. Разложение солей аммония при нагревании Соли летучих кислот: NH4ClCl = Cl = NH3 + HCl (NH4)2CO3
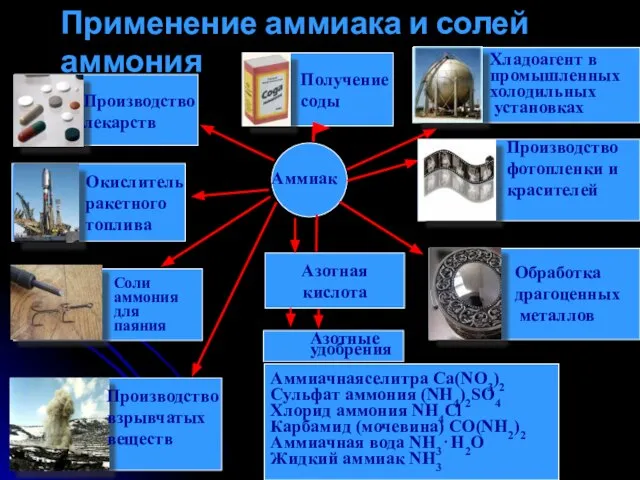
- 13. Азотная кислота Аммиачнаяселитра Ca(NO3)2 Сульфат аммония (NH4)2SO4 Хлорид аммония NH4Cl Карбамид (мочевина) CO(NH2)2 Аммиачная вода NH3⋅H2O
- 15. Скачать презентацию









 Чарующие звуки музыки
Чарующие звуки музыки Диены
Диены В каких стилях русского языка чаще всего встречаются речевые ошибки ? Чаще всего речевые ошибки встречаются в разговорном и Чаще в
В каких стилях русского языка чаще всего встречаются речевые ошибки ? Чаще всего речевые ошибки встречаются в разговорном и Чаще в University of my dream
University of my dream Моя будущая профессия
Моя будущая профессия Синдром дефицита внимания и гиперактвиность
Синдром дефицита внимания и гиперактвиность Презентация на тему Приглашение к чтению Е.И. Чрушина и его творчества
Презентация на тему Приглашение к чтению Е.И. Чрушина и его творчества СОВРЕМЕННЫЕ СИСТЕМЫ ЗАЩИТЫ И АВТОМАТИЗАЦИИ НА МНОГОЦЕПНЫХ ЛИНИЯХ ЭЛЕКТРОПЕРЕДАЧИ СВЕРХВЫСОКОГО НАПРЯЖЕНИЯ Янез Законьшек ЗАО «
СОВРЕМЕННЫЕ СИСТЕМЫ ЗАЩИТЫ И АВТОМАТИЗАЦИИ НА МНОГОЦЕПНЫХ ЛИНИЯХ ЭЛЕКТРОПЕРЕДАЧИ СВЕРХВЫСОКОГО НАПРЯЖЕНИЯ Янез Законьшек ЗАО « Санитарно-эпидемиологические требования к условиям и организации обучения в общеобразовательных учреждениях
Санитарно-эпидемиологические требования к условиям и организации обучения в общеобразовательных учреждениях РасширениеMS Visual Studio 2005с использованиемIntel® C++ IDE Automation
РасширениеMS Visual Studio 2005с использованиемIntel® C++ IDE Automation Растения играют большую роль в жизни животных и человека кислород пища лекарство убежище ткани древесина.
Растения играют большую роль в жизни животных и человека кислород пища лекарство убежище ткани древесина. Переработка попутного нефтяного газа – эффективное использование невозобновляемого источника природных ресурсов РФ
Переработка попутного нефтяного газа – эффективное использование невозобновляемого источника природных ресурсов РФ Банная станция
Банная станция Утилизация теплоты
Утилизация теплоты Бюджетное устройство и бюджетная система
Бюджетное устройство и бюджетная система Глаза животных 3 класс
Глаза животных 3 класс Термическая обработка
Термическая обработка Деловой стиль одежды
Деловой стиль одежды Феварин (флувоксамин) в амбулаторном лечении алкогольной зависимости, осложненной психическими расстройствами
Феварин (флувоксамин) в амбулаторном лечении алкогольной зависимости, осложненной психическими расстройствами Zaadachi_3_klass
Zaadachi_3_klass Охрана атмосферы города от газовых выбросов промышленных предприятий
Охрана атмосферы города от газовых выбросов промышленных предприятий Презентация на тему Косыночные повязки
Презентация на тему Косыночные повязки  Еврейская культура. Еврейские праздники
Еврейская культура. Еврейские праздники Портрет
Портрет ПЛАТФОРМА ВАШЕГО УСПЕХА
ПЛАТФОРМА ВАШЕГО УСПЕХА Процессы приготовления, подготовки к реализации и презентации холодных блюд, кулинарных изделий, закусок
Процессы приготовления, подготовки к реализации и презентации холодных блюд, кулинарных изделий, закусок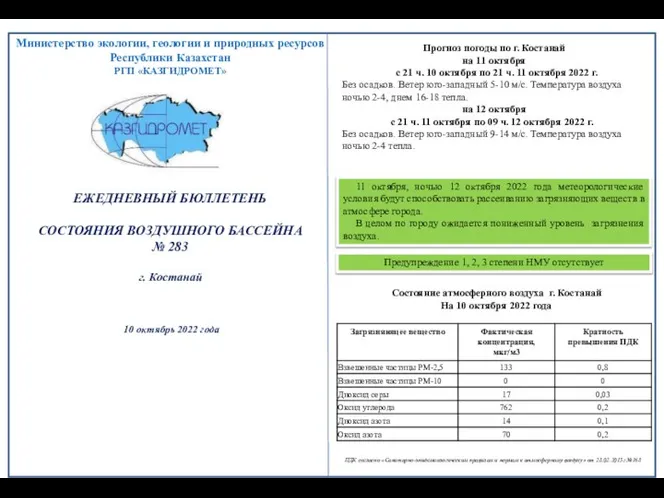 6343f139f10cakostanay-nmu-10-10-22-1
6343f139f10cakostanay-nmu-10-10-22-1 Характеристика аффективно - потребностной сферы школьников, испытывающих трудности в обучении
Характеристика аффективно - потребностной сферы школьников, испытывающих трудности в обучении