Содержание
- 2. 1924 год Франция Луи де Бройль (Луи Виктор Пьер Реймон, 7-й герцог Брольи) (1892-1987) Лауреат нобелевской
- 3. 1927 год США Клинтон Дж. Дэвиссон (1881-1958) Лауреат нобелевской премии по физике (1937) Лестер Г. Джермер
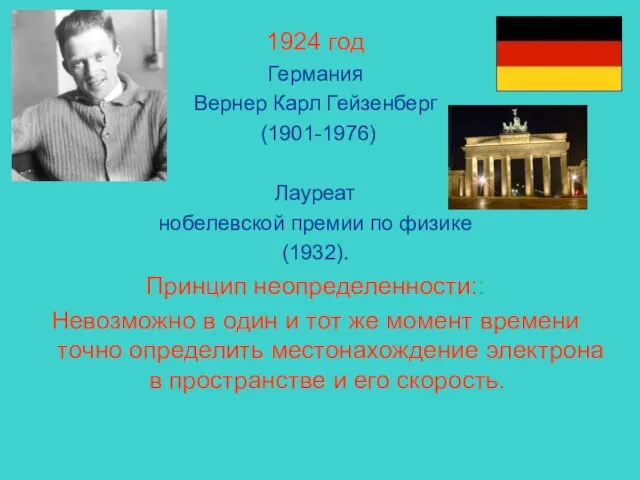
- 4. 1924 год Германия Вернер Карл Гейзенберг (1901-1976) Лауреат нобелевской премии по физике (1932). Принцип неопределенности:: Невозможно
- 5. 1926 год Австрия Эрвин Шредингер (1887-1961) Лауреат нобелевской премии по физике (1933) Уравнение Шредингера
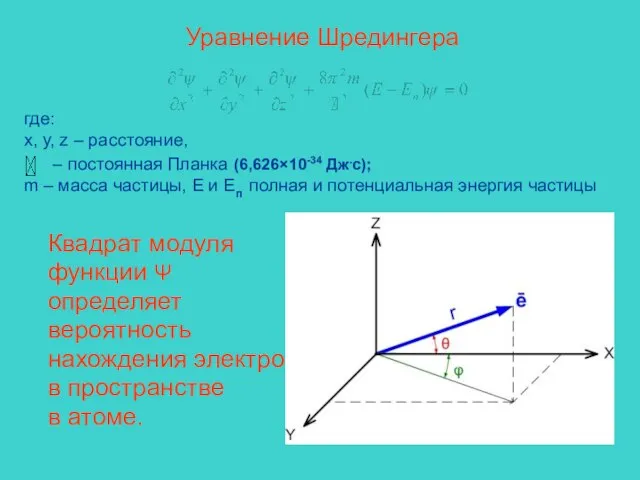
- 6. Уравнение Шредингера где: x, y, z – расстояние, – постоянная Планка (6,626×10-34 Дж.с); m – масса
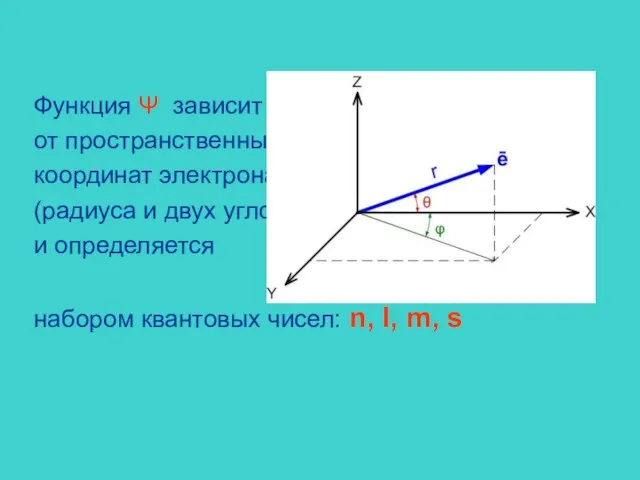
- 7. Функция Ψ зависит от пространственных координат электрона (радиуса и двух углов) и определяется набором квантовых чисел:
- 8. Квантовые числа
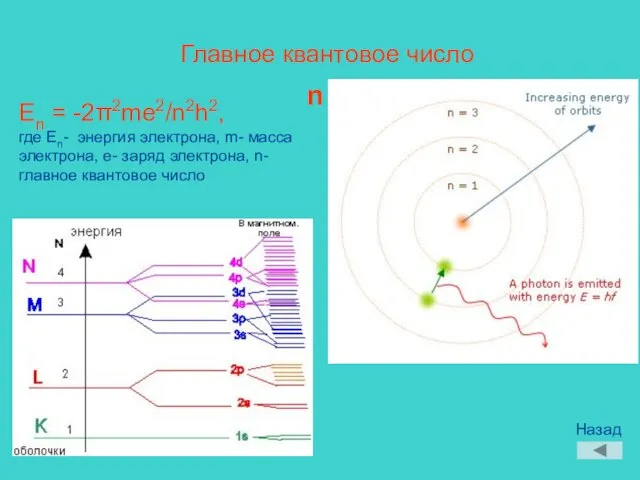
- 9. Главное квантовое число n En = -2π2me2/n2h2, где En- энергия электрона, m- масса электрона, e- заряд
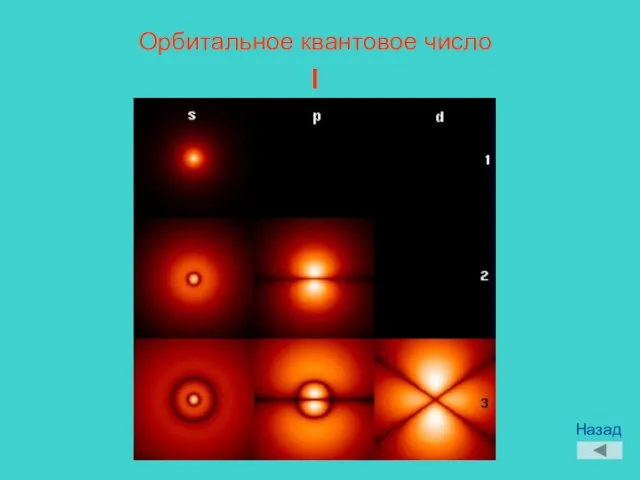
- 10. Орбитальное квантовое число l Назад
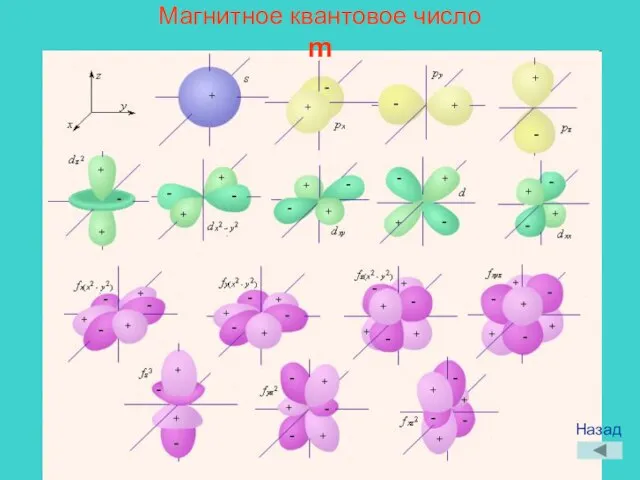
- 11. Магнитное квантовое число m Назад
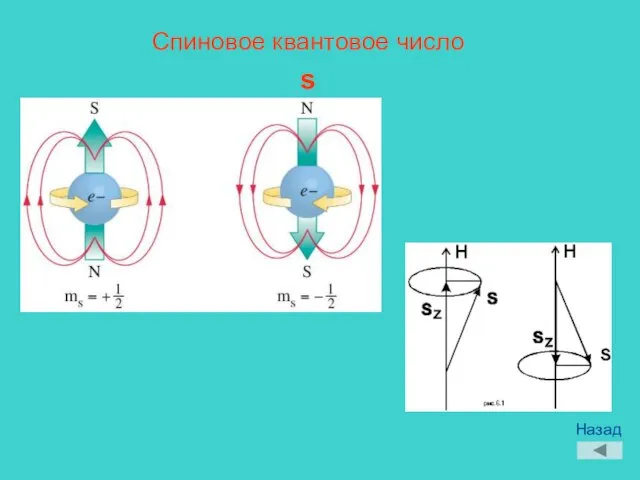
- 12. Спиновое квантовое число s Назад
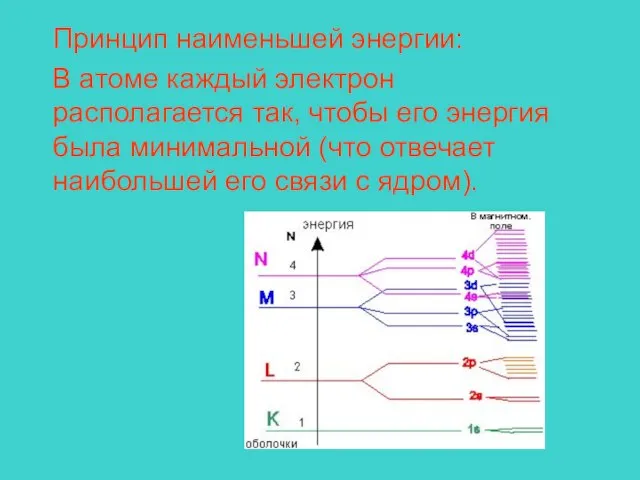
- 13. Принцип наименьшей энергии: В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает
- 14. 1961 Клечковский Всеволод Маврикиевич (1900 -1972) Россия Правило Клечковского: Электрон занимает в основном состоянии уровень не
- 15. 1940 Вольфганг Эрнст Паули (1900 – 1958) Австрия Лауреат нобелевской премии (1945) Принцип Паули: В атоме
- 16. Фридрих Хунд (1896 – 1997) Германия Правило Хунда: При данном значении l (т. е. в пределах
- 18. Скачать презентацию







 Презентация на тему Образ черкесского воина в творчестве М.Ю.Лермонтова
Презентация на тему Образ черкесского воина в творчестве М.Ю.Лермонтова Презентация без названия
Презентация без названия Русская механика
Русская механика 85098d15eff741ddb056b49a74c773e6
85098d15eff741ddb056b49a74c773e6 Общественный фонд«Добровольное Общество «Милосердие»проект«Казахстан без Сирот!»
Общественный фонд«Добровольное Общество «Милосердие»проект«Казахстан без Сирот!» Олимпийские игры – символ мира и единения
Олимпийские игры – символ мира и единения Правила личной гигиены
Правила личной гигиены Предложение Группы компаний СИС для ОФИСНЫХ ЗДАНИЙ. - презентация___________________________________________________________________________________________________________________
Предложение Группы компаний СИС для ОФИСНЫХ ЗДАНИЙ. - презентация___________________________________________________________________________________________________________________ Дизайн упаковки. Темы для выпускной квалификационной работы
Дизайн упаковки. Темы для выпускной квалификационной работы Двухфакторная теория Герцберга
Двухфакторная теория Герцберга 20170225_pochvy
20170225_pochvy Компьютер и здоровье 10 класс
Компьютер и здоровье 10 класс Правила санитарии, гигиены и безопасной работы
Правила санитарии, гигиены и безопасной работы Нормативные документы. Обязанности вожатого
Нормативные документы. Обязанности вожатого Презентация на тему Темза
Презентация на тему Темза  «Беспроводные системы связи в управлении перевозочным процессом и обеспечении безопасности движения»
«Беспроводные системы связи в управлении перевозочным процессом и обеспечении безопасности движения» Презентация на тему Как вести себя дома
Презентация на тему Как вести себя дома  Криминогенные ситуации в доме, в подъезде, на улице (5 класс)
Криминогенные ситуации в доме, в подъезде, на улице (5 класс) Древние орнаменты в творчестве художников разного времени. 6 класс
Древние орнаменты в творчестве художников разного времени. 6 класс Внедрение принципов экологического менеджмента в пао ФСК ЕЭС
Внедрение принципов экологического менеджмента в пао ФСК ЕЭС Югендстиль. Возникновение и описание
Югендстиль. Возникновение и описание Хит 2009 Экзотический фрукт!
Хит 2009 Экзотический фрукт! С чего начать свое дело: бизнес-план (пошаговая инструкция: как составить бизнес-план)
С чего начать свое дело: бизнес-план (пошаговая инструкция: как составить бизнес-план) Обучение иноязычному дискурсу с применением компьютерных технологий. Темы работ
Обучение иноязычному дискурсу с применением компьютерных технологий. Темы работ Представление курса
Представление курса Зеленый материк планеты
Зеленый материк планеты ПРОЕКТЫ СТАНДАРТОВ В СИСТЕМЕ ПЕРСОНАЛЬНОГО УЧЕТА НАСЕЛЕНИЯ РОССИИ Е. В. Бойченко ЗАО «ИВЦ ИНСОФТ»
ПРОЕКТЫ СТАНДАРТОВ В СИСТЕМЕ ПЕРСОНАЛЬНОГО УЧЕТА НАСЕЛЕНИЯ РОССИИ Е. В. Бойченко ЗАО «ИВЦ ИНСОФТ» Формы отчета о самообследовании
Формы отчета о самообследовании