В древности арабские алхимики получали из оазиса Амон, находившегося около храма, бесцветные кристаллы. растирали в ступках, нагревали – и получали едкий газ. Сначала его именовали аммониак, а потом сократили название до «аммиак».
В 18 веке аммиак был получен английским химиком Джозефом Пристли.
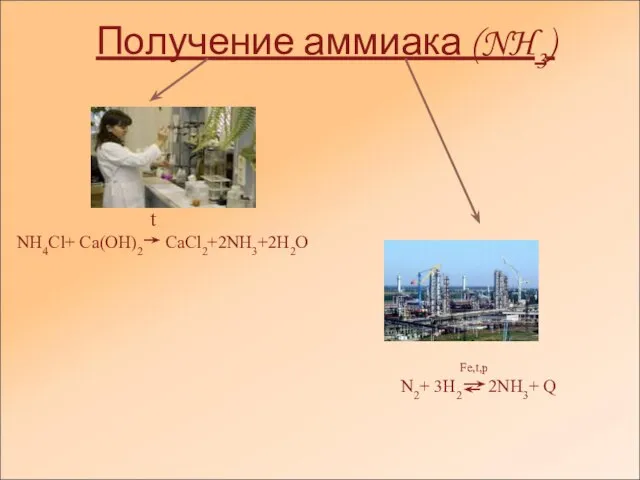
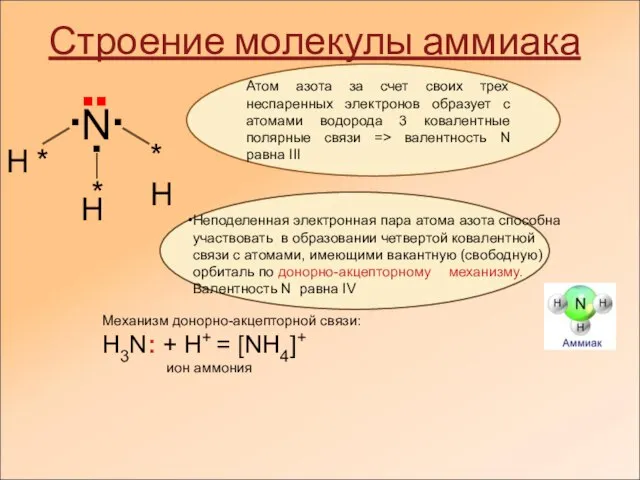
Сегодня аммиак — исключительной важности сырье для производства азотсодержащих веществ, применяемых в сельском хозяйстве, химии, медицине, военном деле. И что не менее важно, он является одним из продуктов белкового обмена в организме.




 Предложение по проведению медиакампании для номинантов «Национальной Цифровой премии» «Золотой» пакет
Предложение по проведению медиакампании для номинантов «Национальной Цифровой премии» «Золотой» пакет Сенситивные периоды человека (методика Марии Монтессори)
Сенситивные периоды человека (методика Марии Монтессори) Проект «Воспитание гражданина демократического общества» Место реализации: МОУ СОШ 33 г. Томска Срок реализации: 2008-2009 г. г. Целевая
Проект «Воспитание гражданина демократического общества» Место реализации: МОУ СОШ 33 г. Томска Срок реализации: 2008-2009 г. г. Целевая  Общие и специальные функции физической культуры
Общие и специальные функции физической культуры Стандарт организации работы общеобразовательной школы
Стандарт организации работы общеобразовательной школы Викторина "Знатоки космоса" для начальной школы
Викторина "Знатоки космоса" для начальной школы Что такое сила
Что такое сила Составители: Балдина Ирина Владимировна, заместитель директора Центра дополнительного образования для детей "Юность" г. Белгорода
Составители: Балдина Ирина Владимировна, заместитель директора Центра дополнительного образования для детей "Юность" г. Белгорода Кредит
Кредит Городские общественные пространства
Городские общественные пространства Туризм
Туризм  Презентация на тему Первые русские князья
Презентация на тему Первые русские князья ООО СэндвичПанель - Лайт. Бизнес-план
ООО СэндвичПанель - Лайт. Бизнес-план Эволюция Российского герба
Эволюция Российского герба Лукас Кранах Старший
Лукас Кранах Старший Запасы на зиму
Запасы на зиму Итоги государственного экзамена
Итоги государственного экзамена Доходная недвижимость. Инвесторский ремонт. Урок 6
Доходная недвижимость. Инвесторский ремонт. Урок 6 Два имени, две судьбы
Два имени, две судьбы Украшения ручной работы в технике фриволите
Украшения ручной работы в технике фриволите театр ноябрь
театр ноябрь What Do We Eat For Breakfast (Lunch, Dinner)?
What Do We Eat For Breakfast (Lunch, Dinner)? Город здоровья
Город здоровья Безверхий К.Ю
Безверхий К.Ю Правописание безударных гласных в корне слова
Правописание безударных гласных в корне слова Олигофрения
Олигофрения Как справиться со стрессом при пандемии
Как справиться со стрессом при пандемии Стилистические фигуры
Стилистические фигуры