Содержание
- 2. Общая характеристика Общая формула гомологического ряда предельных одноатомных спиртов — CnH2n+1OH. В зависимости от того, при
- 3. вторичные спирты третичный спирт Изомерия одноатомных спиртов связана: со строением углеродного скелета (например, бутанол-2 и 2-метилпропанол-2)
- 4. Номенклатура Названия спиртов образуют, добавляя окончание -ол к названию углеводорода с самой длинной углеродной цепью, включающей
- 5. Физические свойства Низшие спирты (до C15) — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются
- 6. Образование водородных связей Образование водородной связи между молекулами спирта … между молекулами воды … между молекулами
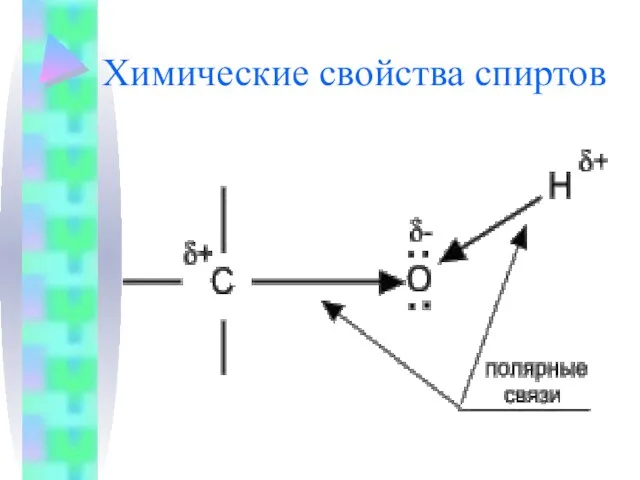
- 7. Химические свойства спиртов
- 8. Химические свойства спиртов определяются присутствием в их молекулах гидроксильной группы ОН-. Связи С-О и О- Н
- 9. Реакции сопровождающиеся разрывом связи С-О: (здесь проявляются слабые основные свойства спиртов) внутримолекулярная дегидратация с образованием алкенов
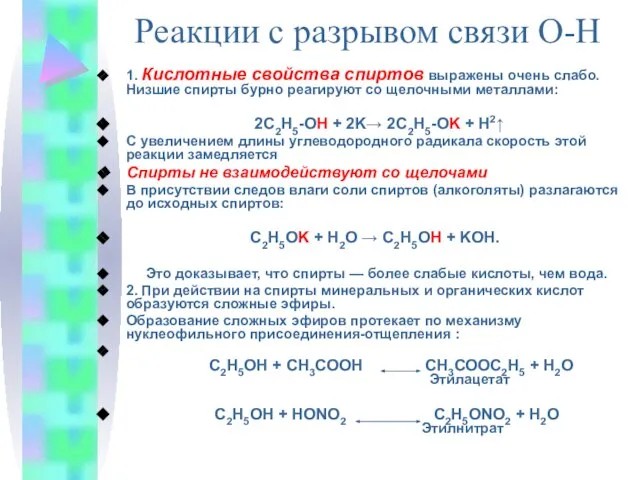
- 10. 1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют со щелочными металлами: 2С2Н5-ОН +
- 11. Отличительной особенностью первой из этих реакций является то, что атом водорода отщепляется от спирта, а группа
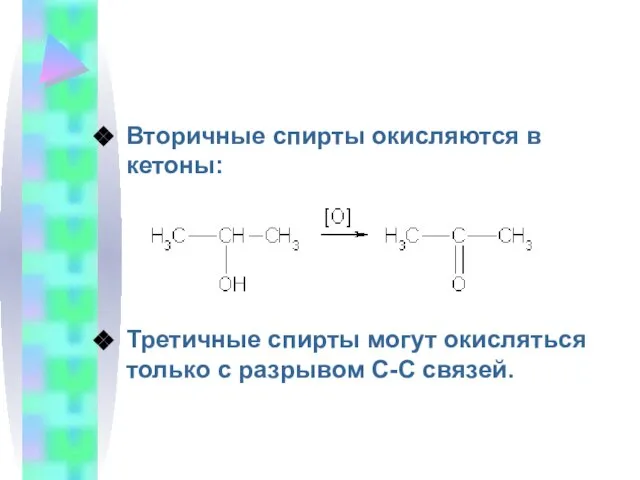
- 12. Вторичные спирты окисляются в кетоны: Третичные спирты могут окисляться только с разрывом С-С связей.
- 13. Реакции с разрывом связи С-О. Реакции дегидратации протекают при нагревании спиртов с водоотнимающими веществами. При сильном
- 14. Получение 1. Самый общий способ получения спиртов, имеющий промышленное значение, — гидратация алкенов. Реакция идет при
- 15. 3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичный спирты, при восстановлении кетонов — вторичные: R—CH=O
- 16. Применение спиртов Спирты главным образом используют в промышленности органического синтеза. Этанол - важное сырье пищевой промышленности.
- 18. Скачать презентацию












 MY DREAM by GILLIAN BROWN
MY DREAM by GILLIAN BROWN  Мастер-класс Мышка из пластилина
Мастер-класс Мышка из пластилина Классификация приемников электроэнергии
Классификация приемников электроэнергии Научно-практическая конференция «Познание малой Родины через реализацию национально-государственного компонента государствен
Научно-практическая конференция «Познание малой Родины через реализацию национально-государственного компонента государствен Установка качелей
Установка качелей Кроссворд Мифы древней Греции
Кроссворд Мифы древней Греции Презентация на тему Былины 2 класс
Презентация на тему Былины 2 класс Сергей Есенин как национальный поэт
Сергей Есенин как национальный поэт Вермут. Абсент. Классификация
Вермут. Абсент. Классификация Презентация на тему Богиня Лада
Презентация на тему Богиня Лада Нахождение неизвестного слагаемого 1 класс
Нахождение неизвестного слагаемого 1 класс Как привить любовь к чтению
Как привить любовь к чтению Разработка концепции способностей как проблемы психологии индивидуальных различий
Разработка концепции способностей как проблемы психологии индивидуальных различий ОАО Шоколаднички
ОАО Шоколаднички Профессия эколог
Профессия эколог Основы административного права
Основы административного права История развития психопатологии в России
История развития психопатологии в России Подготовка МОУ Назаровская СОШ к летней оздоровительной кампании 2011 года
Подготовка МОУ Назаровская СОШ к летней оздоровительной кампании 2011 года Подходы к образованию. Робототехника
Подходы к образованию. Робототехника Гимнастика
Гимнастика Обеспечение физической готовности спортсмена к соревновательной и тренировочной деятельности
Обеспечение физической готовности спортсмена к соревновательной и тренировочной деятельности «Каритас Санкт-Петербург» Адрес: Санкт-Петербург, Саперный пер., д.5.Факс:272-63-53Электронная почта:
«Каритас Санкт-Петербург» Адрес: Санкт-Петербург, Саперный пер., д.5.Факс:272-63-53Электронная почта: 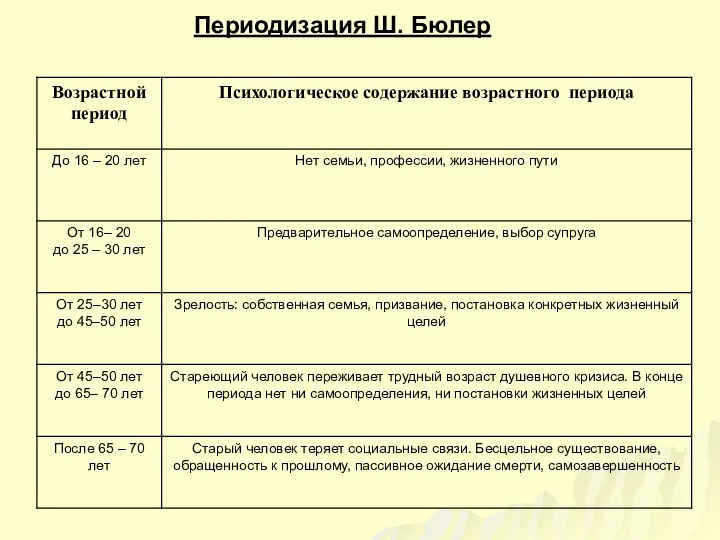 Периодизация Ш. Бюлер
Периодизация Ш. Бюлер Гомельская вобласцьКармянскі раенв. ДубавіцаРагавенка Т.А. 9 класКіраўнік : педагог-арганізатар Лашкевіч А.В.тэл. 6646516
Гомельская вобласцьКармянскі раенв. ДубавіцаРагавенка Т.А. 9 класКіраўнік : педагог-арганізатар Лашкевіч А.В.тэл. 6646516 Социальная медицина
Социальная медицина Реки и озера Кольского полуострова
Реки и озера Кольского полуострова БЕЗУДАРНЫЕ ГЛАСНЫЕ В КОРНЕ СЛОВА
БЕЗУДАРНЫЕ ГЛАСНЫЕ В КОРНЕ СЛОВА Оценка эффективности использования городских территорий
Оценка эффективности использования городских территорий