Содержание
- 2. СОСТАВ СПИРТОВ Спирты – кислородсодержащие органические соединения. Спирты – это органические соединения, в молекулах которых содержится
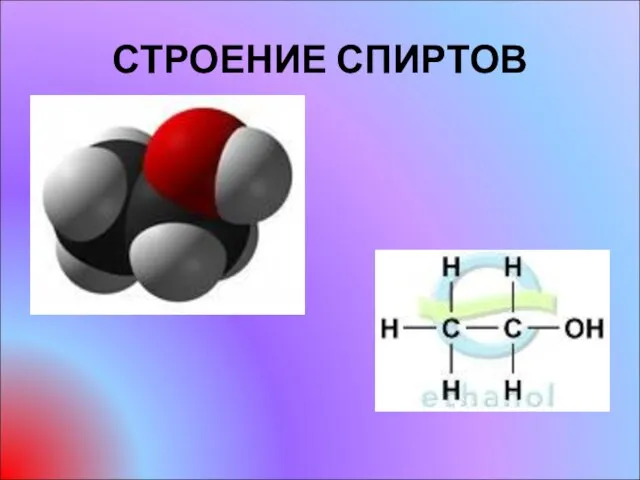
- 3. СТРОЕНИЕ СПИРТОВ
- 4. НОМЕНКЛАТУРА Предельный УВ + ОЛ = название спирта метан метанол (метиловый спирт) этан этанол (этиловый спирт)
- 5. НОМЕНКЛАТУРА Углеводородную цепь нумеруют с того конца, к которому ближе расположена ОН-группа. Далее используют эту нумерацию,
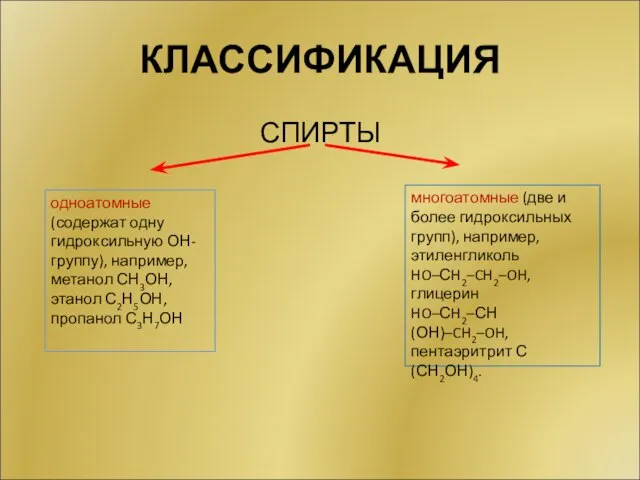
- 6. КЛАССИФИКАЦИЯ СПИРТЫ одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН многоатомные (две
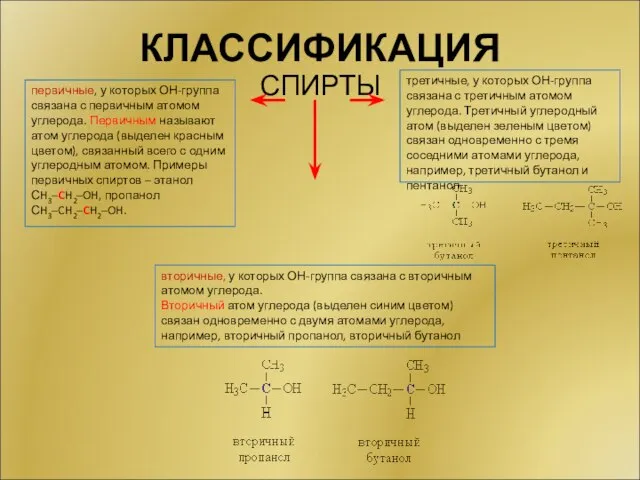
- 7. КЛАССИФИКАЦИЯ СПИРТЫ первичные, у которых ОН-группа связана с первичным атомом углерода. Первичным называют атом углерода (выделен
- 8. КЛАССИФИКАЦИЯ У многоатомных спиртов, содержащих две или более ОН-групп, могут присутствовать одновременно как первичные, так и
- 9. КЛАССИФИКАЦИЯ По строению органических групп, связанных ОН-группой, спирты подразделяют на предельные (метанол, этанол, пропанол), непредельные, например,
- 10. ИЗОМЕРИЯ по разветвлению углеводородного скелета по положению функциональной группы СН3-CH2-CH-CH3 СH3-CH-CH2-OH OH CH3 Первичный бутиловый спирт,
- 11. ФИЗИЧЕСКИЕ СВОЙСТВА Спирты растворимы в большинстве органических растворителей, первые три простейших представителя – метанол, этанол и
- 12. ХИМИЧЕСКИЕ СВОЙСТВА Спирты отличаются разнообразными превращениями. Реакции спиртов имеют некоторые общие закономерности: реакционная способность первичных одноатомных
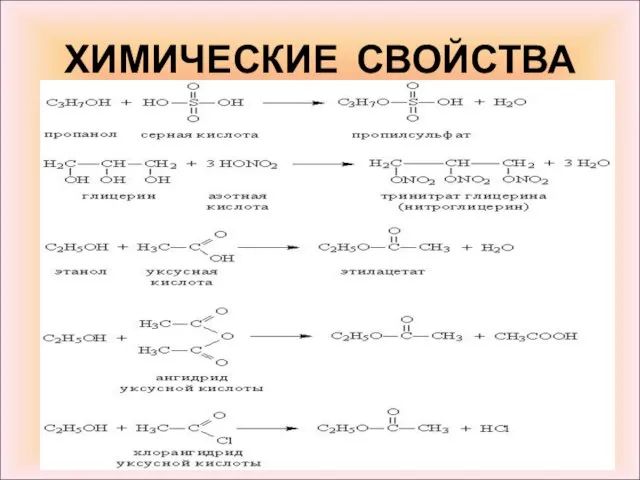
- 13. ХИМИЧЕСКИЕ СВОЙСТВА 1. Реакции, протекающие по связи О–Н. При взаимодействии с активными металлами (Na, K, Mg,
- 14. ХИМИЧЕСКИЕ СВОЙСТВА Они могут образовывать алкоголяты не только при взаимодействии с металлами, но и со щелочами:
- 15. ХИМИЧЕСКИЕ СВОЙСТВА
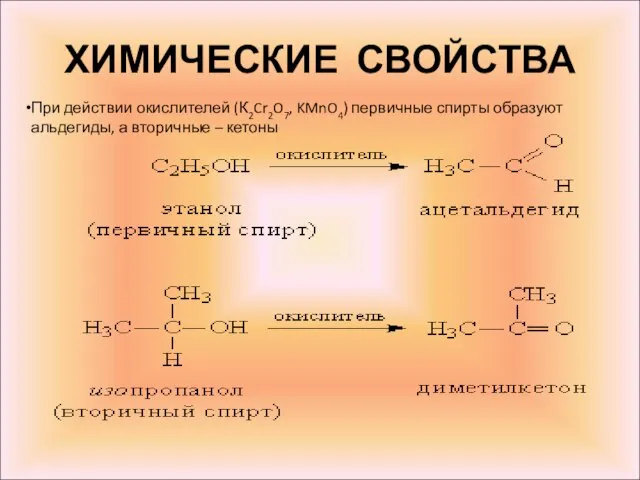
- 16. ХИМИЧЕСКИЕ СВОЙСТВА При действии окислителей (К2Cr2O7, KMnO4) первичные спирты образуют альдегиды, а вторичные – кетоны
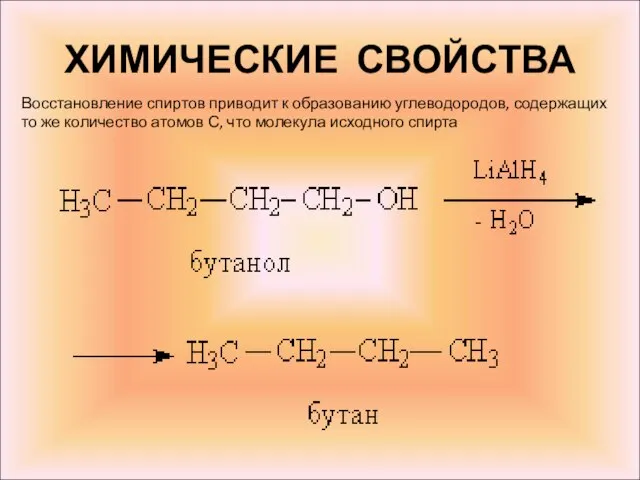
- 17. ХИМИЧЕСКИЕ СВОЙСТВА Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С, что молекула
- 18. ХИМИЧЕСКИЕ СВОЙСТВА 2. Реакции, протекающие по связи С–О. В присутствии катализаторов или сильных минеральных кислот происходит
- 19. ПОЛУЧЕНИЕ Этанол образуется и при так называемом спиртовом брожении сахаров, например, глюкозы С6Н12О6. Процесс протекает в
- 20. ПОЛУЧЕНИЕ Растворы спирта более высокой концентрации получают перегонкой. Метанол получают в промышленности восстановлением монооксида углерода при
- 22. Скачать презентацию













 ORDERS OF ARCHITECTURE
ORDERS OF ARCHITECTURE Кабельные системы обогрева в строительстве
Кабельные системы обогрева в строительстве Презентация на тему Жаркие пустыни
Презентация на тему Жаркие пустыни Воронцов А.Б. 21 мая 2010
Воронцов А.Б. 21 мая 2010 Имидж, поведение и репутация как фактор жизненного успеха
Имидж, поведение и репутация как фактор жизненного успеха День матери
День матери Пингвины
Пингвины Политическая власть. Тема 3
Политическая власть. Тема 3 Разработка электрической винто-моторной группы для лёгкого летательного аппарата
Разработка электрической винто-моторной группы для лёгкого летательного аппарата  Детское воскресное служение
Детское воскресное служение Технология кислородной резки
Технология кислородной резки История вышивки лентами
История вышивки лентами 11 Программа развития МБСКОУ СКОШ 3 VIII вида г. Ишима на 2012 – 2014 гг. Департамент по социальным вопросам администрации г. Ишима Муницип
11 Программа развития МБСКОУ СКОШ 3 VIII вида г. Ишима на 2012 – 2014 гг. Департамент по социальным вопросам администрации г. Ишима Муницип Решение задач на движение
Решение задач на движение Olympiade in der Schule
Olympiade in der Schule Имущественные права личного характера в российском гражданском праве
Имущественные права личного характера в российском гражданском праве Ежегодно команда юношей принимает участиев межрегиональных соревнованиях среди кадетских корпусов, православных гимназий, дет
Ежегодно команда юношей принимает участиев межрегиональных соревнованиях среди кадетских корпусов, православных гимназий, дет Традиции Бурятии
Традиции Бурятии Сайт, который продает. Интернет магазин – это легко!
Сайт, который продает. Интернет магазин – это легко! Применение СУП в командной работе
Применение СУП в командной работе Н.В. Гоголь «Женитьба»
Н.В. Гоголь «Женитьба» Девиантное поведение
Девиантное поведение Педагогическая компетентность учителя как результат самообразования
Педагогическая компетентность учителя как результат самообразования Натюрморт с чучелом птицы
Натюрморт с чучелом птицы Право на оружие
Право на оружие "Ты не одинока"
"Ты не одинока" Курсы дистанционного обучения для электроэнергетики
Курсы дистанционного обучения для электроэнергетики Церковь Иль-Джезу
Церковь Иль-Джезу