Содержание
- 2. Атомно-молекулярное учение Модели строения атома Электронные конфигурации атомов Радиоактивность
- 3. Первый определил химию как науку М. В. Ломоносов. Он считал, что химия должна строиться на точных
- 4. Молекула - это наименьшая частица вещества, сохраняющая его состав и химические свойства. Молекула не может дробиться
- 5. Современное изложение основных положений атомно-молекулярного учения: Все вещества состоят из атомов. 2. Атомы каждого вида (элемента)
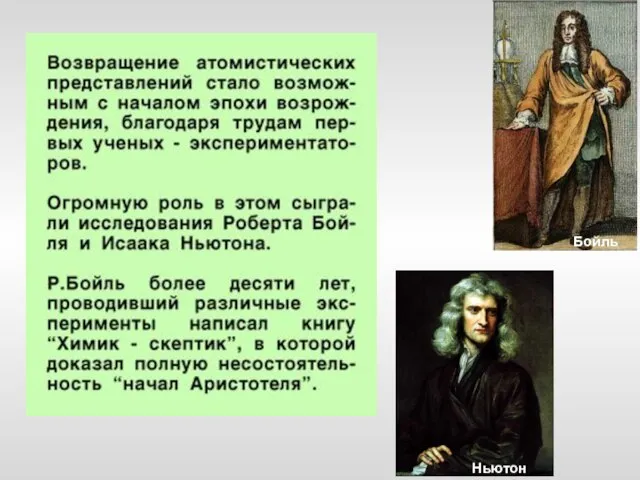
- 7. Бойль Ньютон
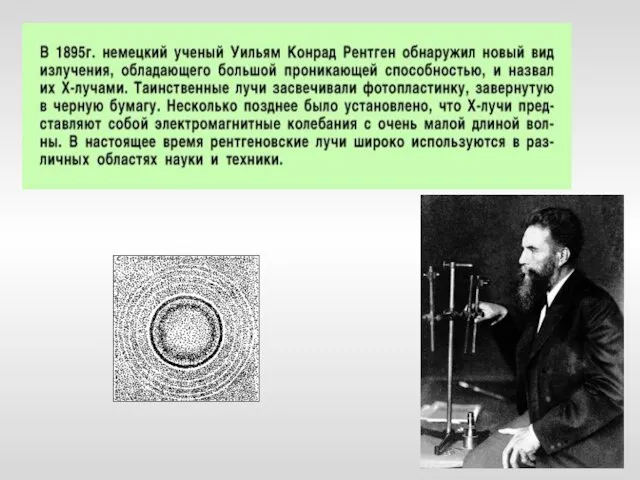
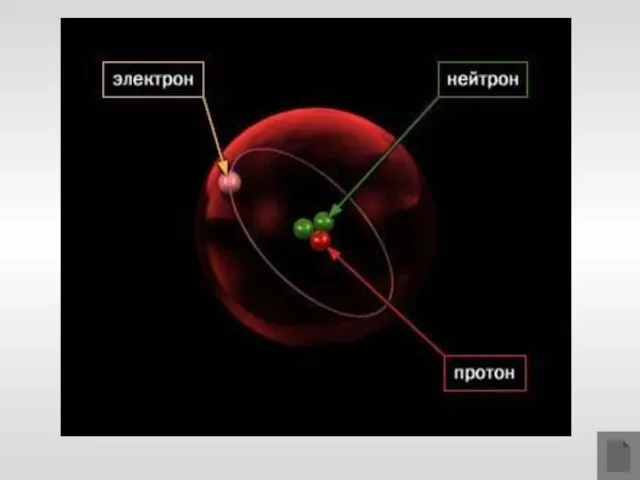
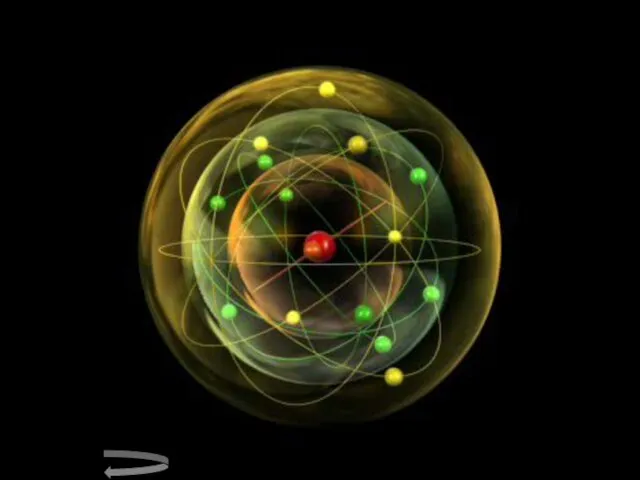
- 14. Модель строения атома Научные исследования, проводившиеся в конце XIX – начале XX вв. позволили предложить следующую
- 17. Электронные конфигурации атомов Электроны располагаются в атомах не хаотично, а на определённом расстоянии от ядра (орбите).
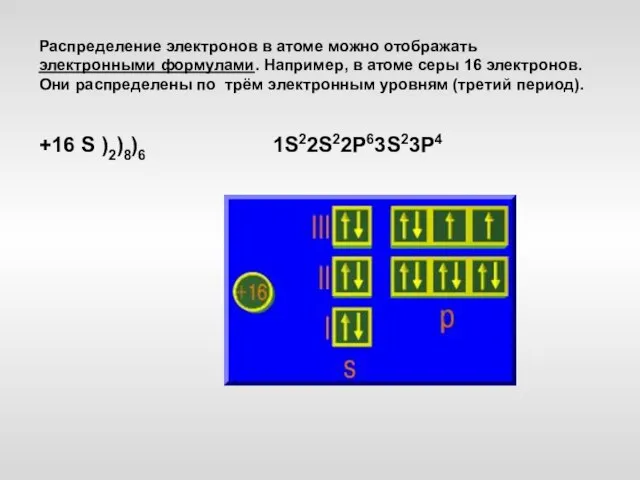
- 18. Распределение электронов в атоме можно отображать электронными формулами. Например, в атоме серы 16 электронов. Они распределены
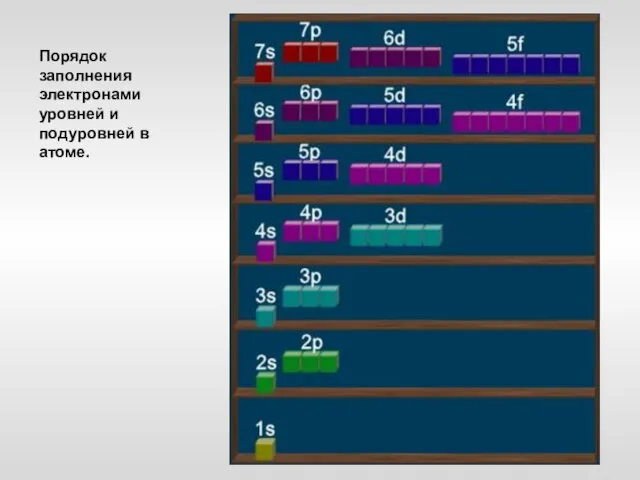
- 19. Порядок заполнения электронами уровней и подуровней в атоме.
- 21. Явление спонтанного деления атомов, сопровождающееся испусканием альфа-, бета- и гамма-лучей, называется естественной радиоактивностью, а элементы, атомы
- 22. Явление радиоактивного распада используется для получения ядерной энергии, для научных исследований, в медицине.
- 25. Скачать презентацию















 Олимпийский чемпион
Олимпийский чемпион Творческая мастерская построения знаний
Творческая мастерская построения знаний Ремёсла в России 17 – 18 вв.
Ремёсла в России 17 – 18 вв. Традиции празднования Святой Пасхи
Традиции празднования Святой Пасхи НАТО Организация Североатлантического договора
НАТО Организация Североатлантического договора Пуск преобразователя. Снятие питания с 14 провода. Включение РБР
Пуск преобразователя. Снятие питания с 14 провода. Включение РБР Ускоряем внедрение инноваций: прогрессивные инструменты уже и в России
Ускоряем внедрение инноваций: прогрессивные инструменты уже и в России Система предназначена для автоматизации учета потребления электрической и тепловой энергии, учета расхода воды и газа. Система АИ
Система предназначена для автоматизации учета потребления электрической и тепловой энергии, учета расхода воды и газа. Система АИ Игра. Всё как оно есть
Игра. Всё как оно есть Водные виды спорта
Водные виды спорта Презентация на тему Инфразвук
Презентация на тему Инфразвук English
English Работа в приложении MS Project
Работа в приложении MS Project Logicași calculul propozițional
Logicași calculul propozițional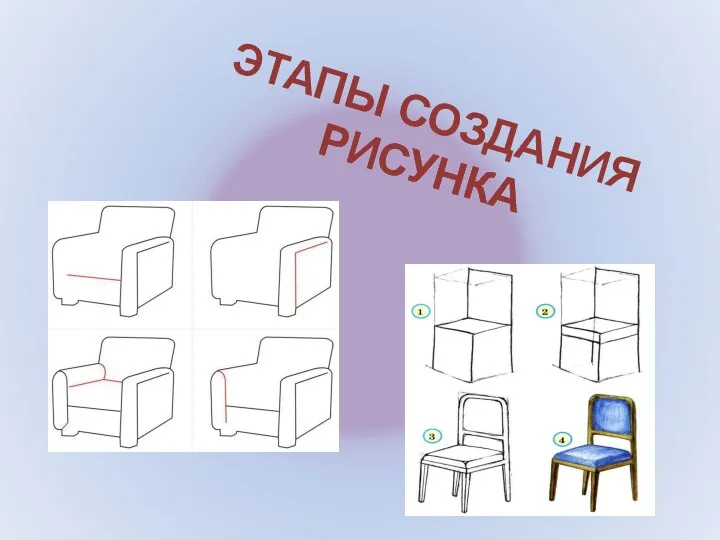 Этапы создания рисунка
Этапы создания рисунка Общепризнано, что современного человека должны отличать ответственность и инициативность, продуктивность и эффективность, адапт
Общепризнано, что современного человека должны отличать ответственность и инициативность, продуктивность и эффективность, адапт Пиление древесины. 5 класс
Пиление древесины. 5 класс БРАЗИЛИЯ
БРАЗИЛИЯ Секреты пластилина. Котенок
Секреты пластилина. Котенок Проволока
Проволока Окрашивание изделий из древесины красками
Окрашивание изделий из древесины красками Квалификационная работа: Модернизация котельной с увеличением мощности в г. Тверь
Квалификационная работа: Модернизация котельной с увеличением мощности в г. Тверь Пётр Николаевич Черняев
Пётр Николаевич Черняев Центр экспорта
Центр экспорта Устное народное творчество - Былины
Устное народное творчество - Былины Урок-лекция: Аппаратное обеспечение КС
Урок-лекция: Аппаратное обеспечение КС Создание социально-педагогических условий для интеграции общего и начального профессионального образования
Создание социально-педагогических условий для интеграции общего и начального профессионального образования Тема урока: «Своеобразие архитектурных традиций. Особенности храмового зодчества» Урок МХК в 9 классе
Тема урока: «Своеобразие архитектурных традиций. Особенности храмового зодчества» Урок МХК в 9 классе