Слайд 2АТОМЫ И ЭЛЕМЕНТЫ
Окружающий нас мир состоит из веществ, а вещества образованы мельчайшими

частицами: кристаллами, молекулами и атомами. При этом наименьшими структурными частицами веществ являются молекулы (у молекулярных веществ) или кристаллы (атомные либо ионные). Из атомов же состоят лишь благородные газы: He, Ne, Ar, Kr, Xe, Rn. Определённый вид атомов с одинаковым зарядом ядра называют химическим элементом.
Слайд 3ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
В настоящее время известно более 114 химических элементов, но устойчивыми являются

только 83 элемента, остальные либо не существуют в природе (поэтому их получают путём радиоактивного синтеза), либо естественно радиоактивны, то есть самопроизвольно превращаются в другие химические элементы с излучением энергии и элементарных частиц. Данные о химических элементах собраны в Периодической системе Д.И.Менделеева (1869 год).
Слайд 4СИМВОЛЫ (ЗНАКИ) ЭЛЕМЕНТОВ
Химические знаки современного вида были предложены шведским химиком Й. Я.Берцелиусом
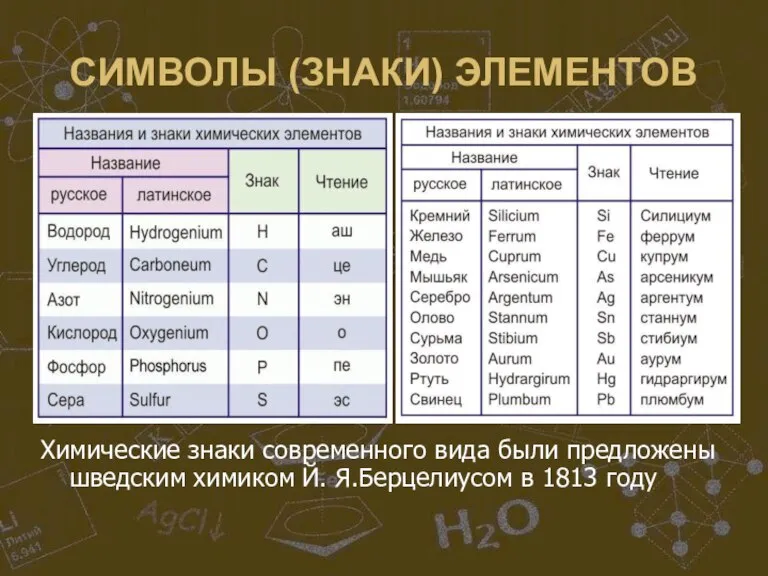
в 1813 году
Слайд 5ПЕРИОДИЧЕСКАЯ СИСТЕМА
В настоящее время общепринятой является короткопериодная форма Периодической системы. Все элементы

расположены в порядке возрастания атомной массы. Горизонтальные строки, в которых у атомов происходит образование устойчивого внешнего электронного слоя, называются периодами. Периодов всего семь: 3 периода - малые и 4 - большие, причём последний ещё не завершён. В периодах слева направо закономерно уменьшается радиус атома, ослабевают металлические и усиливаются неметаллические свойства элемента, возрастает его электроотрицательность (χ)
Слайд 6ПЕРИОДИЧЕСКАЯ СИСТЕМА
Вертикальные столбцы называют группами. Их восемь. Группы содержат элементы с одинаковой

высшей степенью окисления. Группы подразделены на подгруппы. Если в подгруппе есть элементы малых и больших периодов, то эта подгруппа главная – подгруппа «А». Если в подгруппе находятся элементы только больших периодов, тогда эта подгруппа называется побочной или подгруппой «Б». В группе сверху вниз закономерно увеличивается радиус атомов и усиливаются металлические свойства элементов.
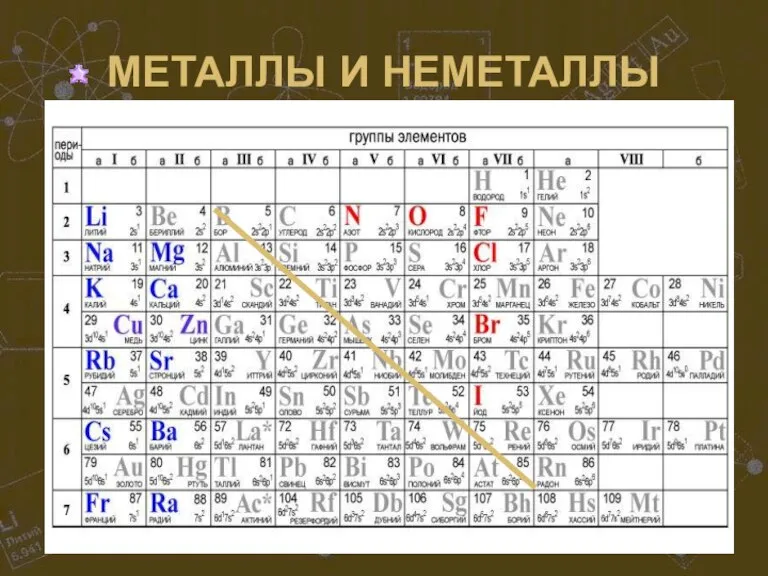
Слайд 8Если от элемента бора (В) провести условную линию к элементу астату (At),

то в главных подгруппах окажутся: правее и выше линии «B – At» – неметаллы; левее и ниже – металлы. Элементы, оказавшиеся вблизи этой линии проявляют переходные свойства. Неметаллов, включая благородные газы, насчитывается 22, все остальные элементы, в том числе и вновь синтезируемые, относятся к металлам. В побочных подгруппах находятся только металлы. Для металлов характерно небольшое число электронов на внешнем энергетическом уровне (1-3) и электроотрицательность ниже 2. Неметаллам присуща высокая электроотрицательность, 4 и более электронов на внешнем уровне. При образовании химических связей атомы металлов отдают внешние электроны, а атомы неметаллов их захватывают.
Слайд 9СТРОЕНИЕ АТОМА
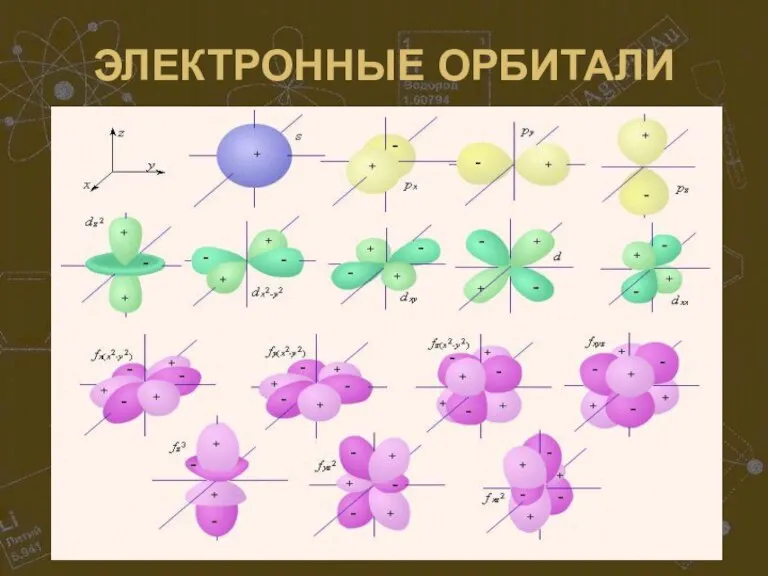
Атомы имеют сложное строение: вокруг положительно заряженного массивного ядра движутся по

определённым орбитам с огромной скоростью практически невесомые отрицательно заряженные электроны. Ядро состоит из нуклонов – протонов(+) и нейтронов(0). По форме орбиты электроны бывают 4 типов: s, p, d и f и образуют электронные облака (орбитали) 4 видов. Общее число электронов в атоме равно числу протонов в ядре, а число электронов на внешнем уровне (у элементов главных подгрупп) равно номеру группы. Число энергетических уровней (электронных слоёв) в атоме равно номеру периода.
Слайд 11ФОРМУЛЫ АТОМОВ
В современной химии строение атомов принято изображать при помощи электронно-графических формул.
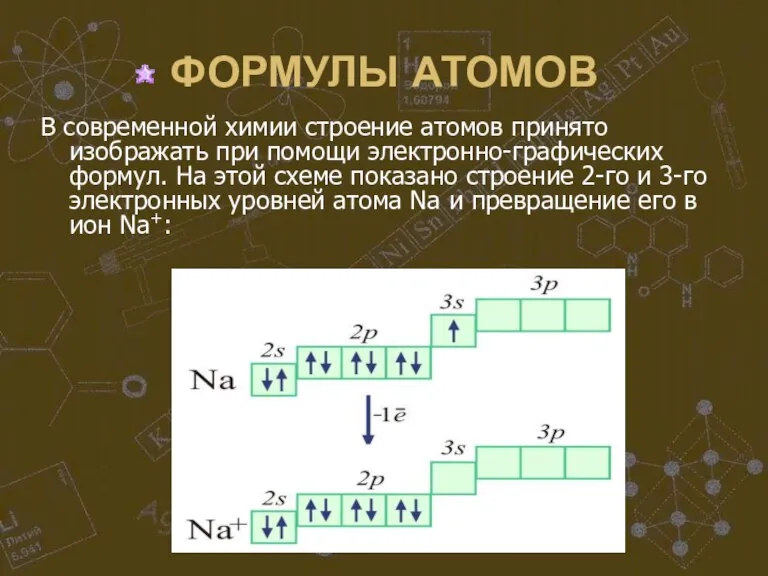
На этой схеме показано строение 2-го и 3-го электронных уровней атома Na и превращение его в ион Na+:
Слайд 12ФОРМУЛЫ АТОМОВ
На таких формулах квадратом обозначается электронная орбиталь, стрелки внутри квадрата символизируют

электроны, этажное расположение обозначает уровни и подуровни электронов. Графическая часть формулы подтверждается буквенно-цифровым обозначением. Отсюда их название: электронно-графические формулы.
Слайд 13ПОЛОЖЕНИЕ В СИСТЕМЕ
По положению в Системе можно определить:
Заряд ядра, число протонов в

ядре и общее число электронов = порядковый номер элемента;
Число энергетических уровней (электронных оболочек) = номер периода;
Число электронов на внешнем уровне у элементов главных подгрупп = номер группы;
Металл или неметалл – по расположению относительно линии «B-At».
Слайд 14ХАРАКТЕРИСТИКИ ЭЛЕМЕНТА
Химический элемент можно характеризовать по следующим пунктам:
Положение в Периодической системе;
Металл или

неметалл;
Электроотрицательность, то есть сила притяжения электронов к ядру;
Степень окисления, то есть число отданных или захваченных в процессе образования данного вещества, электронов (применяется к любым химическим элементам);
Валентность, то есть число образованных в данном веществе общих пар электронов (корректнее применять эту характеристику только к неметаллам).
Слайд 15ВЗАИМОДЕЙСТВИЯ АТОМОВ
Для атомов присуще стремление приобрести более устойчивую и энергетически выгодную электронную

конфигурацию, характерную для благородных газов (завершённый внешний энергетический уровень – «электронный октет»). В результате взаимодействия между собой, атомы более электроотрицательных элементов захватывают электроны на внешний уровень, а атомы менее электроотрицательных элементов – отдают свои внешние электроны.
Слайд 16ХИМИЧЕСКИЕ СВЯЗИ
Возможны 4 случая взаимодействия атомов:
Металл А – металл А, оба слабо

удерживают внешние электроны, - образуется металлическая связь;
Металл А (отдаёт электроны) – неметалл В (захватывает электроны), образуются положительные и отрицательные ионы, а между ними ионная связь;
Неметалл В – неметалл С (электронные пары подтягивает к себе более электроотрицательный неметалл, образуется полярная ковалентная связь);
Неметалл В – неметалл В (электронные пары расположены строго посередине, так как электроотрицательность обоих атомов одинакова, образуется неполярная ковалентная связь).
Слайд 17ИОННАЯ И МЕТАЛЛИЧЕСКАЯ СВЯЗИ
Атомы металлов очень слабо удерживают свои внешние электроны и

в кристалле металла наряду с нейтральными атомами всегда присутствуют положительные ионы и свободно движущиеся электроны – «электронный газ». С этим связаны все типичные свойства простых веществ металлов: электропроводность, высокая теплопроводность, металлический блеск и ковкость. Таким образом, металлическая связь похожа на ионную, а свойства металлов - на свойства ионных веществ.
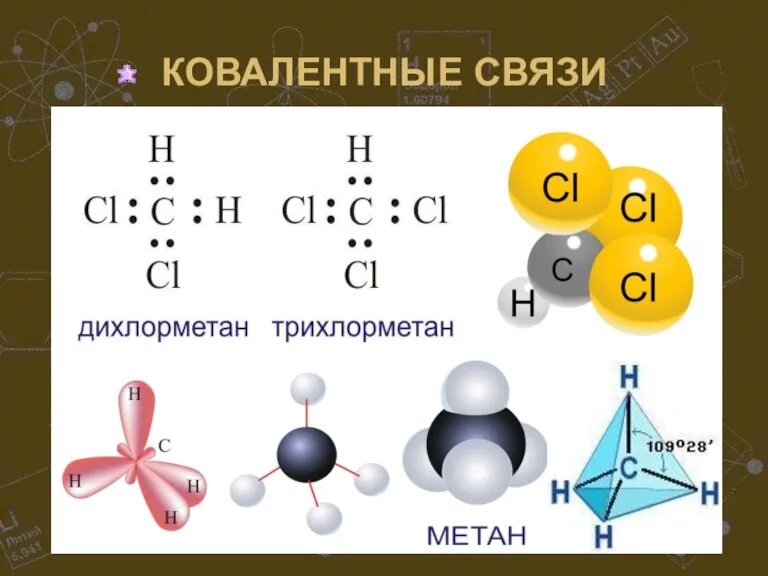
Слайд 19ОБРАЗОВАНИЕ КОВАЛЕНТНОЙ СВЯЗИ
Ковалентная связь формируется между атомами неметаллов в результате перекрывания электронных
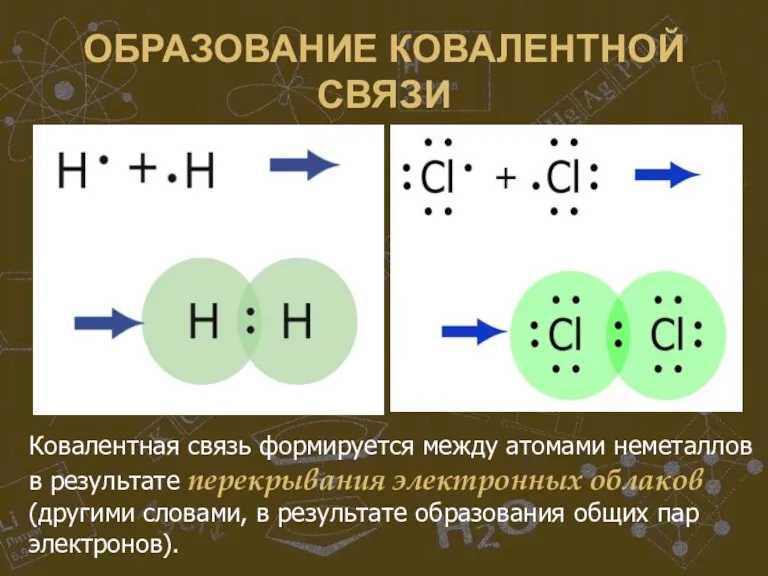
облаков (другими словами, в результате образования общих пар электронов).
Слайд 20ВИДЫ КОВАЛЕНТНЫХ СВЯЗЕЙ
Они могут быть неполярными, полярными, одинарными, двойными и тройными. Двойные
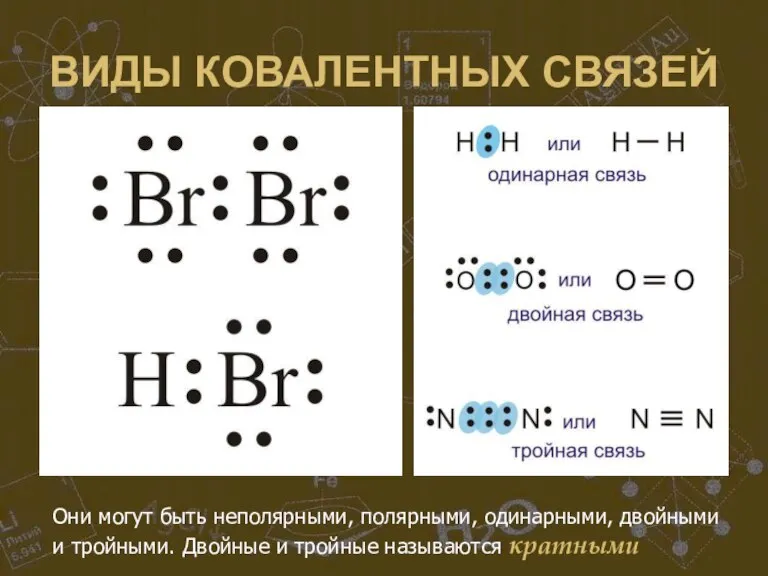
и тройные называются кратными
Слайд 21СОСТОЯНИЕ ВЕЩЕСТВА
Частицы вещества находятся в непрестанном хаотическом движении, при повышении температуры колебания

частиц усиливаются, а при понижении – замедляются. Соответственно существуют 3 агрегатных состояния веществ:
Твёрдое;
Жидкое;
Газообразное.
Слайд 23ПРОСТЫЕ ВЕЩЕСТВА-МЕТАЛЛЫ
Золото
Серебро

Слайд 24ПРОСТЫЕ ВЕЩЕСТВА-НЕМЕТАЛЛЫ
Углерод
Сера

Слайд 25БИНАРНЫЕ СОЕДИНЕНИЯ
Примером бинарных (состоящих из двух элементов) соединений являются оксиды. Здесь приведена
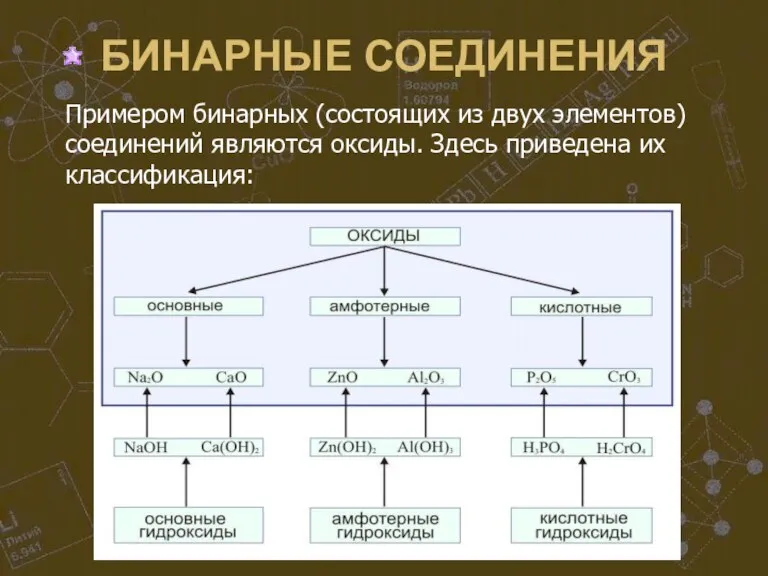
их классификация:
Слайд 26ХАРАКТЕРИСТИКА ВЕЩЕСТВА
Любое вещество можно характеризовать его физическими и химическими свойствами: цветом, запахом,

массой, плотностью, объёмом, критическими температурами, отношением к другим веществам. Специально для характеристики веществ введена величина, именуемая «количество вещества». Она обозначается как латинская «n» или греческая «ν(ню)» и измеряется в молях:
Слайд 27Mr и МОЛЯРНАЯ МАССА
Молярная масса веществ с атомным строением (или записываемых как

атомные: Cu, Fe, Au, C, S, P, Ne, Xe…) численно равняется их атомной массе Ar. Молярная масса остальных веществ численно равна их относительной молекулярной массе Mr.
M = Ar (г/моль ) и M = Mr (г/моль)






















 Философия Общая характеристика предмета
Философия Общая характеристика предмета Программа Microsoft PowerPoint
Программа Microsoft PowerPoint Цветущие дворики села. Фотовыставка
Цветущие дворики села. Фотовыставка Источники трудового права
Источники трудового права Социальная защита несовершеннолетних в РФ
Социальная защита несовершеннолетних в РФ Выражение отношения к окружающему миру через изображение животных
Выражение отношения к окружающему миру через изображение животных Гиппиус
Гиппиус Методика проведения игровых программ: практические советы и рекомендации
Методика проведения игровых программ: практические советы и рекомендации Презентация1
Презентация1 Мировая религия Буддизм 7 класс
Мировая религия Буддизм 7 класс Османская империя в XIV-XVI веках
Османская империя в XIV-XVI веках Открытое акционерное общество «Сибвзрывкомплект»
Открытое акционерное общество «Сибвзрывкомплект» SQA DAYS 9:Опыт создания своей QA компании
SQA DAYS 9:Опыт создания своей QA компании БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Выпускная работа по«Основам информационных технологий» Минск – 2010 г.
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Выпускная работа по«Основам информационных технологий» Минск – 2010 г. НИР-2008
НИР-2008 Речевые ошибки
Речевые ошибки Силикатная промышленность
Силикатная промышленность Криптовалюты. Блокчейн и биткойн
Криптовалюты. Блокчейн и биткойн Отчет о проделанной работе ЮАО. Бизнес разведка Тайм кафе
Отчет о проделанной работе ЮАО. Бизнес разведка Тайм кафе 1 класс
1 класс Бизнес-план антикафе Час за минуту
Бизнес-план антикафе Час за минуту ГК РФ Статья 87. Основные положения об обществе с ограниченной ответственностью
ГК РФ Статья 87. Основные положения об обществе с ограниченной ответственностью Повторение
Повторение Основы коммерческой деятельности
Основы коммерческой деятельности Алкоголь
Алкоголь Жизненный цикл проекта. Инициация
Жизненный цикл проекта. Инициация Потестарно-политические институты обских угров в дореволюционной России и в советское время (Никифорова И.М.)
Потестарно-политические институты обских угров в дореволюционной России и в советское время (Никифорова И.М.) Принятие управленческих решений
Принятие управленческих решений