Слайд 2ЦЕЛЬ УРОКА
познакомить учащихся с новым классом неорганических соединений - кислоты

Слайд 3ПРОВЕРКА ЗНАНИЙ
1. Из предложенного перечня веществ выпишите формулы оснований:
CuO , Mn2O7,

N2O3, HNO3, H2SO3, H2S, Fe(OH)2, NaOH, A1(OH)3, Ca3(PO4)2, ZnI2, Mg(NO2)2.
2. Дайте им название.
3. Составьте формулы оксидов, соответствующие этим основаниям.
Слайд 4На какие группы можно разделить основания?
Как это можно определить, не проводя опыт?

Слайд 6КЛАССИФИКАЦИЯ ОСНОВАНИЙ ПО РАСТВОРИМОСТИ
Слайд 7Каждое вещество имеет свое название! Как правильно дать название основанию?
LiOH –
Fe(OH)3
-
гидроксид лития
гидроксид железа (III)
Слайд 8Каждому основанию соответствует оксид. Что является обязательным условием данного соответствия?
Слайд 9ПРОБЛЕМА
Оксидам металлов соответствуют основания, а оксидам неметаллов?

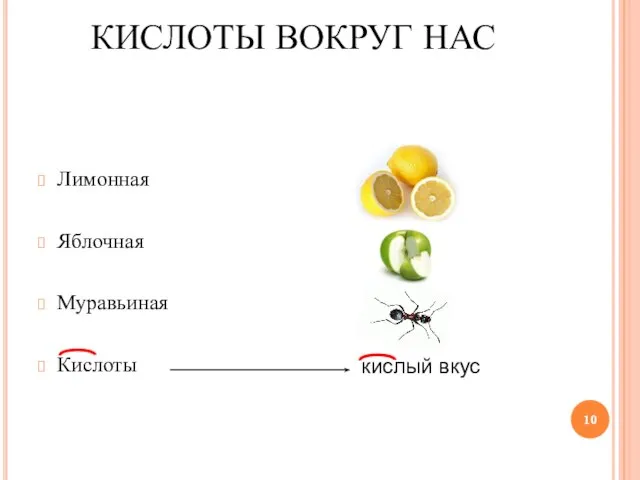
Слайд 10Лимонная
Яблочная
Муравьиная
Кислоты
кислый вкус
КИСЛОТЫ ВОКРУГ НАС
Слайд 11ИНДИКАТОРЫ
Индикаторы – это вещества, которые изменяют свою окраску в растворах щелочей и

кислот
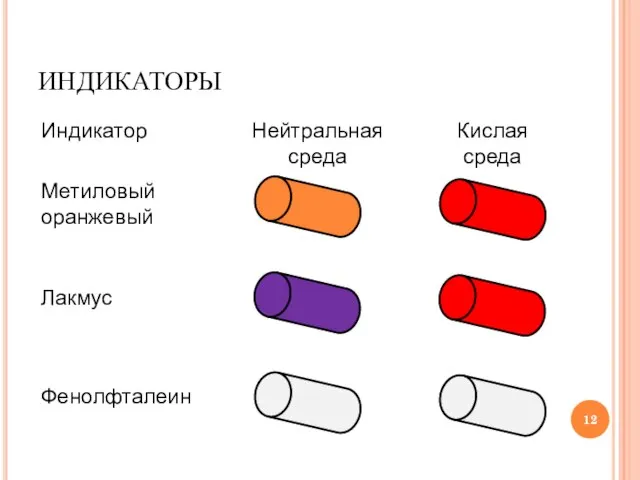
Слайд 12ИНДИКАТОРЫ
Индикатор
Метиловый оранжевый
Нейтральная среда
Кислая среда
Лакмус
Фенолфталеин
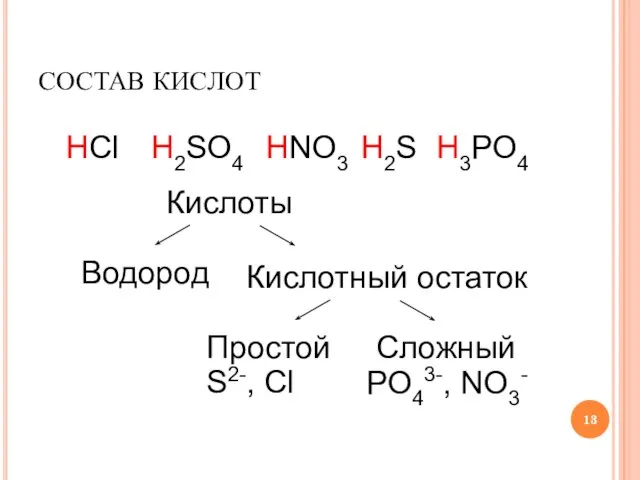
Слайд 13СОСТАВ КИСЛОТ
HCl
H2SO4
HNO3
H2S
H3PO4
Кислоты
Водород
Кислотный остаток
Простой
Сложный
S2-, Cl
PO43-, NO3-
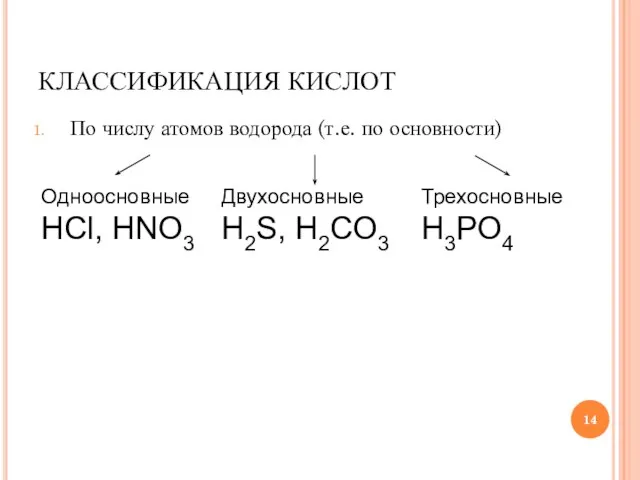
Слайд 14КЛАССИФИКАЦИЯ КИСЛОТ
По числу атомов водорода (т.е. по основности)
Одноосновные
HCl, HNO3
Двухосновные
H2S, H2CO3
Трехосновные
H3PO4
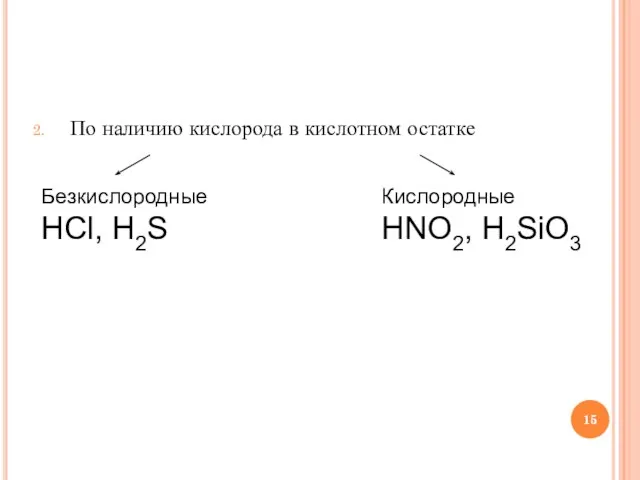
Слайд 15По наличию кислорода в кислотном остатке
Безкислородные
HCl, H2S
Кислородные
HNO2, H2SiO3
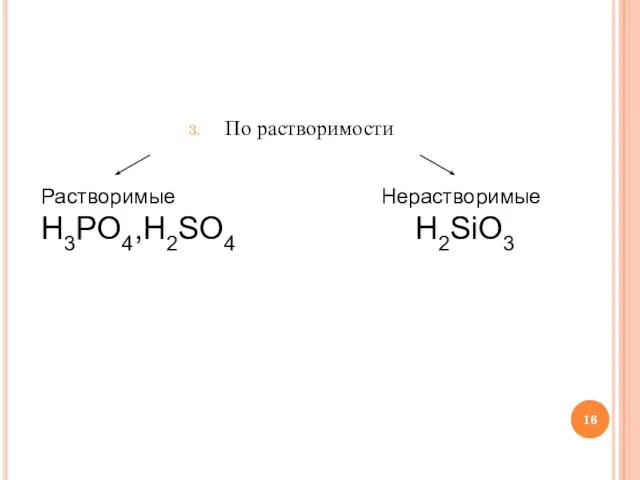
Слайд 16По растворимости
Растворимые
H3PO4,H2SO4
Нерастворимые
H2SiO3
Слайд 17ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОТ
Жидкие: HCl – соляная, H2SO4 – серная.
Твердые: стеариновая, борная
H2CO3 –

угольная кислота
H2SO3 – сернистая кислота
H2CO3 H2O + CO2
H2SO3 H2O + SO2
Слайд 18ОПРЕДЕЛЕНИЕ СТЕПЕНЕЙ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ И ЗАРЯДОВ ИОНОВ КИСЛОТ
Водород в кислотах всегда заряжен

+1.
Численное значение заряда кислотного остатка всегда равно числу атомов водорода в молекуле, т. е. основности данной кислоты.
Примеры:
HNO3 HCl
H2S, Н2СО3
Слайд 19ВАЖНЕЙШИЕ КИСЛОТЫ
Молочная кислота – скисание молока
Щавелевая – в листьях щавеля
Серная H2SO4 Получают
Соляная

HCl искусственным
Азотная HNO3 путем
Наиболее часто используют серную кислоту H2SO4
Слайд 20ПРАВИЛА РАЗБАВЛЕНИЯ КИСЛОТ
Кислоту в воду!!!

Слайд 21ЗАКРЕПЛЕНИЕ
Лабораторный опыт «Определение раствора кислоты с помощью индикатора»




















 Предложение по перспективному развитию военного городка отдельного медико-санитарного батальона г. Балашиха
Предложение по перспективному развитию военного городка отдельного медико-санитарного батальона г. Балашиха Язык современной Интернет - субкультуры
Язык современной Интернет - субкультуры Отцовская доблесть. Семья Канчуриных
Отцовская доблесть. Семья Канчуриных Кто хочет стать миллионером (разовая игра 15 вопросов)
Кто хочет стать миллионером (разовая игра 15 вопросов) Публичный отчет МОУ СОШ №18 г. Пензы (декабрь 2009 г.)
Публичный отчет МОУ СОШ №18 г. Пензы (декабрь 2009 г.) Презентация на тему Декартовы координаты
Презентация на тему Декартовы координаты  Кулинарные традиции семьи
Кулинарные традиции семьи Аксонометрия. Прямоугольные и косоугольные аксонометрические проекции
Аксонометрия. Прямоугольные и косоугольные аксонометрические проекции Технические средства измерения массы груза
Технические средства измерения массы груза Мой любимый продукт
Мой любимый продукт Гамма-стерилизация
Гамма-стерилизация Химическое оружие. Виды
Химическое оружие. Виды ОРГАНИЗАЦИЯ ПРОЦЕССА ОБУЧЕНИЯ В ПОЛЬШЕ
ОРГАНИЗАЦИЯ ПРОЦЕССА ОБУЧЕНИЯ В ПОЛЬШЕ Служба в органах уголовно-исполнительной системы как вид государственной службы
Служба в органах уголовно-исполнительной системы как вид государственной службы Путевая бюрократия или все о вагонной документации
Путевая бюрократия или все о вагонной документации Ecological problems
Ecological problems Продам 2 комнатную квартиру по приятной цене
Продам 2 комнатную квартиру по приятной цене Возрастная психология
Возрастная психология Правила vs Нормы
Правила vs Нормы Психолог-юзабилист О новой профессии в мире высоких технологий (для студентов-психологов)
Психолог-юзабилист О новой профессии в мире высоких технологий (для студентов-психологов) Управления рисками в банке
Управления рисками в банке Презентация на тему Мировые религии
Презентация на тему Мировые религии Ядерная сделка с Ираном
Ядерная сделка с Ираном Lean Startup «Бережливый стартап» Как делать игры, нужные людям
Lean Startup «Бережливый стартап» Как делать игры, нужные людям Презентация на тему Первые летательные аппараты
Презентация на тему Первые летательные аппараты Документирование среды программирования для операционной системы L4Ka(Documenting the programmer environment for L4ka)
Документирование среды программирования для операционной системы L4Ka(Documenting the programmer environment for L4ka) Правописание частицы НЕ с глаголами
Правописание частицы НЕ с глаголами Пьеса для театра А.Н.Островского "Снегурочка"
Пьеса для театра А.Н.Островского "Снегурочка"