Содержание
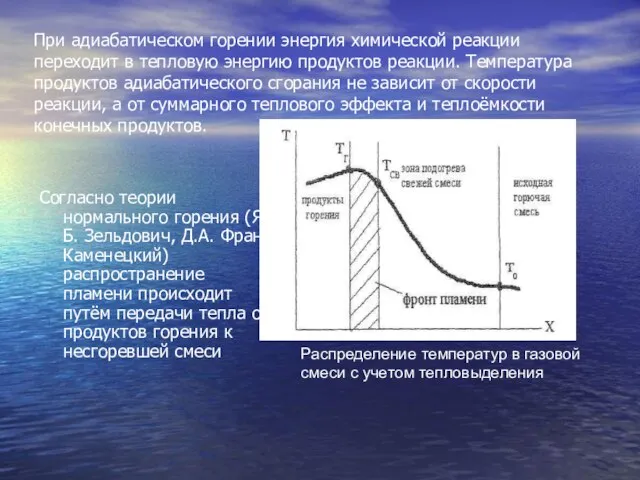
- 2. При адиабатическом горении энергия химической реакции переходит в тепловую энергию продуктов реакции. Температура продуктов адиабатического сгорания
- 3. Химическая реакция сосредоточена в узкой зоне и уравнение теплопроводности в зоне подогрева выглядит: с·ρ·dT/dt=η·d2T/dx2 μ=η/(с·ρ) Скорость
- 4. Важной характеристикой является зона прогрева и толщина прогрева: если зона прогрева и зона химической, то U·x/μ=1;
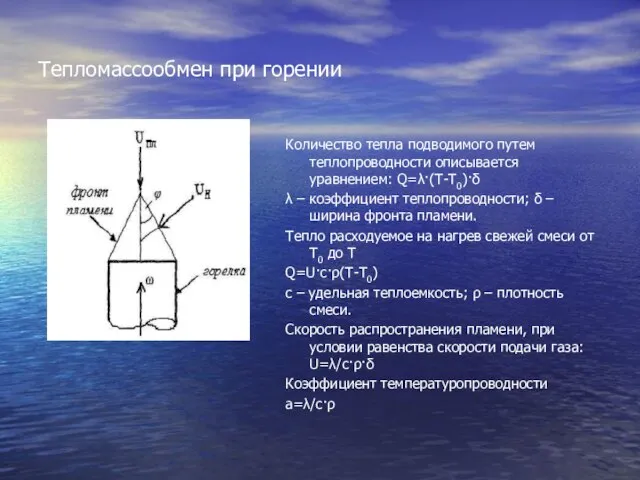
- 5. Тепломассообмен при горении Количество тепла подводимого путем теплопроводности описывается уравнением: Q=λ·(T-T0)·δ λ – коэффициент теплопроводности; δ
- 6. Согласно кинетической теории газов время химической реакции: t=λ·γ/c где λ – длина свободного пробега молекулы; с
- 7. Уравнение теплового баланса: сР·ρ·dT/dt=U·cP·ρ·dT/dt+η·d2T/dx2+F где сР·ρ·dT/dt – изменение температуры в какой-то точке в единице объёма; U·cP·ρ·dT/dt
- 8. Тогда упрощенный вид уравнения теплового баланса будет выглядеть: η·d2T/dx2+F=0 Вводим дополнительные переменные: φ=d2T/dx2 dx=dT/φ d2T/dx2=φ·dφ Тогда
- 10. Скачать презентацию





 Презентация по английскому языку на тему _Школьные предметы_ (5 класс)
Презентация по английскому языку на тему _Школьные предметы_ (5 класс) NETWORKING в стиле Бутерброд. Команда Бизнес-вектор
NETWORKING в стиле Бутерброд. Команда Бизнес-вектор These strange Englishmen
These strange Englishmen Обобщающий урок по теме:
Обобщающий урок по теме: Интернет Маркетинг
Интернет Маркетинг Полномочия территориальных органов Роскомнадзора в области персональных данных
Полномочия территориальных органов Роскомнадзора в области персональных данных Отчёт по производственной практике
Отчёт по производственной практике «Оценка жителями города Архангельска эффективности деятельности муниципальной власти»
«Оценка жителями города Архангельска эффективности деятельности муниципальной власти» Надеждинск Кабаковск Серов
Надеждинск Кабаковск Серов Анна Ахматова. « Я научила женщин говорить».
Анна Ахматова. « Я научила женщин говорить». Наружная реклама в Украине Развитие наружной рекламы Украины 01.01.06-26.08.06 в категории медицина 2006.
Наружная реклама в Украине Развитие наружной рекламы Украины 01.01.06-26.08.06 в категории медицина 2006. ЕДИНСТВЕННЫЙ ПОСТАВЩИК
ЕДИНСТВЕННЫЙ ПОСТАВЩИК Объекты и их имена
Объекты и их имена Анализ работы школы
Анализ работы школы Презентация на тему Герои Великой Отечественной войны Лётчики-герои
Презентация на тему Герои Великой Отечественной войны Лётчики-герои  Иллюстрация. 2 урок. 8 д
Иллюстрация. 2 урок. 8 д Изображение женского портрета с элементами декорирования
Изображение женского портрета с элементами декорирования Обучение в сотрудничестве
Обучение в сотрудничестве Лёгкая атлетика. Метание. Урок 4
Лёгкая атлетика. Метание. Урок 4 Лёгкая атлетика. Прыжки в длину
Лёгкая атлетика. Прыжки в длину Самая живая часть речи
Самая живая часть речи Новое в законодательстве
Новое в законодательстве м е д п ч е л и н ы й
м е д п ч е л и н ы й Описание технологического процесса выполнения прически объемный пучок
Описание технологического процесса выполнения прически объемный пучок Проверка статистических гипотез
Проверка статистических гипотез Русские народные обычаи и обряды. (Часть 3)
Русские народные обычаи и обряды. (Часть 3) Презентация на тему Озера России
Презентация на тему Озера России Использование цифрового оборудования на уроках биологии
Использование цифрового оборудования на уроках биологии