Слайд 21. Поняття про титрування
2. Індикатори
3. Правила титрування
4. Види титрування
5. Встановлення титру робочих

розчинів (стандартизація)
Слайд 3 1. Поняття про титрування
Кількісний хімічний аналіз поділяють на титриметричний і гравіметричний.

Їх називають класичними методами аналізу.
Під загальною назвою " титриметричний аналіз" об'єднують кількісні визначення, що здійснюються титруванням.
Слайд 4Титрування полягає в поступовому додаванні до певної порції розчину аналізованої речовини або

її наважки порцій розчину реагенту з точно відомою концентрацією до повного проходження хімічної реакції між реагентом і визначуваною речовиною.
Слайд 5Цю реакцію називають реакцією титрування, а момент її закінчення реєструють за зміною

забарвлення спеціальних хімічних хромофорних речовин - індикаторів .
Слайд 6Момент закінчення титрування називають кінцевою точкою титрування (КТТ) або моментом (точкою) еквівалентності

(МЕ, ТЕ), якщо він точно відповідає моменту хімічної еквівалентності визначуваної речовини та речовини реагенту.
Слайд 7Розчин реагенту з точно відомою концентрацією, вираженої , у вигляді титру, називають

титрантом, або робочим розчином.
Вміст визначуваної речовини в титриметрії розраховують за законом еквівалентів (рівняння зв'язку), використовуючи інтенсивність аналітичного сигналу вимірювань об'єму титранту, що пішов на титрування.
Слайд 8Конкретне титрування в титриметрії прийнято зображати схемою у вигляді вертикальної стрілки (бюретки),

справа вгорі від якої вказують хімічну формулу і концентрацію титранту, всередині - індикатор, а внизу -визначувану речовину, наприклад :
Слайд 10 виведенням середньоарифметичного (розбіжність не більше 0,1 - 0,2 см3) результату повторних

(паралельних) титруваннь.
Слайд 11Титриметричні методи аналізу розділяють за типом хімічних реакцій
1. Методи кислотно-основного титрування які ґрунтуються

на використанні реакції нейтралізації. Їх застосовують для визначення кислот, основ та солей, які внаслідок гідролізу утворюють кислу або лужну реакцію середовища.
Слайд 122. Методи осаджувального титрування у яких досліджувана речовина при взаємодії з титрантом виділяється

з розчину у вигляді малорозчинної сполуки.
3. Методи комплексонометричного титрування грунтуються на утворенні комплексів титранту з досліджуваною речовиною.
4. Методи окисно-відновного титрування (оксред-методи) побудовані на окисно-відновних реакціях, що відбуваються між
певною речовиною і титрантом.
Слайд 13 2. Індикатори
ІНДИКАТОРИ - речовини, що дозволяють слідкувати за складом середовища або

за перебігом хімічної реакції.
Одними з найпоширеніших є кислотно-основні, які змінюють колір в залежності від кислотності розчину. Відбувається це тому, що в кислому і лужному середовищі молекули індикатора мають різну будову.
Слайд 14Кислотно-основні індикатори у більшості випадків являють собою розчинні складні органічні сполуки, що

мають здатність змінювати своє забарвлення в залежності від рН розчину. За хімічною будовою вони є слабкими кислотами або основами, що частково дисоціюють в розчині за рівнянням:
Слайд 16При виборі індикатора керуються наступними правилами:
первагу потрібно надавати індикаторам, ділянка переходу яких

найближча до рН в точці еквівалентності;
величина переходу забарвлення індикатора повинна повністю або частково входить в скачок титрування;
при титруванні слабких кислот не можна застосовувати індикатори з інтервалом переходу, що лежить в кислотній ділянці, а при титруванні слабких основ - в лужній.
Слайд 17Практично ніколи не вдається підібрати індикатор, у якого ділянка переходу співпадала би

з рН в точці еквівалентності, тому найчастіше зміна забарвлення відбувається до або після точки еквівалентності.
Слайд 18При титруванні необхідно встановити кількість робочого розчину, еквівалентну кількості визначуваної речовини.
Для

цієї мети до досліджуваного розчину доливають поступово титрант до тих пір, поки не буде досягнуто еквівалентної точки. Цей момент називається точкою еквівалентності.
Ознакою досягнення точки еквівалентності служить набуття розчином певного значення рН.
Слайд 19Тому як індикатор методу нейтралізації служать речовини, забарвлення яких змінюється залежно від

зміни величини рН.
До них відносяться лакмус, метиловий оранжевий, фенолфталеїн і багато інших речовини.
Забарвлення кожного з них змінюється всередині певного вузького інтервалу значень рН, причому цей інтервал залежить тільки від властивостей даного індикатора і абсолютно не залежить від природи реагуючих між собою кислоти і основи.
Слайд 20Момент титрування, коли індикатор змінює своє забарвлення, називається точкою кінця титрування.
Необхідно

вибирати індикатор та умови титрування так, щоб точка кінця титрування збігалася з точкою еквівалентності або була, можливо, ближче до неї.
Слайд 21Індикатори готують у вигляді водних, водно-спиртових або спиртових розчинів. Зміна забарвлення індикатора

залежить від зміни концентрації іонів водню, причому кожний індикатор змінює забарвлення лише в певних інтервалах рН. Кінець титрування визначають або за зміною забарвлення (метиловий оранжевий), або за зникненням чи його появою (фенолфталеїн).
Слайд 223. Правила титрування
Під час титрування колбу треба тримати правою рукою, а лівою

управляти краном бюретки, щоб рідина стікала рівномірно. При титруванні велике значення має швидкість додавання розчину.
Для перемішування титрованого розчину зручно застосовувати магнітні мішалки. Кінець титрування визначають за зміною забарвлення розчину.
Слайд 23 Слід пам'ятати кілька правил титрування.
Титровані розчини повинні бути свіжими. Не дозволяється

їх тривале зберігання.
Титровані розчини при зберіганні змінюють свій титр, тому його слід періодично перевіряти.
Титр розчинів КМп04 потрібно установлювати не раніше, ніж через 3—4 дні після приготування.
Титровані розчини лугів потрібно зберігати в бутлях, покритих всередині парафіном, і захищати від дії двоокису вуглецю.
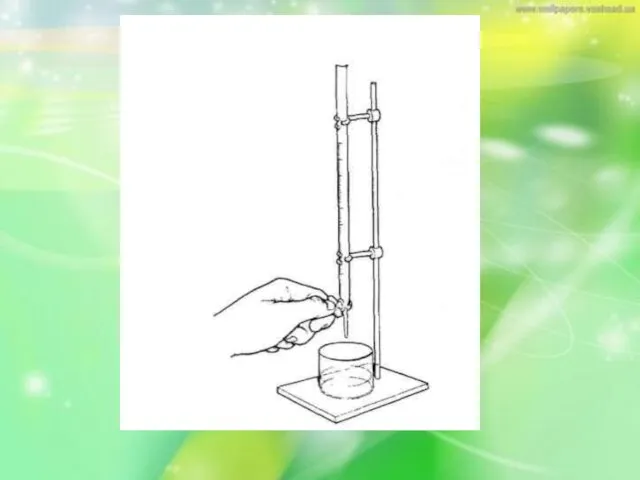
Слайд 24 Порядок виконання титрування . Закріпляють бюретку строго вертикально в лапці штативу.
Наповнюють

її за допомогою лійки вище нульової поділки розчином титранта. Виймають лійку.
Слайд 25Відкривають затвор, дають розчину заповнити кінчик бюретки нижче крана або скляної кульки

і витісняють пухирці повітря. Установлюють рівень розчину на нульовій поділці бюретки (мал.І)зливанням розчину титранта в стакан.
Слайд 27Око спостерігача повинно бути на рівні нульової поділки, тобто в одній горизонтальній

площині з ним. Нижня частина меніска повинна збігатися з нульовою поділкою.
Підставляють конічну колбу або стакан під бюретку, підклавши під неї аркуш білого паперу, щоб була помітною зміна переходу кольору індикатора.
Слайд 28Набирають піпеткою 2 мл розчину досліджуваної речовини, виливають в конічну колбу або

стакан і добавляють до нього 1-2 мл розчину індикатору. Фіксують як змінюється забарвлення індикатора.
Виміряють термометром температуру розчину.
Слайд 29Добавляють до розчину лугу з індикатором одразу 1-1.5 мл кислоти з бюретки.

Після цього продовжують добавляти кислоту краплями, злегка збовтуючи рідину коловими рухами. Тримають колбу за шийку правою рукою і перемішують розчин, обертаючи колбу .
Слайд 30Кран бюретки повинен бути з правого боку; відкривають його лівою рукою і

регулюють ним швидкість витікання розчину.
Добавляють окремими краплями кислоту. Збовтують вміст колби (стакана) після кожної краплі, спостерігаючи за зміною забарвлення.
Слайд 32 4.Види титрування
У титриметріі використовують види титрування:
пряме
зворотнє (за залишком)
непряме (замісникове)
реверсивне

Слайд 33Вимоги до реакцій прямого титрування
Взаємодія титрованої речовини із реагентом в умовах проведення

аналізу повинна бути специфічною.
Реакція повинна протікати стехіометрично, тобто відповідно до певного рівняння.
Реакція повинна проходити швидко, тобто стан рівноваги після додавання чергової порції титр акта повинен досягатися майже миттєво.
Слайд 34Константа рівноваги повинна бути достатньо високою, реакція повинна
проходити до кінця, щоб похибки,

які виникають від неповного протікання
реакції не перевищили допустимі величини.
Можливість підбору індикатора для фіксації .
Слайд 35 Зворотнє титрування застосовують тоді, коли:
мала швидкість прямої реакції
відсутній відповідний індикатор
можлива втрата

визначуваної речовини, внаслідок її леткості (летючості)
Слайд 36 Непряме титрування застосовуюють тоді, коли:
визначувана речовина із використовуваним титрантом не взаємодіє
взаємодія

титранту і визначуваної речовини проходить не стехіометрично
взаємодія визначуваної речовини і титранту приводить до утворення суміші декількох продуктів, кількісне співвідношення яких не є постійним
Слайд 37 Реверсивне титрування
При реверсивному титруванні розчином визначуваної речовини титрують стандартний розчин

реагенту.
Слайд 38 5.Встановлення титру робочих розчинів (стандартизація)
Стандартними розчинами називаються розчини з точно відомою

концентрацією.
Існує два способи їх приготування:
1. Беруть на аналітичних вагах точну наважку відповідної речовини,
розчиняють її в мірній колбі і доводять об'єм розчину водою до позначки.
Цим способом можна готувати титранти - розчини тільки тих речовин, які
задовольняють ряду вимог:
Слайд 39Речовина має бути хімічно чистою, тобто не повинна містити сторонніх домішок у

таких кількостях, які можуть вплинути на точність аналізів (не більше 0,05-0,1%).
Склад речовини повинен строго відповідати формулі. Наприклад, кристалогідрати повинні містити рівно стільки води, скільки відповідає їх формулам.
Речовина має бути стійкою при зберіганні і в твердому вигляді, і в розчині, тому що інакше легко порушилася б відповідність складу за формулою.
Слайд 402. Якщо речовина не задовольняє перераховані вище вимоги, то спочатку
готують розчин з

його приблизною молярністю. Паралельно з цим готують
також стандартний розчин якої-небудь відповідно вихідної речовини, як
описано вище. Далі, відтитрувавши один із зазначених розчинів іншим і
знаючи концентрацію розчину вихідної речовини, обчислюють точну
концентрацію розчину даної речовини.
Слайд 41Цим способом готують, наприклад,
стандартні розчини сильних кислот і лугів, речовини яких внаслідок

своєї агресивності не відповідають вимогам, що пред'являються до вихідних
речовин.
Слайд 42Перша стадія полягає в розведенні концентрованого розчину до концентрації близькою до необхідної

в мірній посудині з приблизною точністю вимірювання об'єму (1-10 смЗ).
Друга стадія полягає в приготуванні
спеціального інсталяційного розчину з приготованим титром. На третій стадії
титруванням встановлюють точну концентрацію робочого розчину по
концентрації інсталяцій.
Слайд 43Розчини з приготованим титром називають первинним стандартом, а з встановленим - вторинним.

Слайд 44Інструментами для точного вимірювання об'ємів (до 10-2 см ) розчинів у титриметріі

служать аналітичні піпетки, бюретки і мірні колби різної місткості, а маси - аналітичні ваги (до 10-4-10-5 г).
Для приблизного вимірювання об'ємів - мірні циліндри, мензурки, склянки і колби з поділками (до 10-1-50 см ), а маси - технічні ваги (до 10-2 г).
Слайд 45Повторне титрування проводять двома способами: піпетування і окремих наважок.
При піпетуванні для кожного

повторного титрування аналітичної піпеткою певної місткості відбирають пробу аналізованого розчину. Розрахунок маси визначуваної речовини у всьому об'ємі розчину, взятого на аналіз проводять за формулою з поправочних коефіцієнтів, або просто розведенням).













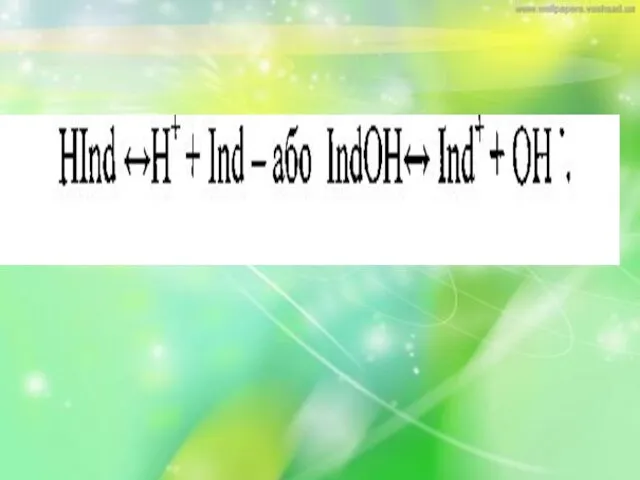





























 Теория вероятности и математическая статистика
Теория вероятности и математическая статистика Единая Россия
Единая Россия Презентация на тему Искусство Древнего Египта Всеобщая история 5 класс
Презентация на тему Искусство Древнего Египта Всеобщая история 5 класс План маркетингового исследования
План маркетингового исследования Команда Британский Парламент
Команда Британский Парламент It инфраструктура предприятия
It инфраструктура предприятия  Принцип действия асинхронного двигателя
Принцип действия асинхронного двигателя  Бионика как отдельная наука
Бионика как отдельная наука Формирование навыков чтения у младших школьников
Формирование навыков чтения у младших школьников TechTalk. Думайте о пользователях, как пользователь, а не как разработчик продукта
TechTalk. Думайте о пользователях, как пользователь, а не как разработчик продукта Схема расположения участка в структуре города
Схема расположения участка в структуре города Торговая марка „Vitrulan“
Торговая марка „Vitrulan“ COFME ПРЕЗЕНТАЦИЯ SACI
COFME ПРЕЗЕНТАЦИЯ SACI "Своя игра" 3-4 класс
"Своя игра" 3-4 класс Проект
Проект Программа Microsoft IT Academy
Программа Microsoft IT Academy Структура программы. Объявление переменных
Структура программы. Объявление переменных ИСПОЛЬЗОВАНИЕ АЛЬТЕРНАТИВНОЙ ЭНЕРГИИ В КЫРГЫЗСОЙ РЕСПУБЛИКЕ ? ПРОБЛЕМЫ И ПЕРСПЕКТИВЫ
ИСПОЛЬЗОВАНИЕ АЛЬТЕРНАТИВНОЙ ЭНЕРГИИ В КЫРГЫЗСОЙ РЕСПУБЛИКЕ ? ПРОБЛЕМЫ И ПЕРСПЕКТИВЫ Ориентирование на местности
Ориентирование на местности ВКР: Разработка технологического процесса изготовления днищевой секции ледокола
ВКР: Разработка технологического процесса изготовления днищевой секции ледокола Презентация на тему Производство чугуна и стали
Презентация на тему Производство чугуна и стали  Основные изменения в Правила приема на 2022 год для поступающих на базе СПО
Основные изменения в Правила приема на 2022 год для поступающих на базе СПО Почетные граждане
Почетные граждане Концерт рок-группы Slot (Россия). Фестиваль Iosis Fest
Концерт рок-группы Slot (Россия). Фестиваль Iosis Fest Оказание первой помощи Октябрь 2011. - презентация
Оказание первой помощи Октябрь 2011. - презентация «АЛКОЗАМОК» - эффективное средство контроля трезвости водителя транспортного средства.
«АЛКОЗАМОК» - эффективное средство контроля трезвости водителя транспортного средства. Святковий концерт до Дня Святого МИколая презентували учні 3-А класу Бершадської ЗОШ №3
Святковий концерт до Дня Святого МИколая презентували учні 3-А класу Бершадської ЗОШ №3 Презентация на тему Площадь прямоугольника
Презентация на тему Площадь прямоугольника