Содержание
- 2. Оглавление Введение 3 слайд Основная часть 4-9 слайд Вывод 10 слайд Список используемой литературы 11 слайд
- 3. Введение Цель: Исследовать и изучить свойства истинных растворов. Для достижения поставленной цели мы выявили следующие задачи:
- 4. Основная часть 1. Раствор – гомогенная (однородная) система, состоящая из частиц растворенного вещества, растворителя и продуктов
- 6. 2. Движущими силами образования растворов являются энтропийный и энтальпийный факторы. При растворении газов в жидкости энтропия
- 7. 3. Истинные растворы бывают ионно-дисперсными и молекулярно-дисперсными. Размер частиц в первых составляет менее 1 нм, а
- 8. 4. Рассмотрим размеры истинных веществ на примере хлорида натрия. Кристаллы любого вещества, например хлорид натрия, можно
- 9. 5. Истинными называются растворы, в которых растворенное вещество находится в ионной форме. Причиной разложения в воде
- 10. Вывод ✵Проведя исследования, я пришла к следующим выводам: 1. Растворы называют истинными, когда вещество находится в
- 12. Скачать презентацию
Слайд 2Оглавление
Введение 3 слайд
Основная часть 4-9 слайд
Вывод 10 слайд
Список используемой литературы 11
Оглавление
Введение 3 слайд
Основная часть 4-9 слайд
Вывод 10 слайд
Список используемой литературы 11

слайд
Слайд 3Введение
Цель: Исследовать и изучить свойства истинных растворов.
Для достижения поставленной цели мы
Введение
Цель: Исследовать и изучить свойства истинных растворов.
Для достижения поставленной цели мы

выявили следующие задачи:
Выяснить какие растворы называются истинными;
❷Определить движущие силы образования растворов;
❸Выяснить особенность истинных растворов;
❹Определить размеры истинных растворов на примере хлорида натрия;
❺Определить принцип разложения истинных растворов.
Выяснить какие растворы называются истинными;
❷Определить движущие силы образования растворов;
❸Выяснить особенность истинных растворов;
❹Определить размеры истинных растворов на примере хлорида натрия;
❺Определить принцип разложения истинных растворов.
Слайд 4Основная часть
1. Раствор – гомогенная (однородная) система, состоящая из частиц растворенного
Основная часть
1. Раствор – гомогенная (однородная) система, состоящая из частиц растворенного

вещества, растворителя и продуктов их взаимодействия.
Растворы все однофазны, то есть представляют собой однородный газ, жидкость или твердое вещество. Это связано с тем, что одно из веществ распределено в массе другого в виде молекул, атомов и ионов.
Когда вещество находится в окружающей среде в виде молекул или ионов, то такие растворы называют истинными, т.е. гомогенными однофазными растворами. В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
Растворы все однофазны, то есть представляют собой однородный газ, жидкость или твердое вещество. Это связано с тем, что одно из веществ распределено в массе другого в виде молекул, атомов и ионов.
Когда вещество находится в окружающей среде в виде молекул или ионов, то такие растворы называют истинными, т.е. гомогенными однофазными растворами. В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
Слайд 62. Движущими силами образования растворов являются энтропийный и энтальпийный факторы. При растворении
2. Движущими силами образования растворов являются энтропийный и энтальпийный факторы. При растворении

газов в жидкости энтропия всегда уменьшается ΔS < 0, а при растворении кристаллов возрастает (ΔS > 0). Чем сильнее взаимодействие растворенного вещества и растворителя, тем больше роль энтальпийного фактора в образовании растворов. Знак изменения энтальпии растворения определяется знаком суммы всех тепловых эффектов процессов, сопровождающих растворение, из которых основной вклад вносят разрушение кристаллической решетки на свободные ионы (ΔH > 0) и взаимодействие образовавшихся ионов с молекулами растворителя (сольтивация, ΔH < 0). При этом независимо от знака энтальпии при растворении (абсолютно нерастворимых веществ нет) всегда ΔG = ΔH – T·ΔS < 0, т. к. переход вещества в раствор сопровождается значительным возрастанием энтропии вследствие стремления системы к разупорядочиванию. Для жидких растворов (расплавов) процесс растворения идет самопроизвольно (ΔG < 0) до установления динамического равновесия между раствором и твердой фазой.
Слайд 7
3. Истинные растворы бывают ионно-дисперсными и молекулярно-дисперсными. Размер частиц в
3. Истинные растворы бывают ионно-дисперсными и молекулярно-дисперсными. Размер частиц в

первых составляет менее 1 нм, а растворенное вещество находится в виде отдельных гидратированных ионов и молекул в равновесных количествах. Истинные растворы всегда прозрачны, они не должны содержать взвешенных частиц и осадка. Особенностью истинных растворов является то, что они гомогенны даже при рассматривании в электронный микроскоп. Компоненты, входящие в их состав, не могут быть разделены никаким способом. Истинные растворы хорошо диффундируют. К этой группе относятся растворы электролитов и неэлектролитов, таких как глюкоза, натрия хлорид, спирт, магния сульфат и т.д.
Слайд 8
4. Рассмотрим размеры истинных веществ на примере хлорида натрия. Кристаллы любого
4. Рассмотрим размеры истинных веществ на примере хлорида натрия. Кристаллы любого
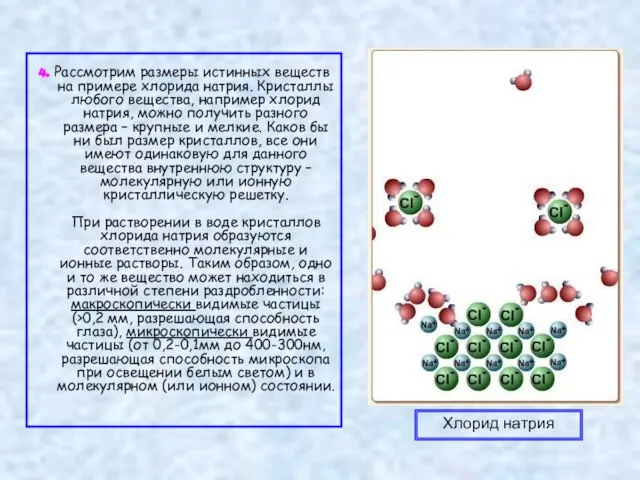
вещества, например хлорид натрия, можно получить разного размера – крупные и мелкие. Каков бы ни был размер кристаллов, все они имеют одинаковую для данного вещества внутреннюю структуру – молекулярную или ионную кристаллическую решетку.
При растворении в воде кристаллов хлорида натрия образуются соответственно молекулярные и ионные растворы. Таким образом, одно и то же вещество может находиться в различной степени раздробленности: макроскопически видимые частицы (>0,2 мм, разрешающая способность глаза), микроскопически видимые частицы (от 0,2-0,1мм до 400-300нм, разрешающая способность микроскопа при освещении белым светом) и в молекулярном (или ионном) состоянии.
Хлорид натрия
Слайд 95. Истинными называются растворы, в которых растворенное вещество находится в ионной форме.
5. Истинными называются растворы, в которых растворенное вещество находится в ионной форме.

Причиной разложения в воде молекул вещества на ионы является электролитическая диссоциация электролитов. Процесс электролитической диссоциации, например, соляной и угольной кислот можно выразить формулами:
НСl —› Н+ + Сl-
Н2СO3 —› Н+ + НСO3-;
НСO3- —› Н+ + СO32-;
В ионном растворе соблюдается принцип электронейтральности, поэтому в нем всегда находится равное число эквивалентов катионов и анионов. Катионы имеют положительный заряд и названы так потому, что при электролизе движутся к катоду. Анионы же имеют отрицательный заряд и при электролизе движутся к аноду.
Слайд 10Вывод
✵Проведя исследования, я пришла к следующим выводам:
1. Растворы называют истинными, когда
Вывод
✵Проведя исследования, я пришла к следующим выводам:
1. Растворы называют истинными, когда

вещество находится в окружающей среде в виде молекул или ионов.
2. Движущими силами образования растворов являются энтропийный и энтальпийный факторы.
3. Особенностью истинных растворов является то, что они гомогенны даже при рассматривании в электронный микроскоп. Компоненты, входящие в их состав, не могут быть разделены никаким способом. Истинные растворы хорошо диффундируют.
4. Одно и то же вещество может находиться в различной степени раздробленности: макроскопически видимые частицы (>0,2 мм, разрешающая способность глаза), микроскопически видимые частицы (от 0,2-0,1мм до 400-300нм, разрешающая способность микроскопа при освещении белым светом) и в молекулярном (или ионном) состоянии.
5. В ионном растворе соблюдается принцип электронейтральности, поэтому в нем всегда находится равное число эквивалентов катионов и анионов.
2. Движущими силами образования растворов являются энтропийный и энтальпийный факторы.
3. Особенностью истинных растворов является то, что они гомогенны даже при рассматривании в электронный микроскоп. Компоненты, входящие в их состав, не могут быть разделены никаким способом. Истинные растворы хорошо диффундируют.
4. Одно и то же вещество может находиться в различной степени раздробленности: макроскопически видимые частицы (>0,2 мм, разрешающая способность глаза), микроскопически видимые частицы (от 0,2-0,1мм до 400-300нм, разрешающая способность микроскопа при освещении белым светом) и в молекулярном (или ионном) состоянии.
5. В ионном растворе соблюдается принцип электронейтральности, поэтому в нем всегда находится равное число эквивалентов катионов и анионов.
 Командный лучный бой
Командный лучный бой ЦЕЛЬ - дать общее представление о государстве Индия.
ЦЕЛЬ - дать общее представление о государстве Индия. Проблемы правового регулирования договора транспортной экспедиции
Проблемы правового регулирования договора транспортной экспедиции Беспроводные решения
Беспроводные решения Клуб внеаренного Лазертага Sector X
Клуб внеаренного Лазертага Sector X Знакомство и особенности деятельности театральных, творческих коллективов и фольклорных студий города Северодвинска
Знакомство и особенности деятельности театральных, творческих коллективов и фольклорных студий города Северодвинска Классификация информации
Классификация информации Истоки русского национальногов характере С.Есенина
Истоки русского национальногов характере С.Есенина The breaking point
The breaking point Сооружения и их оснащение для легкой атлетики
Сооружения и их оснащение для легкой атлетики Локальные нормативные акты по вопросам организации и осуществления образовательной деятельности в организациях дополнительного
Локальные нормативные акты по вопросам организации и осуществления образовательной деятельности в организациях дополнительного Жил-был Ежик
Жил-был Ежик «О МЕРАХ ПО ПОВЫШЕНИЮ ЭФФЕКТИВНОСТИ ЭНЕРГОПОТРЕБЛЕНИЯНА ОСНОВЕ ПРИМЕНЕНИЯ ФУНКЦИОНАЛЬНЫХ НАНОМАТЕРИАЛОВ В ТОПЛИВНО-ЭНЕРГЕТИЧЕ
«О МЕРАХ ПО ПОВЫШЕНИЮ ЭФФЕКТИВНОСТИ ЭНЕРГОПОТРЕБЛЕНИЯНА ОСНОВЕ ПРИМЕНЕНИЯ ФУНКЦИОНАЛЬНЫХ НАНОМАТЕРИАЛОВ В ТОПЛИВНО-ЭНЕРГЕТИЧЕ Сущность и задачи метрологии
Сущность и задачи метрологии Великие битвы Отечественной войны.
Великие битвы Отечественной войны. B&C (БиЭндСи) - лидер европейского рынка промоодежды. Бренд B&C появился в Европе в 2001 году и принадлежит компании The Cotton Group, главный оф
B&C (БиЭндСи) - лидер европейского рынка промоодежды. Бренд B&C появился в Европе в 2001 году и принадлежит компании The Cotton Group, главный оф Презентация на тему Принцип Гюйгенса Принцип Ферма Законы отражения света
Презентация на тему Принцип Гюйгенса Принцип Ферма Законы отражения света  Плоская система произвольно расположенных сил
Плоская система произвольно расположенных сил  prezentatsi_Pekarskaya_Andreev_Volodin
prezentatsi_Pekarskaya_Andreev_Volodin Интеллектуальная одарённость – формы развития и формы мониторинга ( часть II)
Интеллектуальная одарённость – формы развития и формы мониторинга ( часть II) Презентация на тему Система работы учителя по изобразительному искусству и технологии
Презентация на тему Система работы учителя по изобразительному искусству и технологии Лёгкая атлетика
Лёгкая атлетика Эволюция российского избирательного законодательства в аспекте равноправия основных участников выборов
Эволюция российского избирательного законодательства в аспекте равноправия основных участников выборов Особенности проведенияЕГЭв штатном режиме
Особенности проведенияЕГЭв штатном режиме Презентация на тему Профессии моих родителей (2 класс)
Презентация на тему Профессии моих родителей (2 класс) Анализ текста и написание рецензии
Анализ текста и написание рецензии История России
История России Правовой статус личности в Российской Федерации
Правовой статус личности в Российской Федерации