Содержание
- 2. Цели урока Образовательная -- рассмотрение строения атома, аллотропии углерода; формирование представлений о строении, свойствах и применении
- 3. +6С )2)4 +14Si )2)8)4 +32Ge )2)8)18)4 +50Sn )2)8)18)18)4 +82Pb )2)8)18)32)18)4 Общая электронная формула внешнего слоя S2
- 4. Изменение свойств в группе С Si Ge Sn Pb Металлические свойства увеличиваются
- 5. Порядковый номер – 6 Строение атома: протонов – 6, нейтронов – 6, электронов – 6 Энергетических
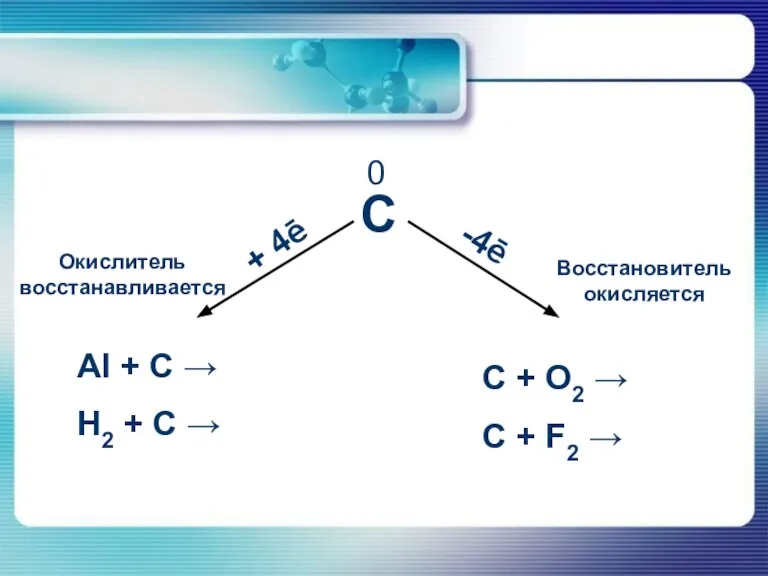
- 6. 0
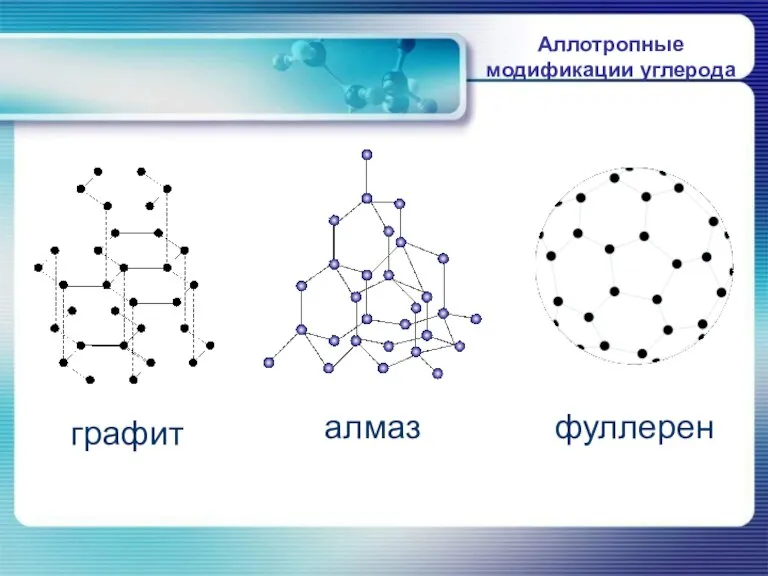
- 7. Аллотропные модификации углерода графит алмаз фуллерен
- 8. А Л М А З
- 10. Звезда ордена Св. Андрея Первозванного Алмаз «Шах» Скипетр императорский
- 11. Большая императорская корона Малая императорская корона
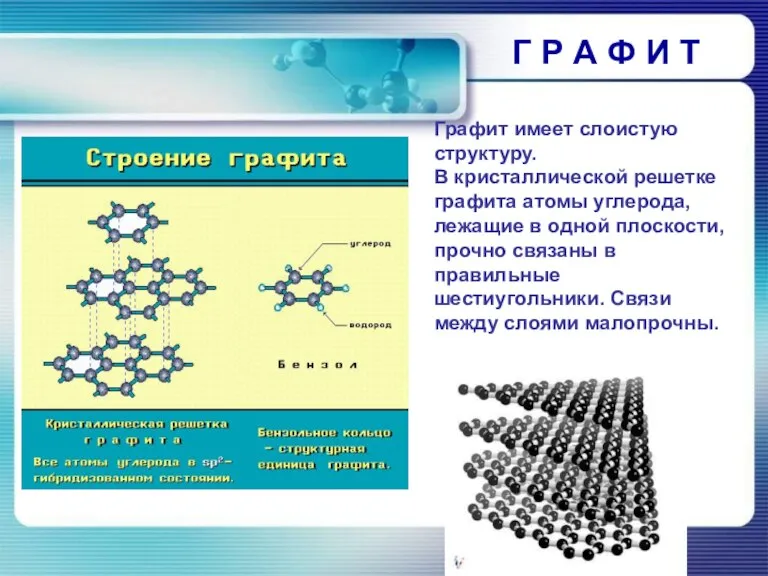
- 12. Г Р А Ф И Т Применение графита: Электроды для электролиза Облицовка сопел ракетных двигателей Смазка
- 13. П О Ч Е М У А Л М А З - очень твердый, Г Р
- 14. А Л М А З Алмаз имеет атомную кристаллическую решетку, в которой каждый атом углерода связан
- 15. Г Р А Ф И Т Графит имеет слоистую структуру. В кристаллической решетке графита атомы углерода,
- 16. Г Р А Ф И Т Сходное с графитом строение имеют: Сажа Древесный уголь Кокс типографская
- 17. Н.Д.Зелинский
- 18. Угольные фильтры В бытовых фильтрах, в промышленном производстве, на очистных сооружениях – уголь поглощает вредные вещества
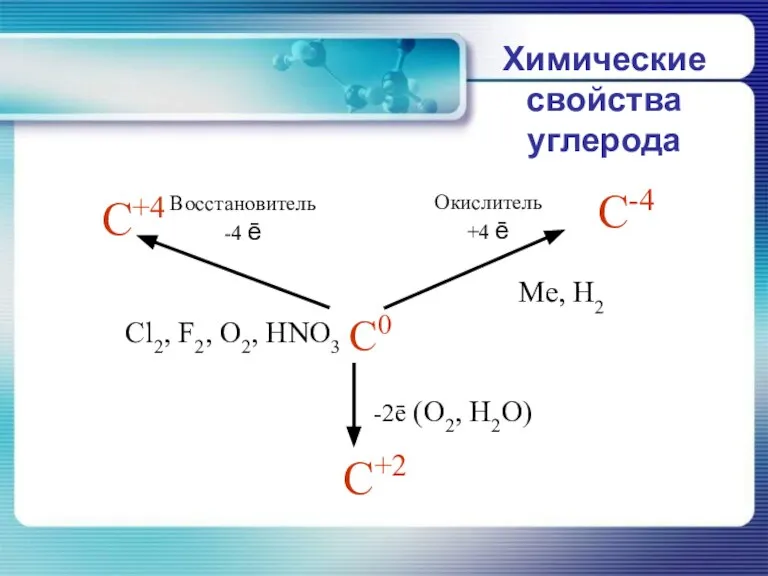
- 19. Химические свойства углерода
- 20. Химические свойства углерода В реакциях с активными неметаллами углерод легко окисляется: C+O2=CO2 2C+O2=2CO C+2S=CS2 C+2F2=CF4 Углерод
- 21. Т е с т 1. Конфигурация внешнего электронного уровня элементов подгруппы углерода: а) ns2np2 б) ns2np3
- 22. ПРОВЕРЬ ПОЛУЧЕННЫЕ ЗНАНИЯ Ответы к тесту 1.а; 2.в; 3.а; 4.б; 5.в; 6.а; 7.в
- 24. Скачать презентацию

















 Общее понятие о личности
Общее понятие о личности Закон О правоохранительной службе
Закон О правоохранительной службе Презентация на тему Кризисы переходного возраста
Презентация на тему Кризисы переходного возраста Выразительные возможности графических материалов. Изобразительное искусство
Выразительные возможности графических материалов. Изобразительное искусство Магический квадрат
Магический квадрат Исследовательская работа по теме «Варианты фразеологических единиц и использование их в речи.
Исследовательская работа по теме «Варианты фразеологических единиц и использование их в речи. Определение каналов сбыта
Определение каналов сбыта Тема 5 ЭБ В РЕАЛЬНОМ СЕКТОРЕ
Тема 5 ЭБ В РЕАЛЬНОМ СЕКТОРЕ Святослав Игоревич
Святослав Игоревич Complete bathroom solutions
Complete bathroom solutions Фотосинтез
Фотосинтез  An Ideal Friend
An Ideal Friend  Lou_Garstner (1)
Lou_Garstner (1) Образовательные курсы по подготовке выпускников
Образовательные курсы по подготовке выпускников Повязка с цветком из атласа
Повязка с цветком из атласа Основы тактики действия сотрудников органов внутренних дел
Основы тактики действия сотрудников органов внутренних дел Презентация на тему КАК СТАТЬ ЛИДЕРОМ
Презентация на тему КАК СТАТЬ ЛИДЕРОМ  Исследование свойства цвета светлота
Исследование свойства цвета светлота В школе...
В школе... Информатика ребус
Информатика ребус Магнитное взаимодействие. Изучение свойств магнита
Магнитное взаимодействие. Изучение свойств магнита Булат Окуджава
Булат Окуджава Самоопределение в пространстве инноваций
Самоопределение в пространстве инноваций © 2008 Promodo www.promodo.ru e-mail:
© 2008 Promodo www.promodo.ru e-mail:  План развития Департамента Хирургия КФ UMC
План развития Департамента Хирургия КФ UMC Основные принципы русской пунктуации
Основные принципы русской пунктуации Правописание приставок А 6 ГИА
Правописание приставок А 6 ГИА Презентация Старт_формат (7) (1)
Презентация Старт_формат (7) (1)