Содержание
- 2. Строение атома
- 3. Порядковый номер – 6 Строение атома: протонов – 6, нейтронов – 6, электронов – 6 Энергетических
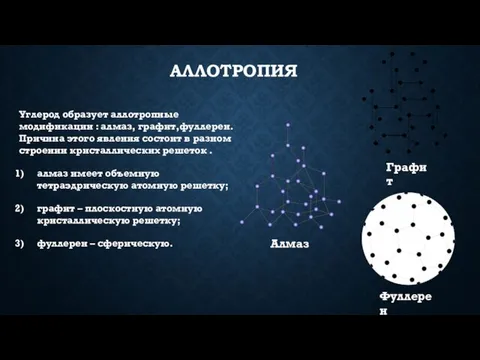
- 4. аллотропия Углерод образует аллотропные модификации : алмаз, графит,фуллерен. Причина этого явления состоит в разном строении кристаллических
- 5. Алмаз Алмаз - прозрачное, бесцветное вещество с сильной лучепреломляемостью. Обладает твердостью, превосходящей твердость всех известных в
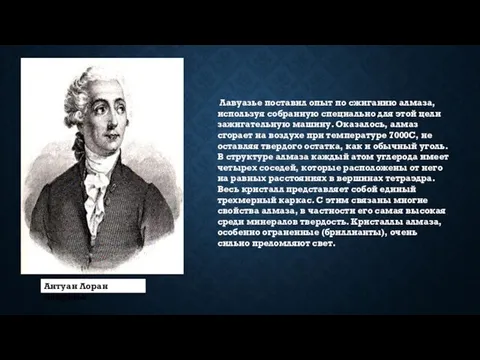
- 6. Лавуазье поставил опыт по сжиганию алмаза, используя собранную специально для этой цели зажигательную машину. Оказалось, алмаз
- 7. Большая императорская корона Звезда ордена Св. Андрея Первозванного
- 8. Графит Графит- вещество серо – стального цвета, мягок, жирен на ощупь. Является хорошим проводником электричества. Имеет
- 9. Графит представляет собой темно-серое с металлическим блеском, мягкое, жирное на ощупь вещество. Хорошо проводит электрический ток.
- 10. Фуллерен Фуллерен Получен в 1985г., имеет сферическую форму (как футбольный мяч), состоит из четного числа атомов
- 11. Усилия многих ученых – физиков, химиков, материаловедов – направлены на развитие нанотехнологии – технологических процессов, осуществляемых
- 12. Химические свойства
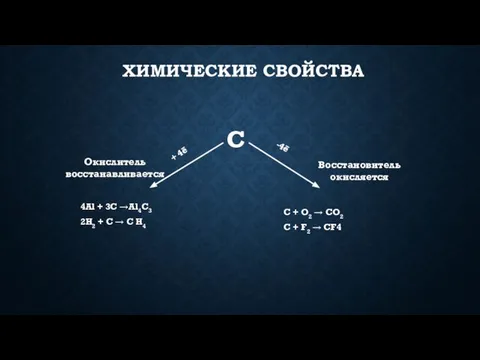
- 13. В нормальных условиях углерод химически малоактивен, однако при высокой температуре он реагирует со многими веществами. Самой
- 14. С водородом углерод соединяется только при высоких температурах и в присутствии катализаторов. В зависимости от температуры
- 15. Углерод – сильный восстановитель. При нагревании с водяным паром он вытесняет из воды водород: Н2O +
- 16. Биологическое значение Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из
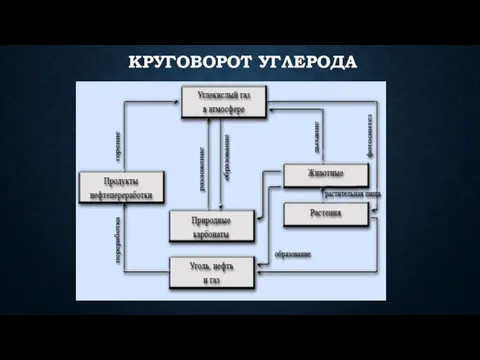
- 17. Круговорот углерода
- 18. Лирическое отступление Углерод. Из элемента углерода (В таблице он шестым стоит) И были созданы природой Алмаз,
- 20. Скачать презентацию













 Lluvia
Lluvia Жужжалочка. Дидактическая игра для автоматизации звука Ж в словах
Жужжалочка. Дидактическая игра для автоматизации звука Ж в словах УД ПСИХОЛОГИЯ
УД ПСИХОЛОГИЯ Храмы России
Храмы России Оптическая микроскопия
Оптическая микроскопия Менеджмент
Менеджмент Кондитерский отдел
Кондитерский отдел Органы и службы стандартизации РФ
Органы и службы стандартизации РФ Вышел зайчик погулять Художник – В. Сергеев
Вышел зайчик погулять Художник – В. Сергеев Знакомство с точкой
Знакомство с точкой Состояние и задачи управления проектами в строительстве
Состояние и задачи управления проектами в строительстве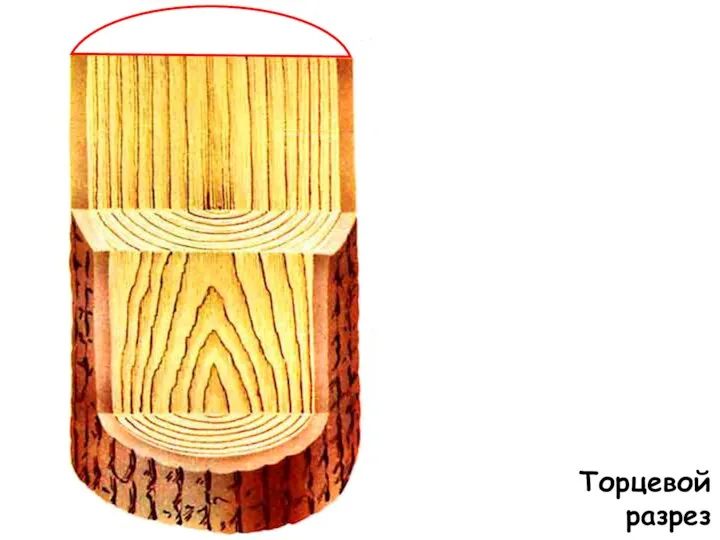 Торцевой разрез. Материаловедение
Торцевой разрез. Материаловедение чайные истории
чайные истории Шпаргалка юного покупателя
Шпаргалка юного покупателя Учебно-методический комплекс "Живая география" Живая география - учебно-методический комплекс, позволяющий использовать геоинфор
Учебно-методический комплекс "Живая география" Живая география - учебно-методический комплекс, позволяющий использовать геоинфор Классификация реакций
Классификация реакций Организация хранения документов Архивного фонда Российской Федерации и других архивных документов
Организация хранения документов Архивного фонда Российской Федерации и других архивных документов Трансляция – биосинтез белка на рибосоме
Трансляция – биосинтез белка на рибосоме Инновационный подход к жизни
Инновационный подход к жизни DaCoPAn Software Engineering Project - Система динамической визуализации событий работы протоколов при обмене данными между двумя сетевыми ЭВМ — D
DaCoPAn Software Engineering Project - Система динамической визуализации событий работы протоколов при обмене данными между двумя сетевыми ЭВМ — D Урок – размышление по рассказу К.Г. Паустовского «Телеграмма»
Урок – размышление по рассказу К.Г. Паустовского «Телеграмма» Путешествие в мир животных
Путешествие в мир животных СПАСИБО, АЗБУКА!
СПАСИБО, АЗБУКА! Rave Cosmology Today Dying, Death & Bardo . RC3.8
Rave Cosmology Today Dying, Death & Bardo . RC3.8 Основные закономерности развития информационного пространства
Основные закономерности развития информационного пространства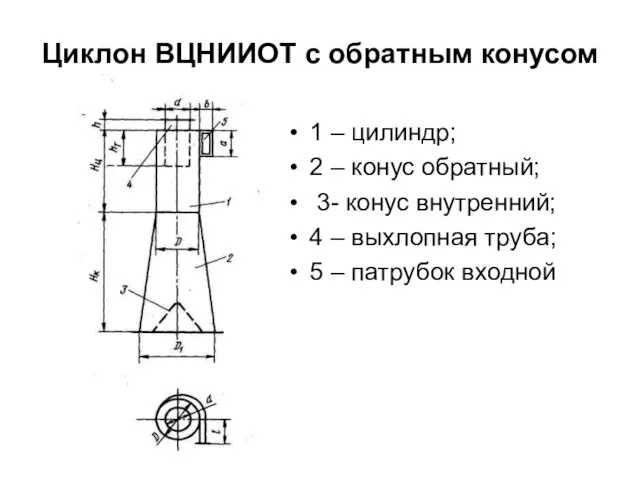 Циклон ВЦНИИОТ с обратным конусом
Циклон ВЦНИИОТ с обратным конусом  Квантовые компьютеры
Квантовые компьютеры Разработать рекламную кампанию в стиле шоу для молодежного интернет-издания Пи-Пермь (бюджет студенческой редакции)
Разработать рекламную кампанию в стиле шоу для молодежного интернет-издания Пи-Пермь (бюджет студенческой редакции)