Содержание
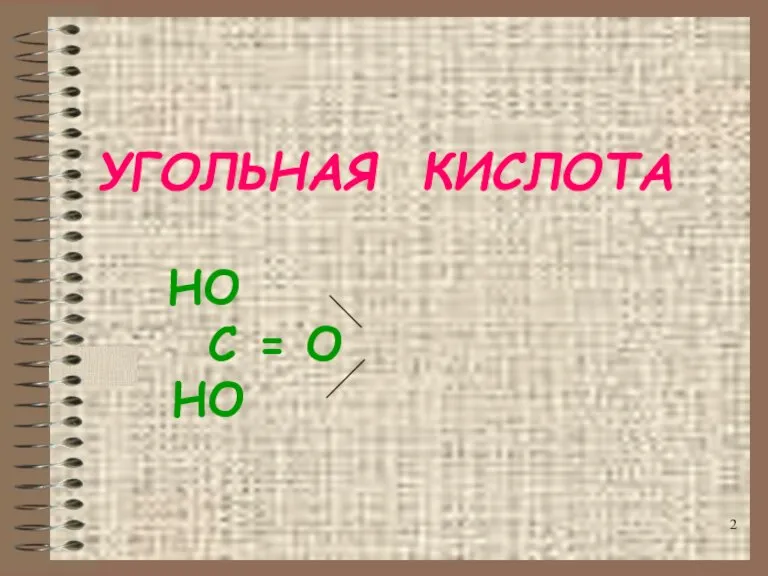
- 2. УГОЛЬНАЯ КИСЛОТА НО C = O НО
- 3. Гидроксимуравьиная (угольная) кислота и её производные
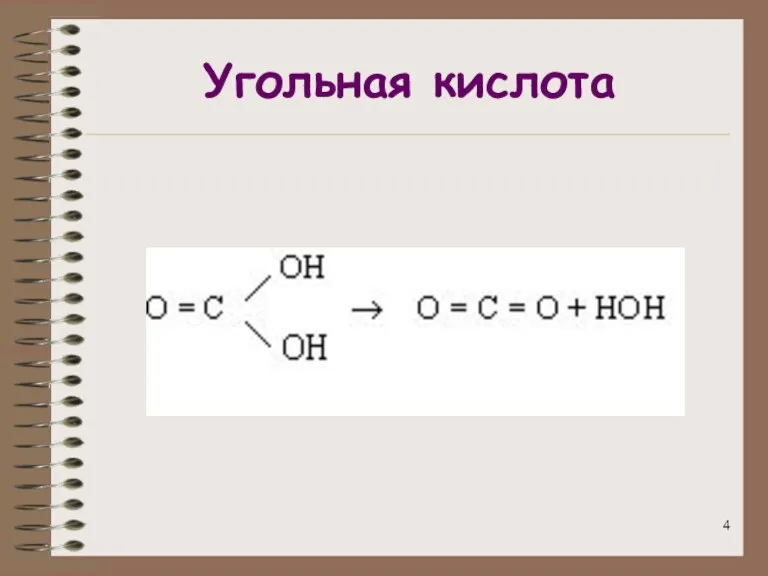
- 4. Угольная кислота
- 5. УГОЛЬНОЙ КИСЛОТЕ СООТВЕТСТВУЮТ: МОНОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ (неустойчивые и легко разлагаются, например HCO2Cl ) ДИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ (устойчивые и
- 6. Многие производные угольной кислоты имеют важное практическое значение Фосген (карбонилхлорид) COCl2 – полный хлорангидрид угольной кислоты,
- 7. Карбаминовая кислота H2N - COOH – неполный амид угольной кислоты. ОН О = С NН2 В
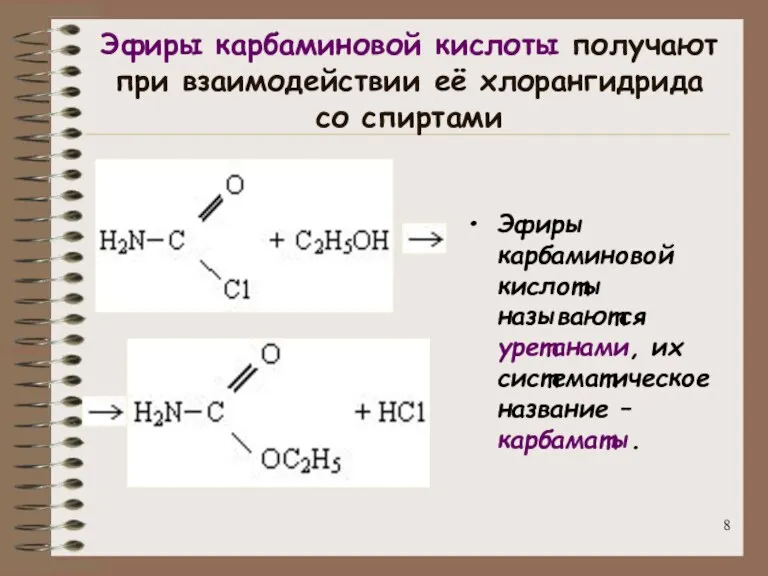
- 8. Эфиры карбаминовой кислоты получают при взаимодействии её хлорангидрида со спиртами Эфиры карбаминовой кислоты называются уретанами, их
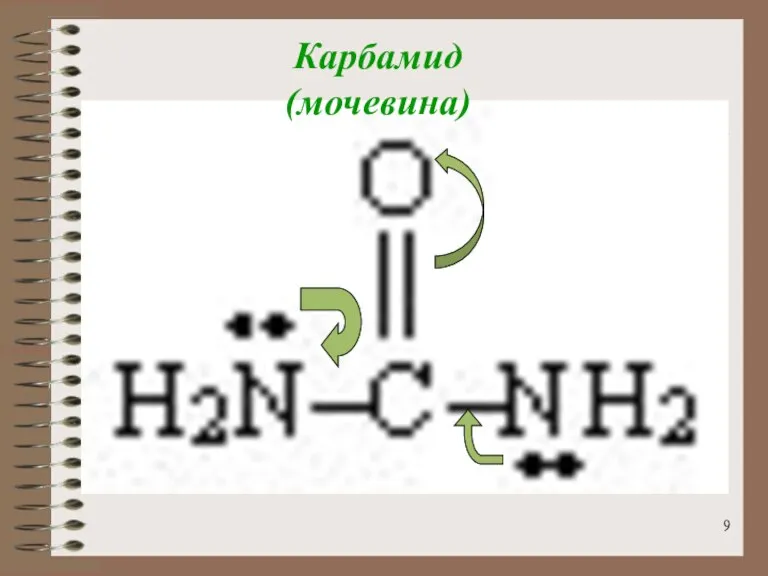
- 9. Карбамид (мочевина)
- 10. КАРБАМИД (МОЧЕВИНА) Представляет собой полный амид угольной кислоты: Н2N C = O Н2N белое кристаллическое вещество,
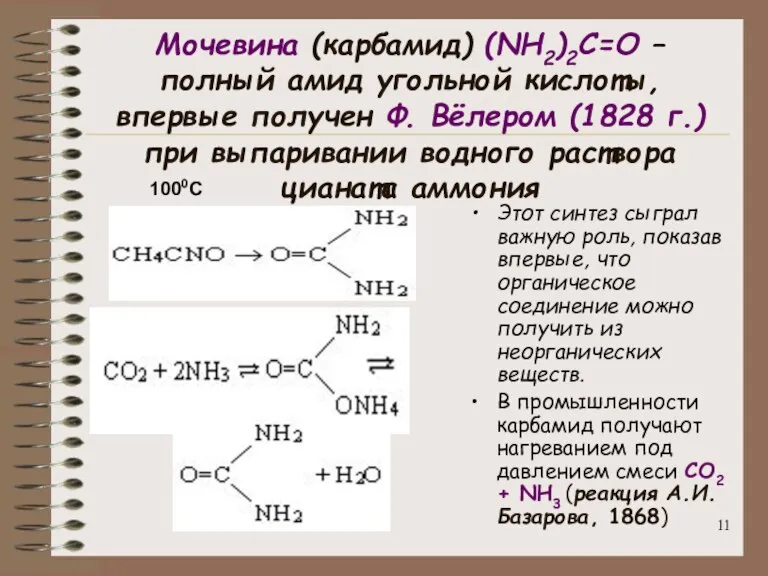
- 11. Мочевина (карбамид) (NH2)2C=O – полный амид угольной кислоты, впервые получен Ф. Вёлером (1828 г.) при выпаривании
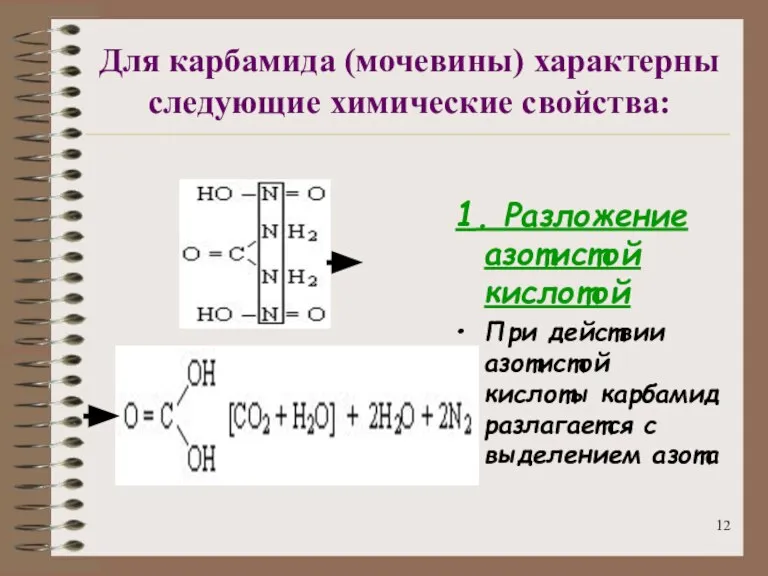
- 12. Для карбамида (мочевины) характерны следующие химические свойства: 1. Разложение азотистой кислотой При действии азотистой кислоты карбамид
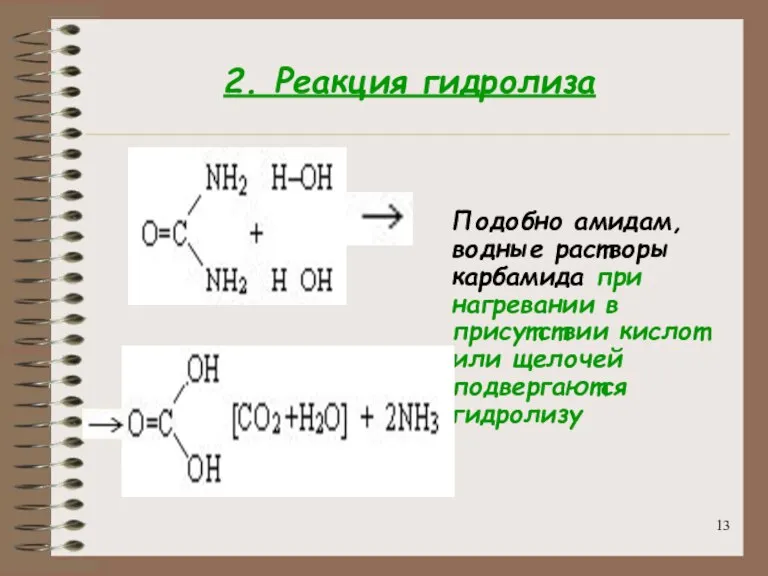
- 13. 2. Реакция гидролиза Подобно амидам, водные растворы карбамида при нагревании в присутствии кислот или щелочей подвергаются
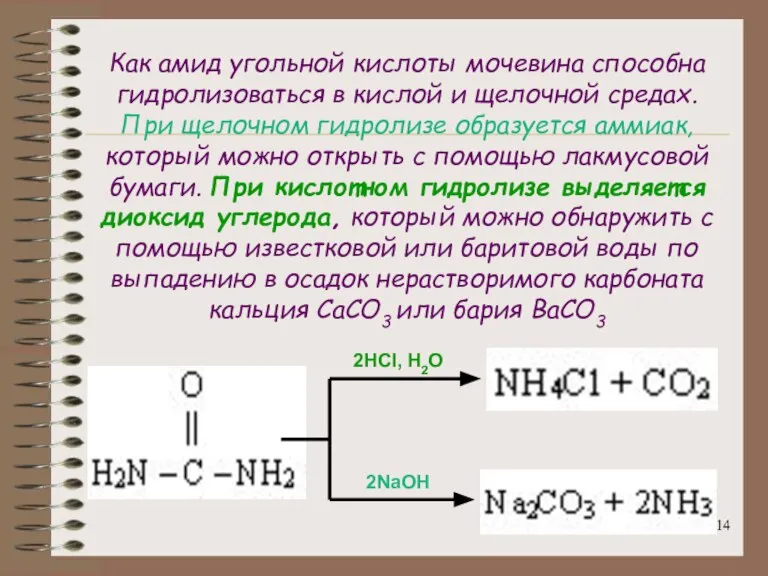
- 14. Как амид угольной кислоты мочевина способна гидролизоваться в кислой и щелочной средах. При щелочном гидролизе образуется
- 15. 3. Разложение при нагревании При нагревании выше температуры плавления карбамид плавится, а затем разлагается с выделением
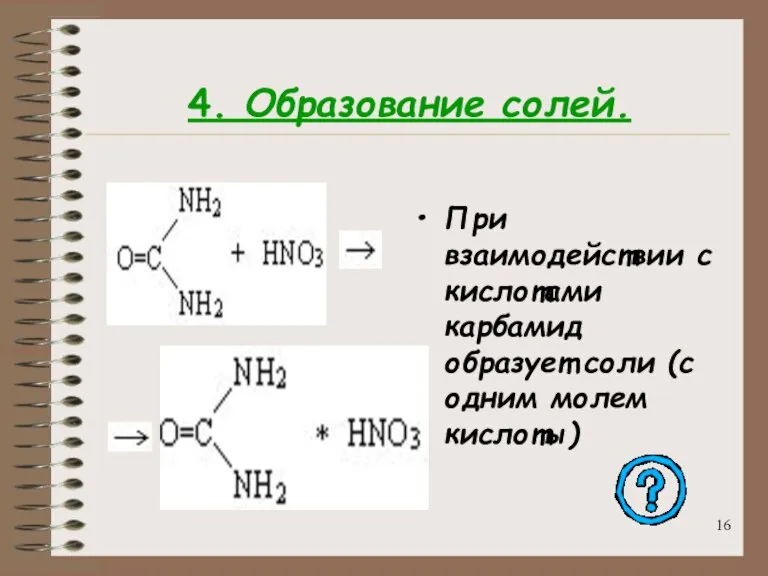
- 16. 4. Образование солей. При взаимодействии с кислотами карбамид образует соли (с одним молем кислоты)
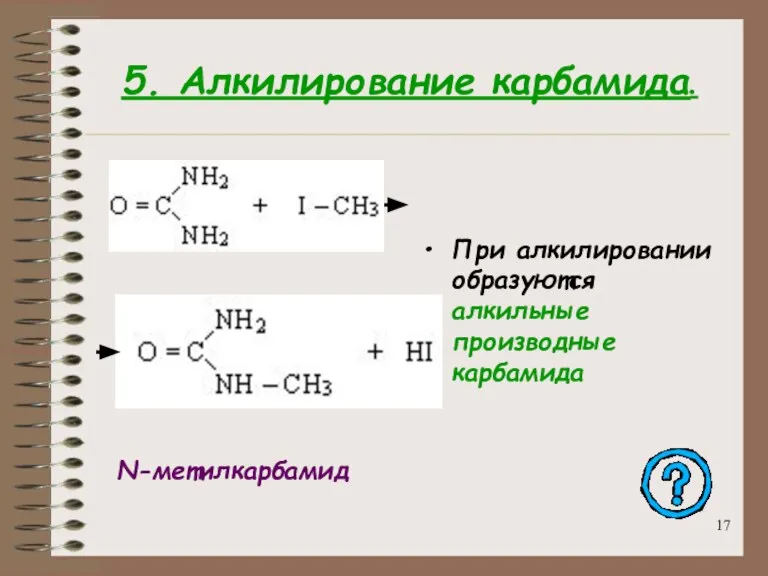
- 17. 5. Алкилирование карбамида. При алкилировании образуются алкильные производные карбамида N-метилкарбамид
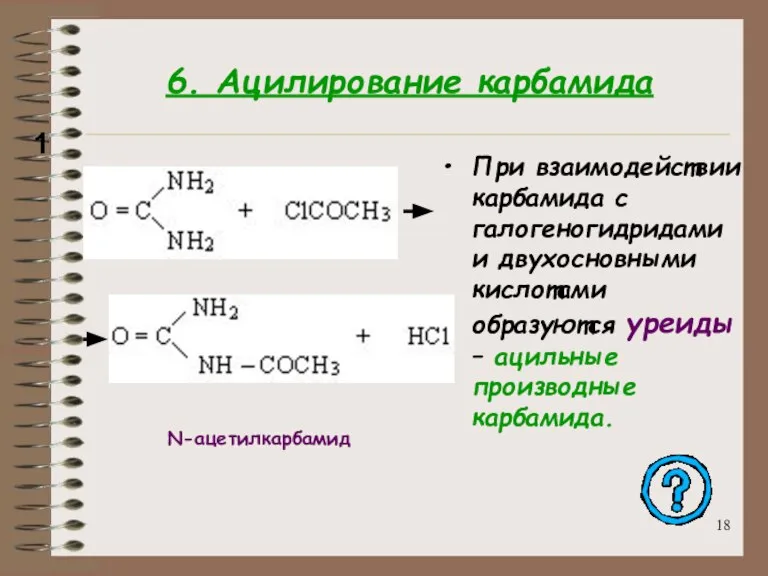
- 18. 6. Ацилирование карбамида При взаимодействии карбамида с галогеногидридами и двухосновными кислотами образуются уреиды – ацильные производные
- 19. 7. Циклизация карбамида При нагревании (350-5000C) и давлении (10-40 МПа) шесьт молекул карбамида образуют циклическое соединение
- 20. * Вычислите массовую долю (%) азота в карбамиде (мочевине). *Почему карбамид может служить ценным азотистым удобрением!
- 21. Решение задачи: 1. Рассчитаем молярную массу карбамида – (NH2)2 CO: М = 2 (14 + 2)
- 22. Задание для самостоятельной проработки темы В каждом тестовом задании выберите только один правильный ответ. Время работы
- 23. «Ключик» для химического хамелеона Правильный ответ Д И М А Й Ы Н Л О П
- 24. «Ключик» для химического хамелеона Д И М А Й Ы Н Л О П Правильный ответ
- 26. Скачать презентацию












 Электрофильное замещение
Электрофильное замещение СОЛНЕЧНАЯ СИСТЕМА
СОЛНЕЧНАЯ СИСТЕМА Архитектура Флоренции
Архитектура Флоренции Оборудование для измельчения и переработки шин
Оборудование для измельчения и переработки шин Гражданский процесс
Гражданский процесс Развитие общества
Развитие общества Женщины в жизни Александра Сергеевича Пушкина
Женщины в жизни Александра Сергеевича Пушкина Информация об организации летнего труда, оздоровления и отдыха детей и молодежи города Калининграда в 2009 году. А.Н. Силанов - п
Информация об организации летнего труда, оздоровления и отдыха детей и молодежи города Калининграда в 2009 году. А.Н. Силанов - п ДАТЧИК ПОЛОЖЕНИЯ КОЛЕНЧАТОГО ВАЛА
ДАТЧИК ПОЛОЖЕНИЯ КОЛЕНЧАТОГО ВАЛА Мы все учились понемногу
Мы все учились понемногу Сепаратизм в современном мире,
Сепаратизм в современном мире, Экскурсионный маршрут “Православные храмы Бежецка”
Экскурсионный маршрут “Православные храмы Бежецка” Организация работы железнодорожных станций. Регламент переговоров ДСП станции, машинистов и составителя поездов при работе
Организация работы железнодорожных станций. Регламент переговоров ДСП станции, машинистов и составителя поездов при работе Биография Бианки
Биография Бианки Определение синуса, косинуса, тангеса острого угла прямоугольного треугольника
Определение синуса, косинуса, тангеса острого угла прямоугольного треугольника Искусство объединяет народы
Искусство объединяет народы КУДА ПОЙТИ УЧИТЬСЯ?
КУДА ПОЙТИ УЧИТЬСЯ? Регламентация IT-процессов
Регламентация IT-процессов Перцептивные процессы в управленческой деятельности
Перцептивные процессы в управленческой деятельности СЛОВАРЬ СЛЕНГА
СЛОВАРЬ СЛЕНГА Конструктивное партнерство. Стелопластик
Конструктивное партнерство. Стелопластик Презентация на тему Общие закономерности реакционной способности органических соединений как химическая основа их биологическо
Презентация на тему Общие закономерности реакционной способности органических соединений как химическая основа их биологическо Презентация_Актион
Презентация_Актион Бизнес-план проекта Велопрокат
Бизнес-план проекта Велопрокат Pointillism
Pointillism Родина Ломоносова
Родина Ломоносова Презентация на тему Бедные
Презентация на тему Бедные  э
э