Слайд 2Цель урока
Ввести понятие изотопы
Тип урока – изучение нового материала

Слайд 3Изотопы
Это разновидности данного химического элемента, различающиеся по массе атомных ядер.
Это разновидности

атомов (и ядерЭто разновидности атомов (и ядер) одного химического элементаЭто разновидности атомов (и ядер) одного химического элемента с разным количеством нейтронов в ядре.
Слайд 4История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут

иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—07 выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий, имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры.
Слайд 5Вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым
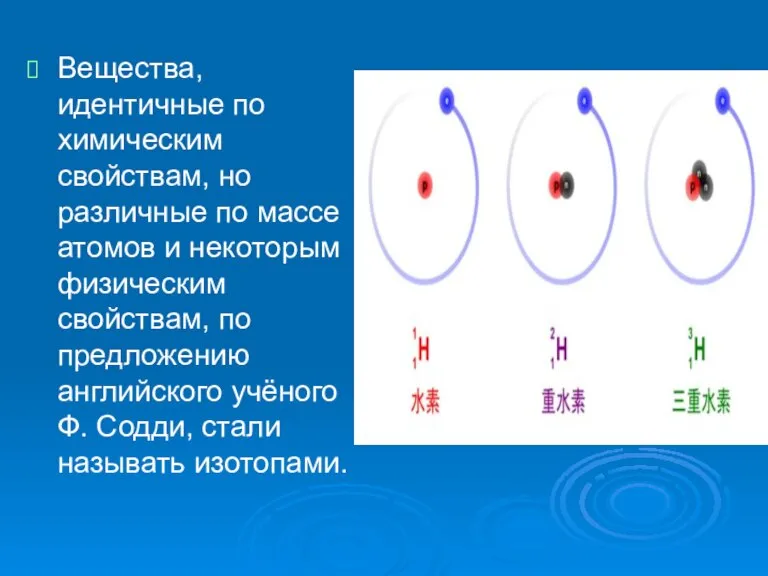
физическим свойствам, по предложению английского учёного Ф. Содди, стали называть изотопами.
Слайд 6Изотопы водорода
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H —

протий, которые имеют индивидуальные названия: 1H — протий (Н), 2Н — дейтерий, которые имеют индивидуальные названия: 1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (T; радиоактивный).
ПротийПротий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,98% и 0,01 %. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода..
Слайд 7Изотопы водорода
3
Н — тритий (T) радиоактивный).
Изотоп водорода 3Н (тритий) нестабилен. Его период

полураспада составляет 12,32 лет. Тритий содержится в природе в очень малых количествах.
Слайд 8изотопы находятся в одном и том же месте (в одной клетке) таблицы

Менделеева.
16 17 18
O, O, O
— три стабильных изотопа кислорода
Все изотопы одного элемента имеют одинаковый заряд ядра ( у кислорода 8), отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число







 Основы Web-дизайна
Основы Web-дизайна 1
1 Weddings in different countries
Weddings in different countries Построение системы внутрикорпоративного обучения
Построение системы внутрикорпоративного обучения Интернет проект по дисциплине: икт в деятельности психолога
Интернет проект по дисциплине: икт в деятельности психолога «В человеке всё должно быть прекрасно: и лицо, и одежда, и душа, и мысли». А.П.Чехов
«В человеке всё должно быть прекрасно: и лицо, и одежда, и душа, и мысли». А.П.Чехов Деловая игра с участиеммолодых специалистов, топ-менеджеров и команды ОПТИМУС.Апрель 2009
Деловая игра с участиеммолодых специалистов, топ-менеджеров и команды ОПТИМУС.Апрель 2009 Принципы познания на основе данных точных наук о мозге
Принципы познания на основе данных точных наук о мозге Конфликт и пути его решения
Конфликт и пути его решения Проект положения об оплате труда торгового представителя отдела по работе с корпоративными клиентами (MD)
Проект положения об оплате труда торгового представителя отдела по работе с корпоративными клиентами (MD) Всероссийский урок Права и свободы человека и гражданина. Всеобщая декларация прав человека
Всероссийский урок Права и свободы человека и гражданина. Всеобщая декларация прав человека Литературный поединок
Литературный поединок Геленджик. Эзотерические экскурсии
Геленджик. Эзотерические экскурсии Там, где спорт – смысл жизни
Там, где спорт – смысл жизни Работа с листами Excel
Работа с листами Excel  Презентация на тему Питер Брейгель Старший
Презентация на тему Питер Брейгель Старший Контроль за выполнением финансовых планов
Контроль за выполнением финансовых планов Сатирические образы человека. Карикатура
Сатирические образы человека. Карикатура Презентация на тему Полисахариды. Крахмал и целлюлоза
Презентация на тему Полисахариды. Крахмал и целлюлоза  Защита портфолио. Жойдик Юлия
Защита портфолио. Жойдик Юлия Анализ документального фильма Титаник
Анализ документального фильма Титаник Вопросы и ответы к кроссворду по теме: Гжель
Вопросы и ответы к кроссворду по теме: Гжель Столовый этикет
Столовый этикет Альтернативные системы управления требованиями
Альтернативные системы управления требованиями Работа УО в 2009 году. Планы на 2010 год
Работа УО в 2009 году. Планы на 2010 год Рубрики. Фотографии
Рубрики. Фотографии Исследовательский проект «Жевательная резинка вредна или полезна»
Исследовательский проект «Жевательная резинка вредна или полезна» " Я выбираю свободу ..."
" Я выбираю свободу ..."