Содержание
- 2. §§ Внутренняя энергия газа 02 В модели идеального газа силами взаимодействия молекул пренебрегают Внутренняя энергия газа
- 3. §§ Работа и теплота 03 Вычислим работу газа при расширении p – давление газа F =
- 4. 04 Процесс обмена внутренними энергиями соприкасающихся тел, который не сопровождается совершением макроскопической работы, называется теплообменом.
- 5. §§ Первое начало 05 Термодинамическая система называется изолированной, если отсутствует всякий обмен энергией между ней и
- 6. 06 Пусть системой α совершена работа A, тогда Рассмотрим контакт систем в адиабатической оболочке. неподвижная теплопроводящая
- 7. идет на приращение ее внутренней энергии ΔU = U2 – U1 07 Получаем математическую формулировку I-го
- 8. §§ Теплоемкость 08 Теплоемкость вещества – физическая величина, равная количеству теплоты, необходимому для нагревания вещества на
- 9. 09 Удельная теплоемкость: Молярная теплоемкость: Из первого начала найдем молярную теплоемкость газа
- 10. 10 1) V = const 2) p = const рассмотрим уравнение М–К:
- 11. 11 Для идеального газа справедливо уравнение Майера Для твердых тел и жидкостей Cp ≈ CV
- 12. §§ Изотермический процесс 12 Это бесконечно медленный процесс, т.к. в системе должно установиться термодинамическое равновесие Закон
- 13. 13 1-е начало термодинамики т.е. вся переданная рабочему телу теплота идет на совершение телом работы Работа
- 14. чтобы не происходил обмен энергией с окружающей средой или он был бы несущественным §§ Адиабатический процесс
- 15. 15 1-е начало термодинамики т.е. работа совершается за счет убыли энергии системы Работа газа при адиабатическом
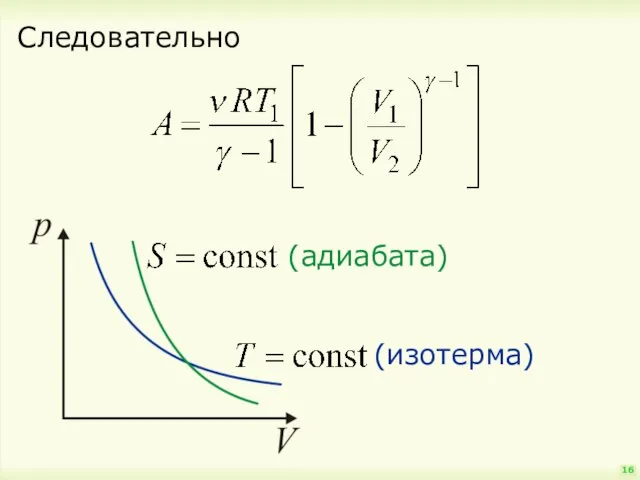
- 16. Следовательно 16
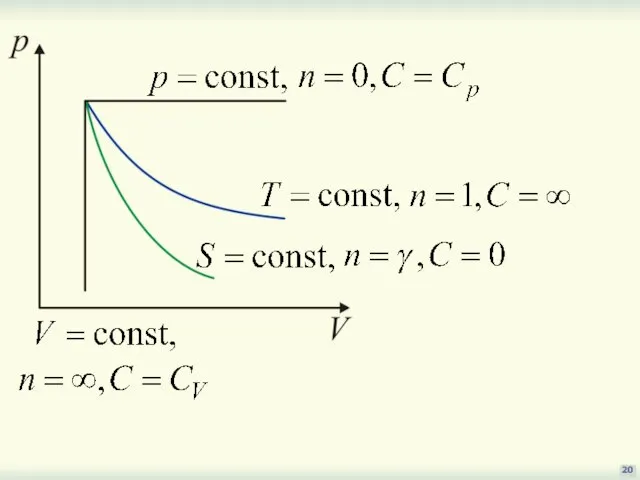
- 17. §§ Политропические процессы 17 Процесс, в котором теплоемкость остается постоянной величиной, называется политропическим (политропным). Рассмотренные процессы
- 18. 18 сделаем замену R = Cp–CV и выразим dT
- 19. 19 Интегрируя, получаем или – уравнение политропы
- 20. 20
- 22. Скачать презентацию
















 Бессмертная комедия А. С. Грибоедова «Горе от ума»
Бессмертная комедия А. С. Грибоедова «Горе от ума» Урок коллективного посещения в 5 классе
Урок коллективного посещения в 5 классе ПЕДАГОГИЧЕСКИЙ СОВЕТОДАРЁННЫЕ ДЕТИ: реалии, проблемы, перспективы.
ПЕДАГОГИЧЕСКИЙ СОВЕТОДАРЁННЫЕ ДЕТИ: реалии, проблемы, перспективы. Ранения. Первая медицинская помощь
Ранения. Первая медицинская помощь Совершенствование сервисно-транспортной инфраструктуры придомовых территорий
Совершенствование сервисно-транспортной инфраструктуры придомовых территорий СТЕКЛЯННЫЕ ТОВАРЫ
СТЕКЛЯННЫЕ ТОВАРЫ Применение электролиза. Основная химическая промышленность
Применение электролиза. Основная химическая промышленность Маршрут прогулки по городу Борисоглебск
Маршрут прогулки по городу Борисоглебск Региональный студенческий хакатон ООО АИС город
Региональный студенческий хакатон ООО АИС город Берегите зрение
Берегите зрение Конкурентные преимущества и перспективы развития казахстанского фондового рынка
Конкурентные преимущества и перспективы развития казахстанского фондового рынка Древние восточные церкви. Православие за рубежом в xх – xxi вв
Древние восточные церкви. Православие за рубежом в xх – xxi вв Pro-психологов: психологическая служба образовательной организации
Pro-психологов: психологическая служба образовательной организации ST Main Page
ST Main Page Лекарственная аллергия
Лекарственная аллергия Знаковые модели. Моделирование и формализация
Знаковые модели. Моделирование и формализация Развитие координационных способностей у юных борцов вольного стиля
Развитие координационных способностей у юных борцов вольного стиля Диплом партнёра центра спортивного комплексного обучения по хоккею г. Сморгони
Диплом партнёра центра спортивного комплексного обучения по хоккею г. Сморгони МЕТОДИКА ПРОВЕДЕНИЯ КОРРЕКЦИОННЫХ ЗАНЯТИЙ
МЕТОДИКА ПРОВЕДЕНИЯ КОРРЕКЦИОННЫХ ЗАНЯТИЙ Политический конфликт
Политический конфликт Чемпионат и первенство города Ярославля по зимнему триатлону
Чемпионат и первенство города Ярославля по зимнему триатлону AI автомобиля в изменчивом мире на примере Ex Machina
AI автомобиля в изменчивом мире на примере Ex Machina Восприятие речи
Восприятие речи Конаково
Конаково Сударыня - Масленица
Сударыня - Масленица Візуальний контакт під час ділової комунікації
Візуальний контакт під час ділової комунікації Технологии проведения избирательной кампании
Технологии проведения избирательной кампании Общественная организацияг.Балаково Саратовской области«Попечительский совет средней школы №11»
Общественная организацияг.Балаково Саратовской области«Попечительский совет средней школы №11»