Содержание
- 2. Вода в жизни человека. Физические свойства воды. Химические свойства воды. Круговорот воды в природе. Мягкая и
- 3. Вода в жизни человека! Вода – самое удивительное и самое распространенное природное соединение – источник и
- 4. В организме человека вода: увлажняет кислород для дыхания, регулирует температуру тела, позволяет организму усваивать температуру тела,
- 5. В конце 60 – х начале 70 – х годов 20 века в статьях и книгах
- 6. Предположим, если бы вода не обладала этим удивительным качеством, что бы произошло с человеком, состоящим в
- 7. Определенное изменение физических свойств воды происходит под воздействием внешних полей. Известны экспериментальные данные о странном явлении
- 8. Оказывается вода - весьма активное в химическом отношении вещество. 1. Вода реагирует со многим металлами с
- 9. SO2 + Н2 О = Н2SO3 сернистая кислота. SO3 + Н2О = Н2SO4 серная кислота. СО2
- 10. Круговорот воды в природе. Вода – находится в постоянном круговороте. Она испаряется с поверхности растений, почвы,
- 11. преимущества , так и недостатки качества источника питьевой воды. Вот, как сложно протекает круговорот воды в
- 12. Жесткая вода – это одна из самых распространенных проблем не только в загородных домах с автономным
- 13. Использование жесткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах, а появлении накипи является
- 14. Загрязнение воды и способы ее очистки. Водоемы загрязняются опасным водами промышленных и коммуникальных предприятий при заготовке,
- 15. Ионы тяжелых металлов вначале поглощают водные растения. Далее по цепочках питания поступают к растительноядным животным, затем
- 16. При сильном загрязнении, самоочищение воды не происходит, из-за гибели организмов и нарушения естественных биологических процессов. Поэтому
- 18. Скачать презентацию
Слайд 2Вода в жизни человека.
Физические свойства воды.
Химические свойства воды.
Круговорот воды в природе.
Мягкая и
Вода в жизни человека.
Физические свойства воды.
Химические свойства воды.
Круговорот воды в природе.
Мягкая и

Загрязнение воды и способы ее очистки.
Использованные информационные ресурсы.
СОДЕРЖАНИЕ:
Слайд 3Вода в жизни человека!
Вода – самое удивительное и самое распространенное природное соединение
Вода в жизни человека!
Вода – самое удивительное и самое распространенное природное соединение

В целом организм человека состоит по весу на 50% - 86% из воды ( у новорожденного до 86%, у пожилых до 50%).Также вода содержится в различных частях тела: кости 20% -30%, мозг – до 75%, кровь – до 85%. Это обстоятельство позволило В. Савченко заявить о том, что у человека «гораздо больше оснований считать себя жидкостью, чем скажем у сорокапроцентного раствора едкого натрия.» Для человека вода является ценным природным богатством, чем уголь, газ, железо, потому что она не заменима.
Слайд 4 В организме человека вода:
увлажняет кислород для дыхания,
регулирует температуру тела,
позволяет организму усваивать
В организме человека вода:
увлажняет кислород для дыхания,
регулирует температуру тела,
позволяет организму усваивать

защищает жизненно важные органы,
смазывает суставы,
помогает преобразовать пищу в энергию, участвует в обмене веществ,
выводит различные отходы из организма.
Правильный питьевой режим подразумевает сохранение
физиологического водного баланса – это уравновешивание поступления
воды с ее выделением. Если в организм поступает достаточное
количество воды то человек становится энергичным и выносливым. Ему
проще всего контролировать свой вес, поскольку улучшается
пищеварения.
Таким образом можно сделать вывод о том, что роль воды для человека
огромна. Сегодня каждый человек может создать для себя
условия сохранения бесценного водного баланса, путем правильного
организации питьевого режима.
Слайд 5В конце 60 – х начале 70 – х годов 20 века
В конце 60 – х начале 70 – х годов 20 века

Вода прозрачная жидкость без вкуса запаха и цвета. Ее аномалии вызваны особенностями строения молекулы воды. Так вода имеет наибольшую теплоемкость среди жидкостей – 41868 кДж/кг что почти вдвое превышает таковую растительных масел ацетона спирт: она в 10 раз больше ,чем у железа. У воды от 0° С до 37°С теплоемкость снижается, а с 37°С и выше растет. Получается, что легче всего она нагревается и быстрее всего охлаждается при температуре 37° C. Это особенность пока не объяснена, как утверждает
академик А.М. Черняев однако совпадение с нормальной температурой здорового человека (36,6°С до 37 °С) невольно наводит на размышления.
Физические свойства воды.
Слайд 6 Предположим, если бы вода не обладала этим удивительным качеством, что бы
Предположим, если бы вода не обладала этим удивительным качеством, что бы

Слайд 7Определенное изменение физических свойств воды происходит под воздействием внешних полей. Известны экспериментальные
Определенное изменение физических свойств воды происходит под воздействием внешних полей. Известны экспериментальные
Слайд 8Оказывается вода - весьма активное в химическом отношении
вещество.
1. Вода реагирует со многим
Оказывается вода - весьма активное в химическом отношении
вещество.
1. Вода реагирует со многим

2Na + 2Н2О = 2NaOН ( бурно)
2К + 2Н2О= Н + 2КОН (бурно)
3Fe + 4H2 O = 4H2 + Fe3O4 ( только при нагревании.)
Не все, только достаточно активные металлы могут участвовать в
окислительно восстановительных реакциях этого типа. Наиболее легко
реагируют щелочные и щелочноземельные металлы 1 и 2 групп.
Из неметаллов с водой реагирует, например: углерод и его водородное
соединение (метан). Эти вещества гораздо менее активны чем металлы,
но все же способны реагировать с водой при высокой температуре.
С + Н2О = Н2 = СО (при сильном нагревании.)
СН2 + 2Н2 О = 4Н2 +СО2 (при сильном нагревании.
Химические свойства воды.
Слайд 9 SO2 + Н2 О = Н2SO3
сернистая кислота.
SO3
SO2 + Н2 О = Н2SO3
сернистая кислота.
SO3

серная кислота.
СО2 +Н2 О = Н2СО3
угольная кислота.
2.Вода разлагается на водород и кислород под действием электрического
тока. Вода может одновременно является окислителем и
восстановителем.
2Н2О Электр. ток 2Н2 + О2
3.Некоторые оксиды металлов также могут вступать в реакции соединения с водой, но не все. Часть из них практически не растворима в воде и поэтому с водой не реагирует. Мне уже встречались такие оксиды. Это: ZnO, TiO2, Cr2O3 из которых приготовляют: например стойкие в воде краски.
Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих эти реакции не окислительно – восстановительные а реакции соединения.
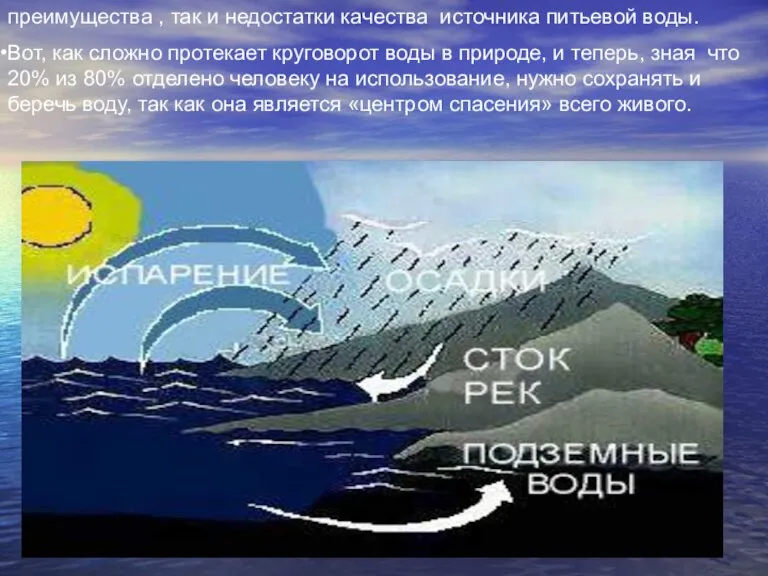
Слайд 10Круговорот воды в природе.
Вода – находится в постоянном круговороте. Она испаряется с
Круговорот воды в природе.
Вода – находится в постоянном круговороте. Она испаряется с

Все осадки которые выпадают на 80% попадают в океан, для меня больший интерес представляет оставшиеся 20%, выпадающие на сушу, так как большинство используемых человеком воды выполняется за счет этого вида осадков. Проще говоря, у воды попавшей на сушу есть 2 пути. Либо она собираясь в ручьи и реки, попадает в результате в озера и водохранилища – так называемые открытые (или поверхностные) источники водозабора. Либо вода просачиваясь через почву и подпочвенные слои, пополняет запасы грунтовых вод. Поверхностные и грунтовые составляют два основных источника водоснабжения. Оба этих ресурса взаимосвязаны и имеют как свои
Слайд 11преимущества , так и недостатки качества источника питьевой воды.
Вот, как сложно
преимущества , так и недостатки качества источника питьевой воды.
Вот, как сложно
Слайд 12 Жесткая вода – это одна из самых распространенных проблем не только
Жесткая вода – это одна из самых распространенных проблем не только

Мягкая и жесткая вода.
Слайд 13 Использование жесткой воды вызывает появление осадка (накипи) на стенках котлов, в
Использование жесткой воды вызывает появление осадка (накипи) на стенках котлов, в

Из этого можно сделать вывод что употребление и использовании жесткой или мягкой воды наносит не большой но эффективный вред людям.
Слайд 14Загрязнение воды и
способы ее очистки.
Водоемы загрязняются опасным водами промышленных и коммуникальных
Загрязнение воды и
способы ее очистки.
Водоемы загрязняются опасным водами промышленных и коммуникальных

Слайд 15Ионы тяжелых металлов вначале поглощают водные растения. Далее по цепочках питания поступают
Ионы тяжелых металлов вначале поглощают водные растения. Далее по цепочках питания поступают

Природная вода обладает способностью самоочищения под влиянием естественных факторов: солнечного света, атмосферных газов, жизнедеятельности организмов – бактерий, грибов, зеленых растений, животных. В процессе естественного самоочищения при многократном разбавлении стоков чистой водой. В реке через 24ч. остается около 50% бактерий а через 63ч. - 0,5%.
Слайд 16При сильном загрязнении, самоочищение воды не происходит, из-за гибели организмов и нарушения
При сильном загрязнении, самоочищение воды не происходит, из-за гибели организмов и нарушения

Охрана вод представляет собой систему мероприятий направленных на предотвращение и установления последствий загрязнения и истощения вод.
 и формирование отчетности
и формирование отчетности Презентация на тему Швейные товары
Презентация на тему Швейные товары  Филологи
Филологи АУДИТ
АУДИТ Проектирование СКС коттеджного участка из бруса
Проектирование СКС коттеджного участка из бруса Интеграция риск-менеджмента в ключевые процессы принятия решений
Интеграция риск-менеджмента в ключевые процессы принятия решений Проект: Юридическое сопровождение дополнительной эмиссии обыкновенных акций, размещаемых по открытой подписке
Проект: Юридическое сопровождение дополнительной эмиссии обыкновенных акций, размещаемых по открытой подписке Выполненное и планируемое благоустройство
Выполненное и планируемое благоустройство Вопросы составления и заверения отчетности получателей бюджетных средств в территориальных органах Федерального казначейства
Вопросы составления и заверения отчетности получателей бюджетных средств в территориальных органах Федерального казначейства Чудесные превращения воды в природе (3 класс)
Чудесные превращения воды в природе (3 класс) Волга – главный символ нашего края
Волга – главный символ нашего края Виды систем наддува дизелей на судне. Аксиально-поршневой насос
Виды систем наддува дизелей на судне. Аксиально-поршневой насос Гражданское общество. Задания для выполнения
Гражданское общество. Задания для выполнения Природные и экологические опасности
Природные и экологические опасности London
London  Семейное право
Семейное право Morphonologie der Verben IPrasens
Morphonologie der Verben IPrasens Www.auditexpo.ru. Основные типы клиентов: Аналитический - ключевой вопрос: «Как?», «Зачем?» Рассудителен, Логичен, Собран, Нужны детали, Изуч
Www.auditexpo.ru. Основные типы клиентов: Аналитический - ключевой вопрос: «Как?», «Зачем?» Рассудителен, Логичен, Собран, Нужны детали, Изуч Мотивация продавцов-промоутеров SEB
Мотивация продавцов-промоутеров SEB Выражение характера человека в изображении. Женский образ русских сказок
Выражение характера человека в изображении. Женский образ русских сказок Портфолио
Портфолио Школьный музей "Родные истоки"
Школьный музей "Родные истоки" Тип, имя и значение переменной
Тип, имя и значение переменной Путь из Варяг в Греки
Путь из Варяг в Греки Масштабируемое решениеот ЛПУ до региона
Масштабируемое решениеот ЛПУ до региона Агроэкосистеемы, или аграрные экологические системы
Агроэкосистеемы, или аграрные экологические системы Религия как одна из форм культуры
Религия как одна из форм культуры Угольная кислота
Угольная кислота