Слайд 2Среду водородного раствора можно охарактеризовать концентрацией ионов водорода Н+ или гидроксид-ионов ОН+
Существует

три типа среды:
Нейтральная
Кислотная
Щелочная
Слайд 3Нейтральная-
Это среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов:
[H+]=[OH-]=10-7 моль/л
![Нейтральная- Это среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов: [H+]=[OH-]=10-7 моль/л](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/380036/slide-2.jpg)
Слайд 4Кислотная-
Это среда, в которой концентрация ионов водорода больше концентрации гидроксид-ионов:
[H+]>[OH-], [H+]>10-7 моль/л
![Кислотная- Это среда, в которой концентрация ионов водорода больше концентрации гидроксид-ионов: [H+]>[OH-], [H+]>10-7 моль/л](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/380036/slide-3.jpg)
Слайд 5Щелочная-
Это среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов:
[H+]<[OH-], [H+]< 10-7моль/л
![Щелочная- Это среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов: [H+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/380036/slide-4.jpg)
Слайд 6Для характеристики сред растворов удобно использовать так называемый водородный показатель рн (пэ-аш),

введённый датским химиком Сёренсеном: р-начальная буква слова potenz- математическая степень, Н- химический знак водорода.
Водородным показателем РН называется отрицательный десятичный логарифм концентрации ионов водорода.
РН=-lg[H+]
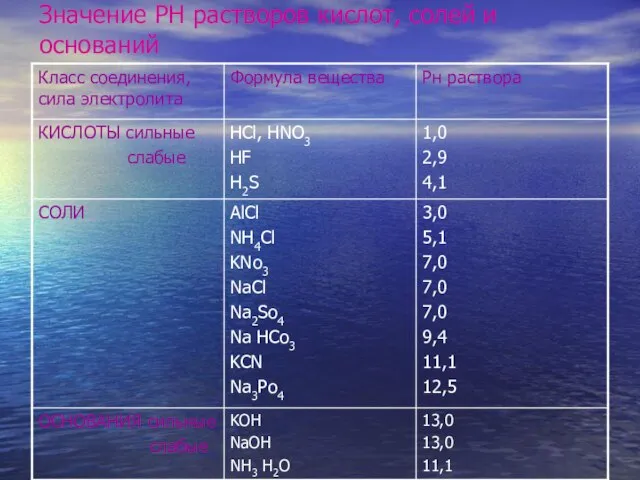
Слайд 7Значение РН растворов кислот, солей и оснований
Слайд 8Значение рн некоторых физиологических жидкостей


![Нейтральная- Это среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов: [H+]=[OH-]=10-7 моль/л](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/380036/slide-2.jpg)
![Кислотная- Это среда, в которой концентрация ионов водорода больше концентрации гидроксид-ионов: [H+]>[OH-], [H+]>10-7 моль/л](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/380036/slide-3.jpg)
![Щелочная- Это среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов: [H+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/380036/slide-4.jpg)



 Текстовое ранжирование в Яндексе. Особенности подхода TF*IDF.
Текстовое ранжирование в Яндексе. Особенности подхода TF*IDF. Презентация на тему Роль инновационных технологий в повышении качества образования
Презентация на тему Роль инновационных технологий в повышении качества образования Химия в быту
Химия в быту Презентация на тему Направленность личности (10 класс)
Презентация на тему Направленность личности (10 класс) Убежища и укрытия
Убежища и укрытия Президенты США
Президенты США Конфликты, возникающие внутри организации
Конфликты, возникающие внутри организации Санкт Петербург, 03 декабря 2002 г.. Акционеры Банка До июля 2000 г. :53% ЕБРР 47% ФЭРС собственные средства: 3 млн. USD Увеличение капитала на 10
Санкт Петербург, 03 декабря 2002 г.. Акционеры Банка До июля 2000 г. :53% ЕБРР 47% ФЭРС собственные средства: 3 млн. USD Увеличение капитала на 10  EICC-KEMEROVO
EICC-KEMEROVO Как мы сделали это
Как мы сделали это The principles of design
The principles of design Обучение граждан, пострадавших вследствии короновирусной инфекции. Федеральная программа
Обучение граждан, пострадавших вследствии короновирусной инфекции. Федеральная программа Содержание
Содержание Технология обеспечения качества Компилятора
Технология обеспечения качества Компилятора Click to edit Master title style Click to edit Master subtitle style
Click to edit Master title style Click to edit Master subtitle style  Институциональные инвесторы на рынке ценных бумаг
Институциональные инвесторы на рынке ценных бумаг Взлетно-посадочная механизация крыла. Назначение и основные схемы шасси. Основы устройства силовых установок и их конструкция
Взлетно-посадочная механизация крыла. Назначение и основные схемы шасси. Основы устройства силовых установок и их конструкция Немного о программе: В 2010 году в Беларуси вышел первый сезон программ «Брэйн-ринг». После успешных эфиров и многочисленных заявок н
Немного о программе: В 2010 году в Беларуси вышел первый сезон программ «Брэйн-ринг». После успешных эфиров и многочисленных заявок н Программа Как быстро закрыть кредиты и увеличить свой доход в 2 раза за 90 дней
Программа Как быстро закрыть кредиты и увеличить свой доход в 2 раза за 90 дней Steps to Your Career (Doctor)
Steps to Your Career (Doctor) Буква Ы (1 класс)
Буква Ы (1 класс) Презентация по физике на тему:
Презентация по физике на тему: Am, is или are?
Am, is или are? Halloween. Ogtober, 31
Halloween. Ogtober, 31 Обучение технике перемещения на площадке
Обучение технике перемещения на площадке Изонить
Изонить Я родился
Я родился Порядок слов в предложении. Логическое ударение
Порядок слов в предложении. Логическое ударение