Содержание
- 2. Проблематика самоорганизации структуры белка “Предсказание трехмерной структуры белка по его аминокислотной последовательности.” “Каким образом белковая молекула
- 3. Белки могут сворачиваться в свои третичные структуры спонтанно В растворах белковые молекулы самостоятельно организуются в трехмерные
- 4. Парадокс Левинтала Можем предположить, что для каждой аминокислоты существует три варианта ее состояния в белке (α-спираль,
- 5. Почему “Самоорганизация структуры белка” так важна? Белки играют важные роли в живых организмах. Некоторые белки напрямую
- 6. Почему проблема “Самоорганизации структуры белка” так сложна? С точки зрения компьютерного моделирования, Сложно моделировать весь процесс
- 7. Молекулярная Динамика (MD) В модели молекулярной динамики, мы имитируем движение атомов как функцию от времени на
- 8. Интегрирование с использованием метода конечной разности Положения в моменты времени (t + Δt ) и (t
- 9. Силы, участвующие в процессе самоорганизации белковой молекулы Электростатические взаимодействия Силы Ван дер Ваальса Водородные связи Гидрофобные
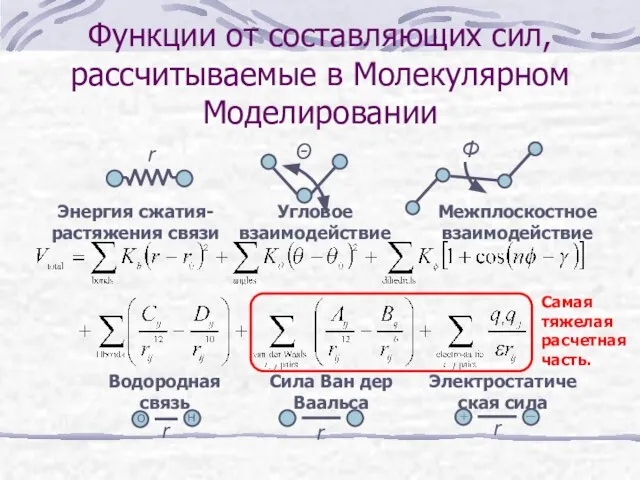
- 10. Функции от составляющих сил, рассчитываемые в Молекулярном Моделировании Электростатическая сила Водородная связь Сила Ван дер Ваальса
- 11. Система для Моделирования с помощью Молекулярной Динамики Без молекул воды С молекулами воды Кол-во атомов: 304
- 12. MD требует колоссальных вычислительных мощностей Квант времени в методе MD (Δt) ограничен 1 фсек (10-15 сек).
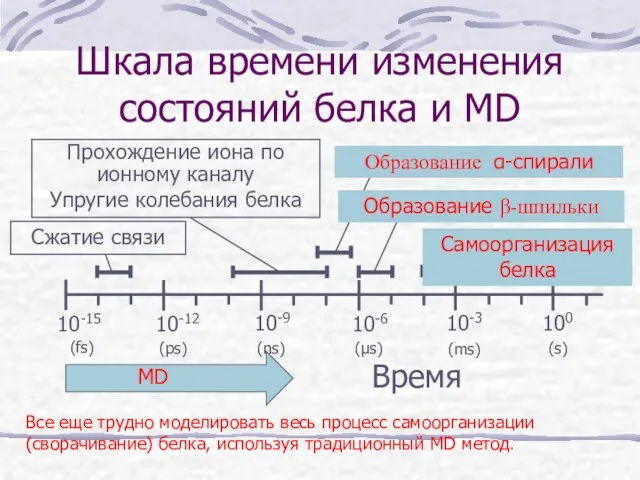
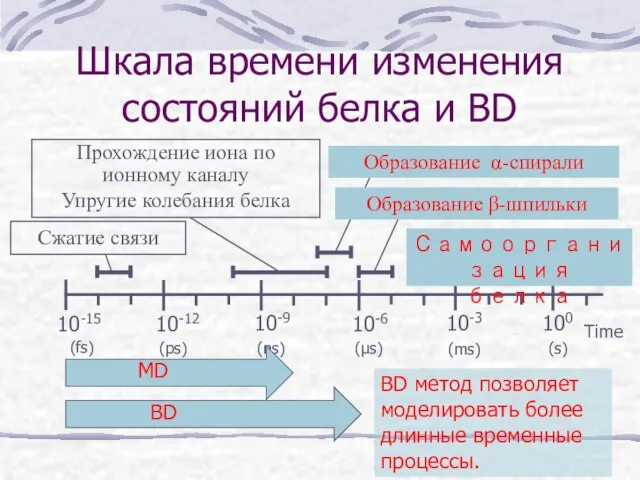
- 13. Шкала времени изменения состояний белка и MD Время Сжатие связи Прохождение иона по ионному каналу Упругие
- 14. Гораздо быстрее, Гораздо больше! Специальные компьютеры Расчет свободных взаимодействий (не химических связей) обеспечивается с использованием специальных
- 15. Броуновская Динамика (BD) Динамический вклад растворителя представлен в виде рассеянного случайного воздействия (Открытие Эйнштейна в 1905).
- 16. Система для BD Моделирования Без молекул воды С молекулами воды Кол-во атомов: 304 Кол-во атомов: 304
- 17. Алгоритм BD Уравнение Ланжевина может быть выражено так: Здесь, ri и mi отражают соответственно положение и
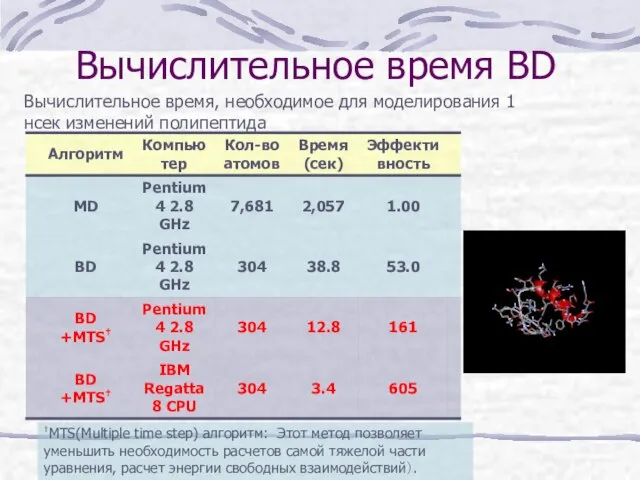
- 18. Вычислительное время BD †MTS(Multiple time step) алгоритм: Этот метод позволяет уменьшить необходимость расчетов самой тяжелой части
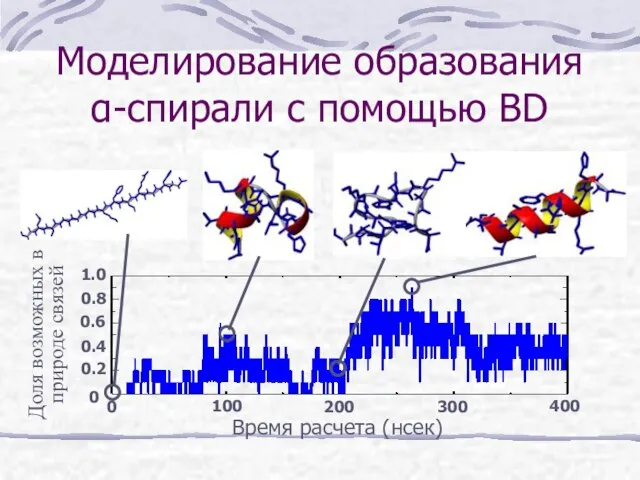
- 19. Моделирование образования α-спирали с помощью BD Доля возможных в природе связей Время расчета (нсек) 0 300
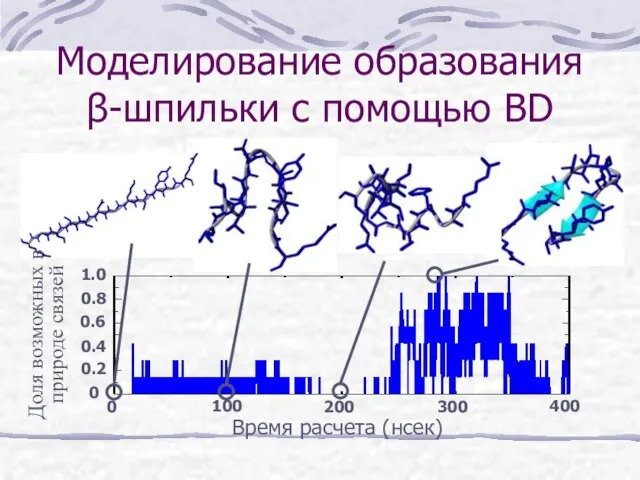
- 20. Моделирование образования β-шпильки с помощью BD Доля возможных в природе связей Время расчета (нсек) 0 300
- 21. Шкала времени изменения состояний белка и BD Time BD метод позволяет моделировать более длинные временные процессы.
- 23. Скачать презентацию














 Презентация(проект) на тему:
Презентация(проект) на тему: Юридический клуб Екатеринбурга. Правовая просвещенность. Профессиональный выбор. Гражданская позиция
Юридический клуб Екатеринбурга. Правовая просвещенность. Профессиональный выбор. Гражданская позиция 1 признак
1 признак Права собственников участков земли
Права собственников участков земли Автомобилизация России и проблемы регулирования
Автомобилизация России и проблемы регулирования Сиропы. Помада. Кандир. Фруктово-ягодные полуфабрикаты
Сиропы. Помада. Кандир. Фруктово-ягодные полуфабрикаты Презентация на тему Биогеоценоз как особый уровень организации жизни
Презентация на тему Биогеоценоз как особый уровень организации жизни Владимир Иванов, ген. директор PM Consulting Services. - презентация
Владимир Иванов, ген. директор PM Consulting Services. - презентация Пирожное "Пасхальное яйцо"
Пирожное "Пасхальное яйцо" СВЕТЛОЕ ХРИСТОВО ВОСКРЕСЕНИЕ
СВЕТЛОЕ ХРИСТОВО ВОСКРЕСЕНИЕ Редкие насекомые нуждающиеся в охране
Редкие насекомые нуждающиеся в охране Нагрев проводников и электрических аппаратов. Лекция 11
Нагрев проводников и электрических аппаратов. Лекция 11 PCI DSS в Украине К чему готовиться?
PCI DSS в Украине К чему готовиться? Dima_Maria - Use case application of SU2 soft package
Dima_Maria - Use case application of SU2 soft package Формирование ключевых компетенций учащихся начальной школы
Формирование ключевых компетенций учащихся начальной школы Внеземная жизнь в кинематографе
Внеземная жизнь в кинематографе Орфографический практикум
Орфографический практикум Lipatova_MA_Prezentatsia (1)
Lipatova_MA_Prezentatsia (1) Семинар «Поиск инвестора и подготовка документов для встречи с ним»
Семинар «Поиск инвестора и подготовка документов для встречи с ним» Возникновение культуры (первобытное общество) (Тема 3)
Возникновение культуры (первобытное общество) (Тема 3) Презентация на тему "УРОК ЗНО Інтернет і ЗНО-2014" - скачать презентации по Педагогике
Презентация на тему "УРОК ЗНО Інтернет і ЗНО-2014" - скачать презентации по Педагогике Отчёт директора МБУ ДО ДШИ №1
Отчёт директора МБУ ДО ДШИ №1 The balance sheet
The balance sheet Практика внедрения систем безналичного расчёта питания в школах. Создание единой городской информационной системы
Практика внедрения систем безналичного расчёта питания в школах. Создание единой городской информационной системы Какого цвета небо?
Какого цвета небо? Многокомпонентный динамометр
Многокомпонентный динамометр Робер Кампен (1378 – 1444)
Робер Кампен (1378 – 1444) Презентация на тему: Обезьянка-воровка
Презентация на тему: Обезьянка-воровка