Содержание
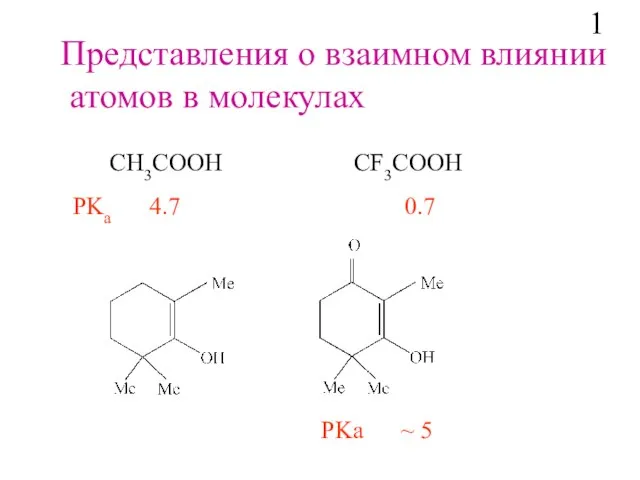
- 2. Представления о взаимном влиянии атомов в молекулах СH3COOH СF3COOH PKa 4.7 0.7 PKa ~ 5 1
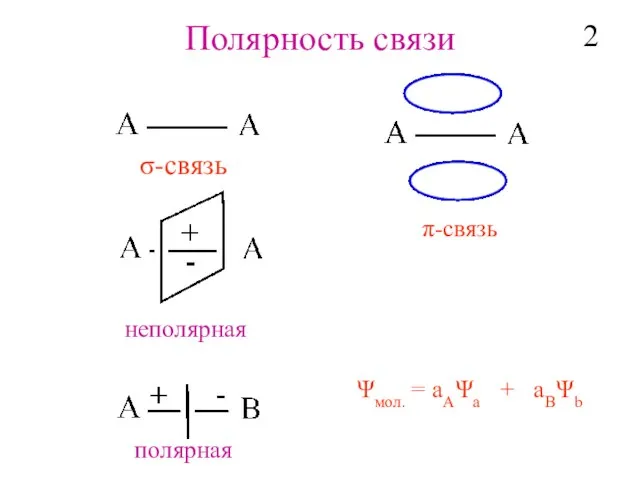
- 3. Полярность связи σ-cвязь π-cвязь Ψмол. = aAΨa + aBΨb неполярная полярная 2
- 4. 1921 - докторская степень по физической химии, 1925 – работал в Европе с Э. Шрёдингером, П.
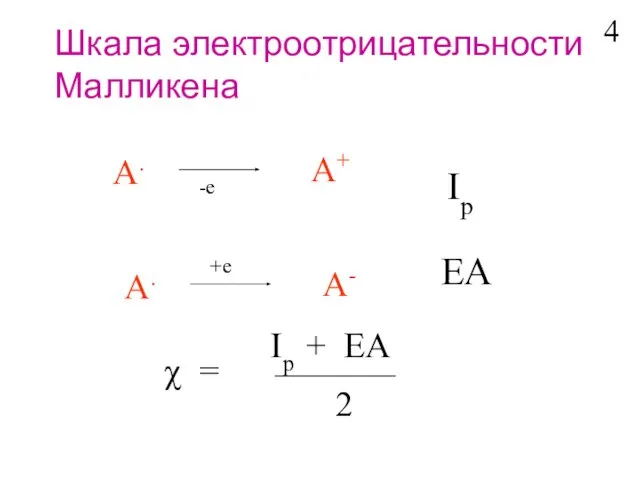
- 5. A. A+ -e Ip A. A- +e EA χ = Ip + EA 2 Шкала электроотрицательности
- 6. Шкала электроотрицательности Полинга A-B A- B+ A+ B- Ковалентная связь: EA-B = (EA-A + EB-B)/2 Ионная
- 7. Прочность связи растет с увеличением разности в электроотрицательности атомов B-F C-F N-F O-F F-F 146.7 130.6
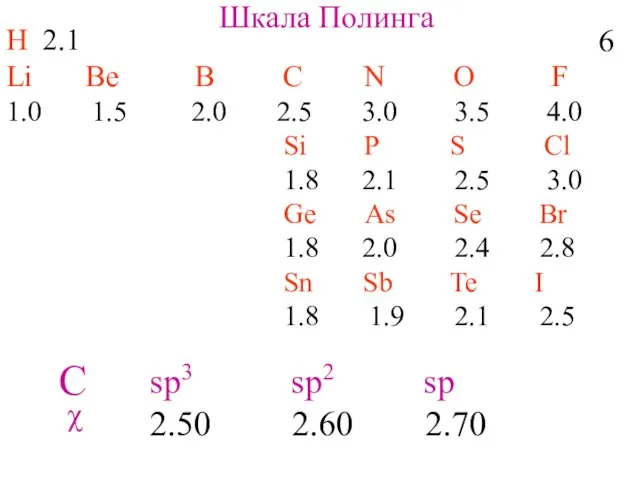
- 8. H 2.1 Li Be B C N O F 1.0 1.5 2.0 2.5 3.0 3.5 4.0
- 9. Дипольные моменты μ (D) Me-Me 0 MeNH2 1.32 Me-OH 1.69 Me-F 1.81 7
- 10. Физическая природа электроотрицательности – экранирование ядра электронами. С увеличением числа электронов экранирование ядра уменьшается (от LI
- 11. Шкала Allred и Rochow χAR = 0.359 Zeff r2 + 0.744 где, r – ковалентный радиус
- 12. Спектроскопическая шкала электроотрицательности Allen χспектр. = aIP(s) + bIP(p) a + b где, IP(s) и IP(p)
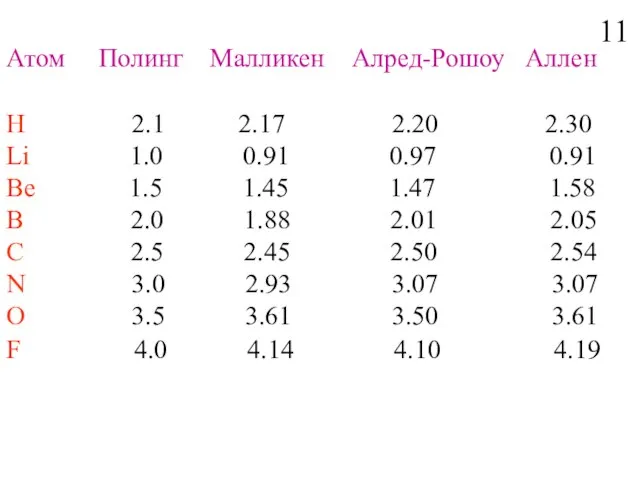
- 13. Атом Полинг Малликен Aлред-Рошоу Аллен Н 2.1 2.17 2.20 2.30 Li 1.0 0.91 0.97 0.91 Be
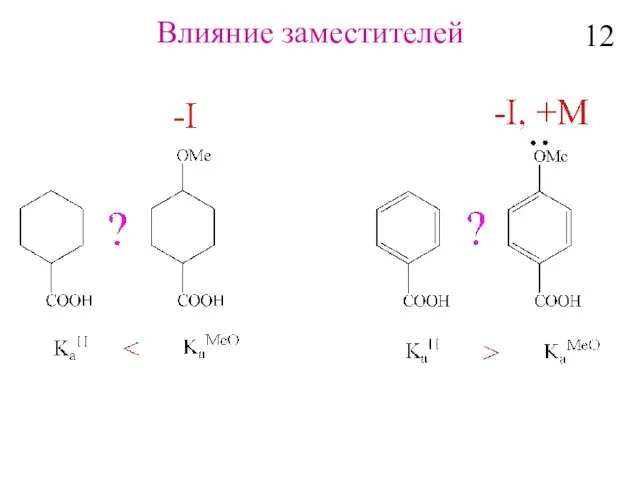
- 14. Влияние заместителей 12
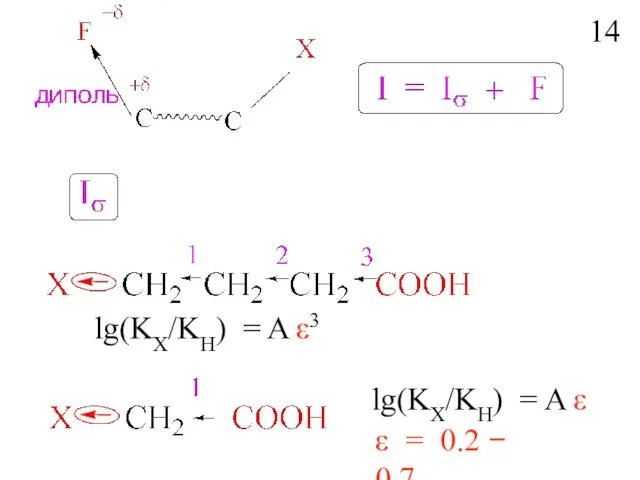
- 15. Влияние заместителей по σ-связям H – CH2 –CH2- CH2 -Y -Индукционный эффект –последовательное распространение и постепенное
- 16. lg(KX/KH) = A ε3 lg(KX/KH) = A ε ε = 0.2 − 0.7 14
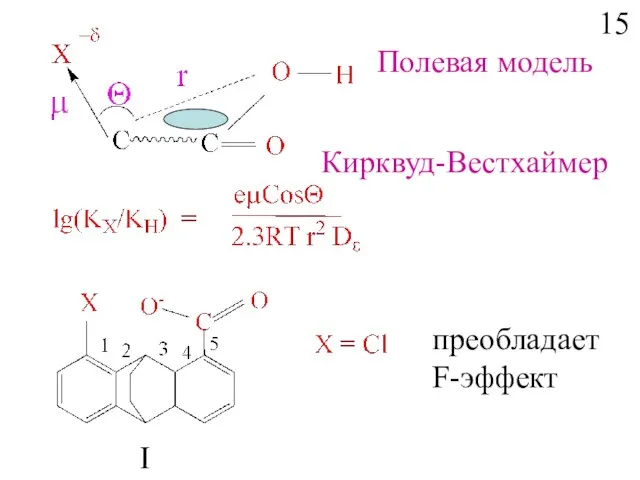
- 17. преобладает F-эффект I Полевая модель Кирквуд-Вестхаймер 15
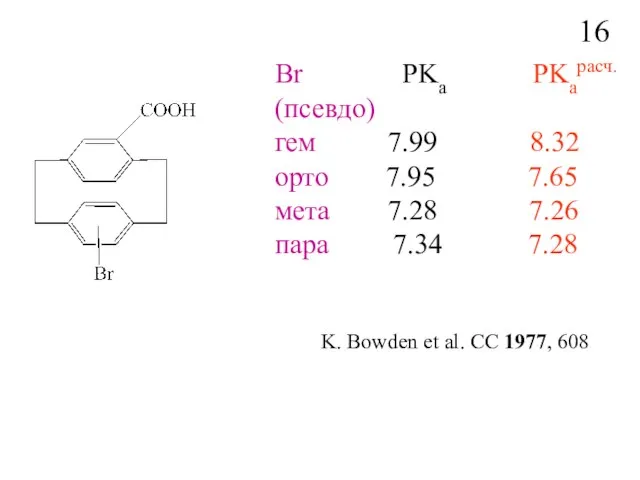
- 18. Br PKa PKaрасч. (псевдо) гем 7.99 8.32 орто 7.95 7.65 мета 7.28 7.26 пара 7.34 7.28
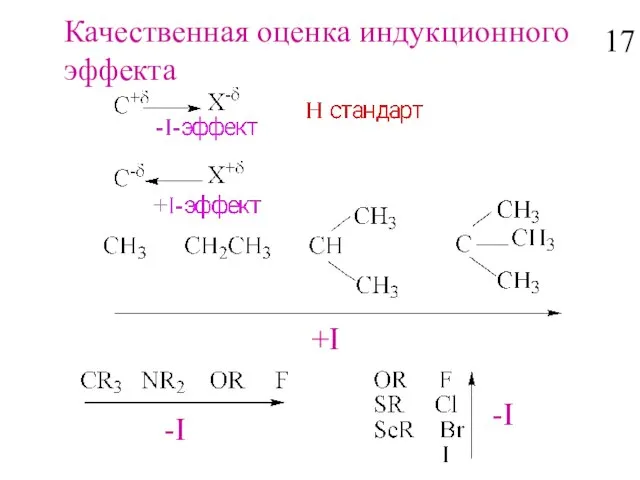
- 19. Качественная оценка индукционного эффекта -I -I +I 17
- 20. Количественная оценка индукционного Влияния (Тафт, 1952-1954 гг.) Robert W. Taft (1922-1996) -Born in Lawrence, - Ph.D.
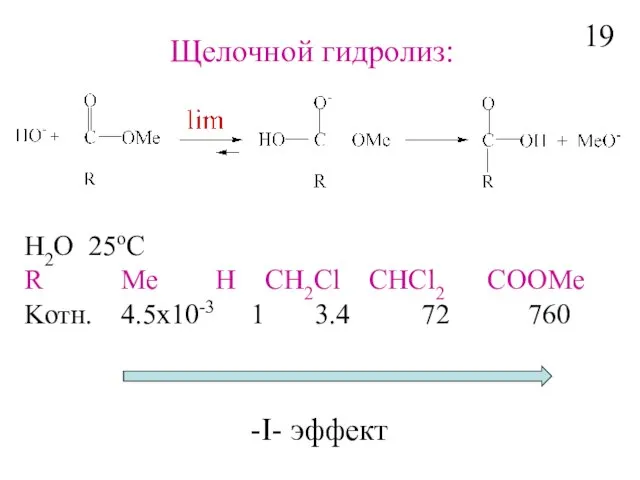
- 21. H2O 25oC R Me H CH2Cl CHCl2 COOMe Kотн. 4.5x10-3 1 3.4 72 760 -I- эффект
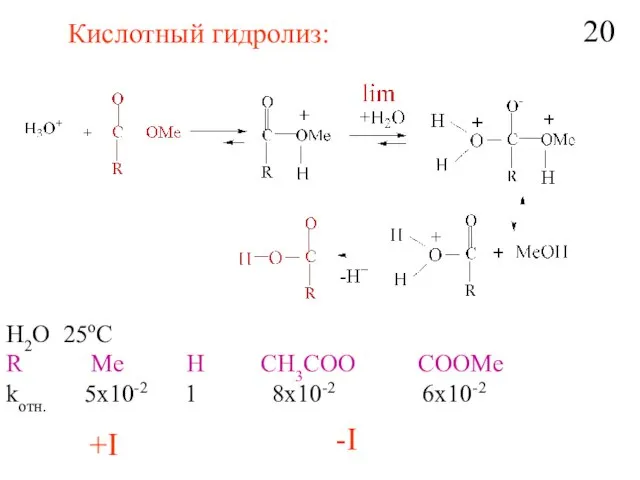
- 22. Кислотный гидролиз: H2O 25oC R Me H CH3COO COOMe kотн. 5x10-2 1 8x10-2 6x10-2 +I -I
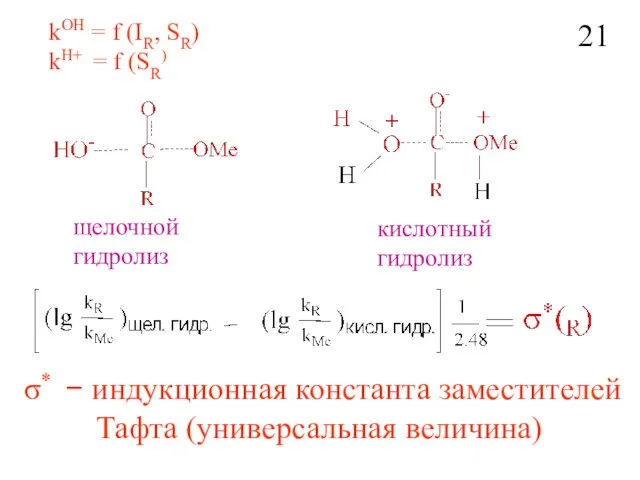
- 23. kOH = f (IR, SR) kH+ = f (SR) щелочной гидролиз кислотный гидролиз σ* − индукционная
- 24. 22
- 25. Закон затухания σ*(CH2)nR = σ*(R)εn σ*(MeSO2) = 3.7 σ*(MeSO2CH2) = 1.32 σ*(ΝΟ2) = 3.9 σ*(NO2CH2CH2) =
- 26. Уравнение Тафта − константа чувствительности реакции (определяет масштаб эффекта влияния заместителя) ρ = f (тип реакции,
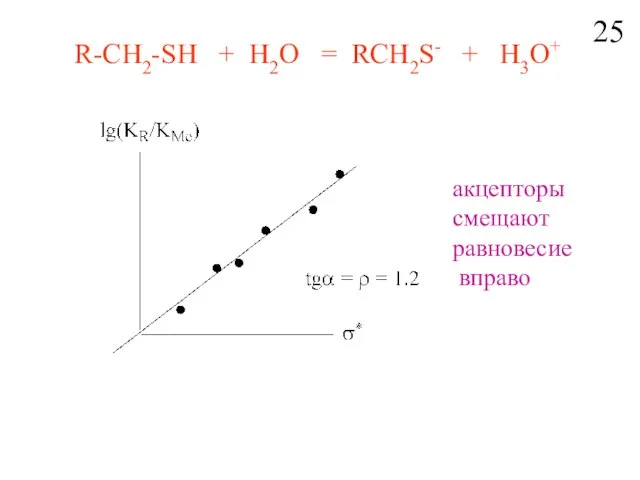
- 27. R-CH2-SH + H2O = RCH2S- + H3O+ aкцепторы смещают равновесие вправо 25
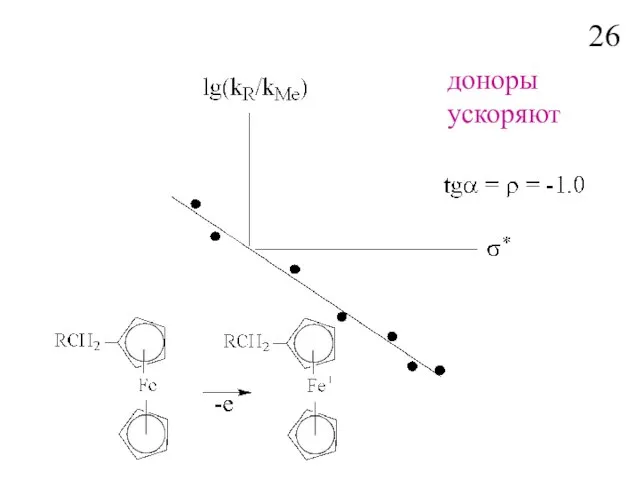
- 28. доноры ускоряют 26
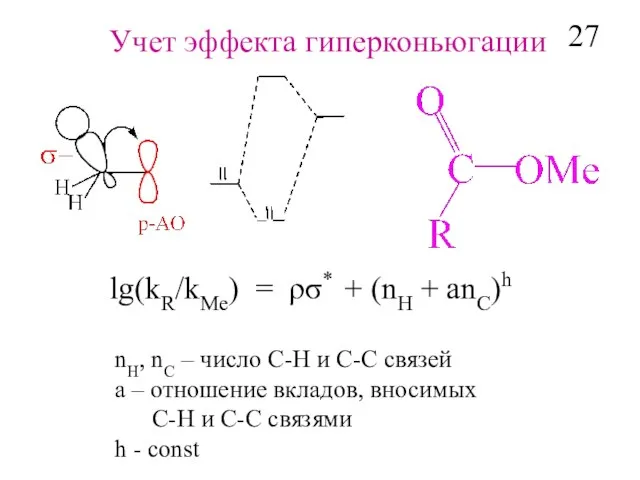
- 29. Учет эффекта гиперконьюгации lg(kR/kMe) = ρσ* + (nH + аnC)h nH, nC – число С-Н и
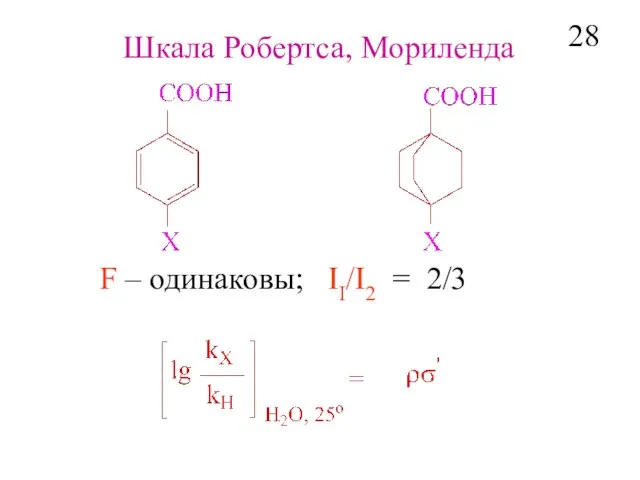
- 30. Шкала Робертса, Мориленда F – одинаковы; II/I2 = 2/3 28
- 32. Скачать презентацию












 Сталь
Сталь Царёв курган
Царёв курган Кто вы господин дракон?
Кто вы господин дракон? Современная электрическая нагрузка квартиры на примере пассивных потребителей активной мощности
Современная электрическая нагрузка квартиры на примере пассивных потребителей активной мощности Культура Беларуси во второй половине 17- первой половине 18 в
Культура Беларуси во второй половине 17- первой половине 18 в Презентация на тему Права и обязанности потребителей
Презентация на тему Права и обязанности потребителей  Общая характеристика истории и литературы ХХ века
Общая характеристика истории и литературы ХХ века Презентация на тему ЛЕТОПИСИ ЛЕТОПИСЦЫ ЗЕМЛИ РУССКОЙ
Презентация на тему ЛЕТОПИСИ ЛЕТОПИСЦЫ ЗЕМЛИ РУССКОЙ  Презентация ошибки кадастровых инженеров
Презентация ошибки кадастровых инженеров Германская служба академических обменов (DAAD) Лектор ДААД – Ola Bouziane WartiniУРФУ факультет Экономики и Управления Екатеринбург
Германская служба академических обменов (DAAD) Лектор ДААД – Ola Bouziane WartiniУРФУ факультет Экономики и Управления Екатеринбург Прохождение военной службы по призыву
Прохождение военной службы по призыву Городская экспериментальная площадка «Совершенствование форм организации образовательного процесса в обучении по индивидуальн
Городская экспериментальная площадка «Совершенствование форм организации образовательного процесса в обучении по индивидуальн Техника безопасности в школе на уроке информатики
Техника безопасности в школе на уроке информатики Пастор
Пастор Реализация. Макет
Реализация. Макет Хозяйство Центрального района
Хозяйство Центрального района СООТНОШЕНИЕ ПОЛИТИЧЕСКИХ РЕЖИМОВ С ДЕМОКРАТИЕЙ
СООТНОШЕНИЕ ПОЛИТИЧЕСКИХ РЕЖИМОВ С ДЕМОКРАТИЕЙ  Исследование силовой подготовки девушек и женщин, занимающихся фитнесом
Исследование силовой подготовки девушек и женщин, занимающихся фитнесом AGP Dust
AGP Dust Мукополисахаридоз типа I-Н (синдром Гурлер)
Мукополисахаридоз типа I-Н (синдром Гурлер)  LIBRO
LIBRO Презентация на тему Этические нормы речевой культуры
Презентация на тему Этические нормы речевой культуры
 О ПОДХОДАХ К РЕШЕНИЮ ПРОБЛЕМ ЗАЩИТЫ ПЕРСОНАЛЬНЫХ ДАННЫХ В ПРИВОЛЖСКОМ ФЕДЕРАЛЬНОМ ОКРУГЕ
О ПОДХОДАХ К РЕШЕНИЮ ПРОБЛЕМ ЗАЩИТЫ ПЕРСОНАЛЬНЫХ ДАННЫХ В ПРИВОЛЖСКОМ ФЕДЕРАЛЬНОМ ОКРУГЕ Краткая история компьютера
Краткая история компьютера Моя любимая школа
Моя любимая школа Знакомство с народными праздниками. День народного единства.
Знакомство с народными праздниками. День народного единства. Ghost-busters. Che cosa mangiano le scimmie?
Ghost-busters. Che cosa mangiano le scimmie? Презентация на тему экономический и политический кризис начала 20-х годов 9 класс
Презентация на тему экономический и политический кризис начала 20-х годов 9 класс