Содержание
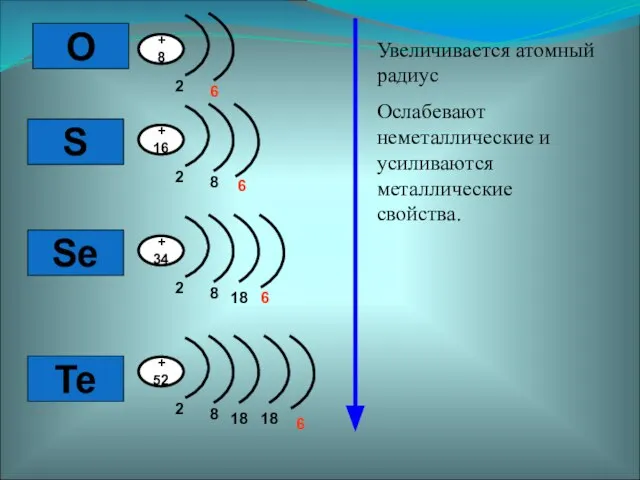
- 2. Элементы VI – А группы Атомы этих элементов содержат на внешнем уровне 6 электронов
- 3. O S Se Te
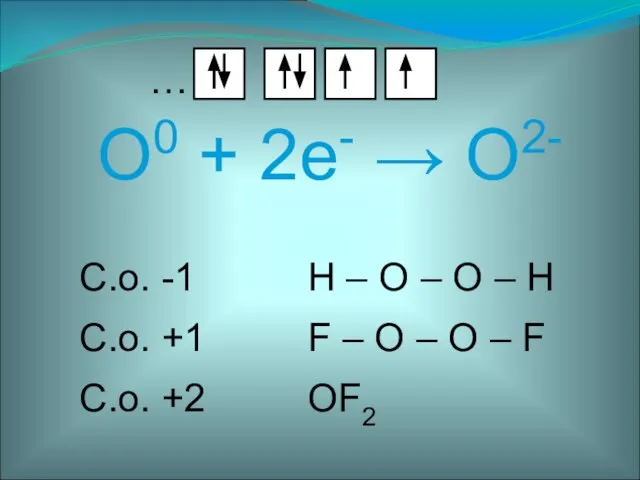
- 4. O0 + 2е- → O2- …
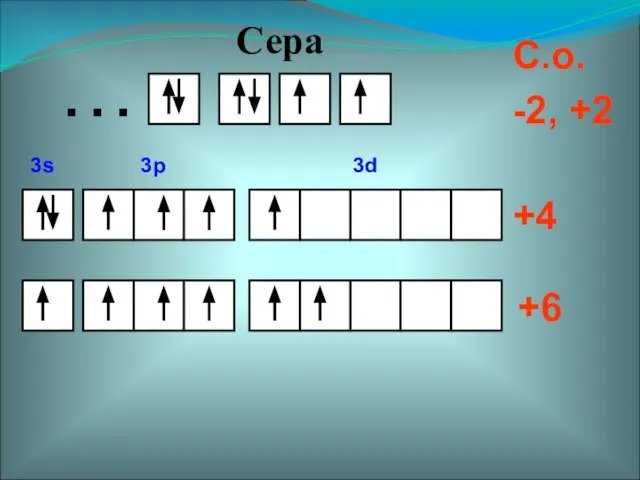
- 5. +4 +6 С.о. -2, +2 … Сера 3s 3p 3d
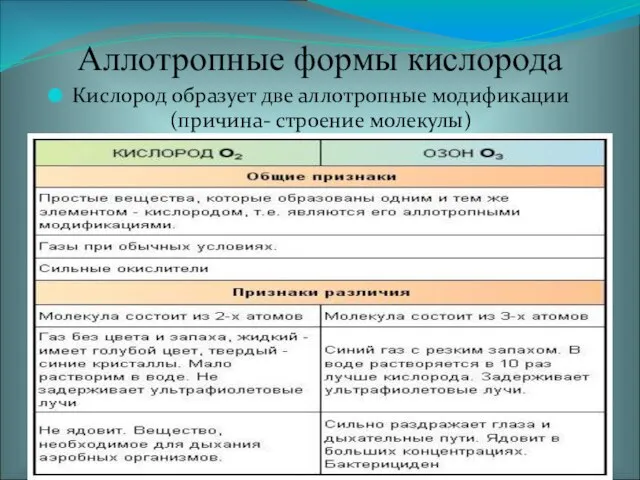
- 6. Аллотропия кислорода. Кислород и озон
- 7. Аллотропные формы кислорода Кислород образует две аллотропные модификации (причина- строение молекулы)
- 8. Аллотропия серы. Кристаллическая, пластическая и моноклинная http://www.intellect-video.com/4289/27-Poluchenie-plasticheskoy-sery-online/
- 9. Красный железняк (гематит) Fe2O3 «Халькогены» - греч. «рождающие руды» Основные руды – соединения данной подгруппы –
- 10. Магнитный железняк(магнетит) - Fe3O4
- 11. Серный колчедан ( пирит) - FeS2
- 12. Медный колчедан (халькопирит)-CuFeS3
- 13. Цинковая обманка(cфалерит)- ZnS
- 14. Свинцовый блеск (галенит)- PbS
- 15. Киноварь – HgS
- 16. Гипс – CaSO4 *2 H2O
- 17. Глауберова соль (мирабилит)- Na2SO4* 10H2O
- 18. Самородная сера Cелен
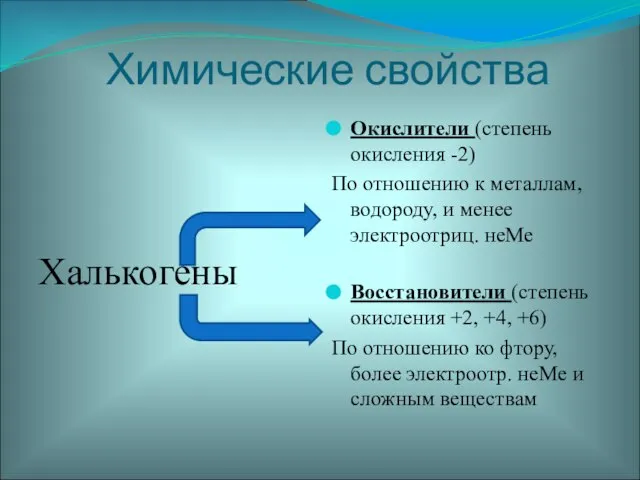
- 19. Химические свойства Халькогены Окислители (степень окисления -2) По отношению к металлам, водороду, и менее электроотриц. неМе
- 20. Химические свойства серы Окислитель Со всеми Ме, кроме Au и Pt А) S + Cu→ http://www.youtube.com/watch?v=quQ9GBdlnxE
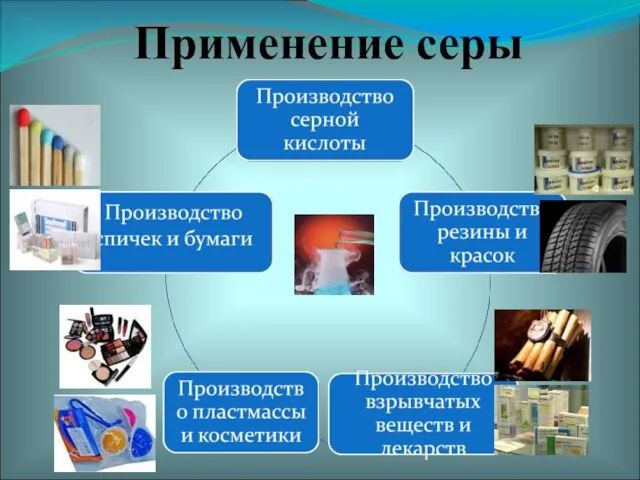
- 21. Применение серы
- 22. Биологическое значение серы Входит в состав белков (белки волос, рогов, шерсти) Составная часть витаминов, ферментов и
- 23. Домашнее задание: § 22, в.1-3. До свидания!
- 25. Скачать презентацию
















 Виды Австралии
Виды Австралии Презентация на тему Наука и образование 7 класс
Презентация на тему Наука и образование 7 класс Орхидеи из бумаги в технике квиллинга
Орхидеи из бумаги в технике квиллинга Способы обозначения [Й‘] на письме
Способы обозначения [Й‘] на письме Программы утилиты
Программы утилиты Портрет
Портрет Симметрия вокруг нас
Симметрия вокруг нас Гимнастика спортивная и атлетическая
Гимнастика спортивная и атлетическая Школа
Школа 222 группа. Лукояновский педагогический колледж им. А.М. Горького
222 группа. Лукояновский педагогический колледж им. А.М. Горького ГЕНЕОЛОГИЯ UNIX
ГЕНЕОЛОГИЯ UNIX МОУ сош№2 МО город Горячий Ключ7 апреля 2011 годаСобрание родителей учащихся 9-х, 10-х классов
МОУ сош№2 МО город Горячий Ключ7 апреля 2011 годаСобрание родителей учащихся 9-х, 10-х классов Международные договоры как источник МЧП
Международные договоры как источник МЧП example
example Новая начальная школа
Новая начальная школа Родом из бетонной коробки, или новейшая архитектура Петербурга
Родом из бетонной коробки, или новейшая архитектура Петербурга ИСПОЛЬЗОВАНИЕ ВОЗМОЖНОСТЕЙ ИНТЕРНЕТ В РАБОТЕ УЧИТЕЛЕЙ АНГЛИЙСКОГО ЯЗЫКА.
ИСПОЛЬЗОВАНИЕ ВОЗМОЖНОСТЕЙ ИНТЕРНЕТ В РАБОТЕ УЧИТЕЛЕЙ АНГЛИЙСКОГО ЯЗЫКА. Трудности адаптации первоклассников к школе
Трудности адаптации первоклассников к школе Презентация на тему Классификация детских игр
Презентация на тему Классификация детских игр Тематическая деловая игра Государственная Дума РФ
Тематическая деловая игра Государственная Дума РФ Проектный метод в образовании
Проектный метод в образовании  Презентация на тему Возрастные особенности детей 5-6 лет
Презентация на тему Возрастные особенности детей 5-6 лет  Бизнес-марафон Взлетная полоса. Команда Fairy tale
Бизнес-марафон Взлетная полоса. Команда Fairy tale Природные памятники литосферы
Природные памятники литосферы Роль книги в интеллектуальном развитии ребенка
Роль книги в интеллектуальном развитии ребенка SHOES
SHOES Изображение фигуры человека и образ человека
Изображение фигуры человека и образ человека ПРАВОПРЕЕМСТВО ГОСУДАРСТВ В ОТНОШЕНИИ ГОСУДАРТСВЕННОЙ СОБСТВЕННОСТИ, ГОСУДАРСТВЕННЫХ ДОЛГОВ И ГОСУДАРСТВЕННЫХ АРХИВОВ
ПРАВОПРЕЕМСТВО ГОСУДАРСТВ В ОТНОШЕНИИ ГОСУДАРТСВЕННОЙ СОБСТВЕННОСТИ, ГОСУДАРСТВЕННЫХ ДОЛГОВ И ГОСУДАРСТВЕННЫХ АРХИВОВ