Содержание
- 2. Молекула – это… …минимумом полной энергии системы
- 3. Термодинамика процесса образования ХС. Энтальпийный фактор Энтропийный фактор Процесс самопроизвольный, т.е. ∆ G А + В
- 4. ∆ G Основной причиной образования химических связей между атомами с образованием молекулы является понижение полной энергии
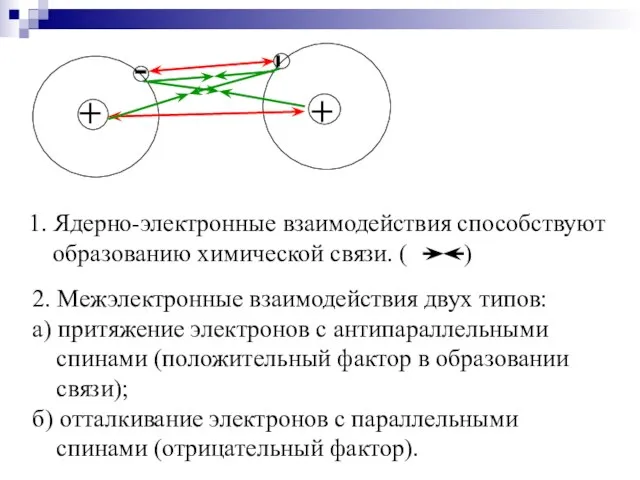
- 5. 2. Межэлектронные взаимодействия двух типов: а) притяжение электронов с антипараллельными спинами (положительный фактор в образовании связи);
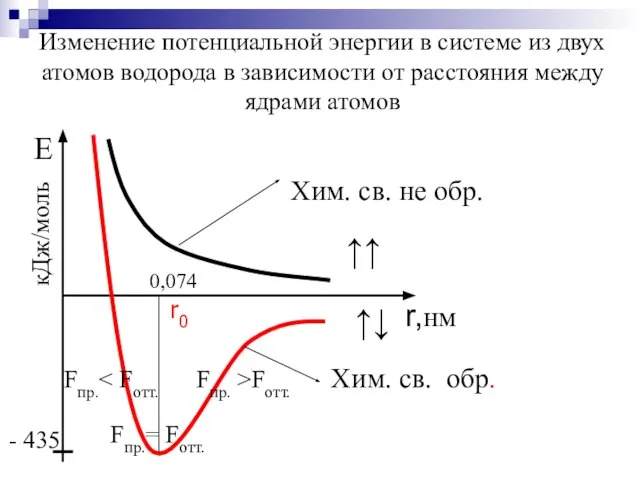
- 6. В 1927 В. Гайтлер и Ф. Лондон Исследовали зависимость потенциальной энергии системы из двух атомов Н
- 7. r,нм Изменение потенциальной энергии в системе из двух атомов водорода в зависимости от расстояния между ядрами
- 8. Химическая связь – это совокупность электронно – ядерных взаимодействий, приводящих к минимуму потенциальной энергии системы. Энергия
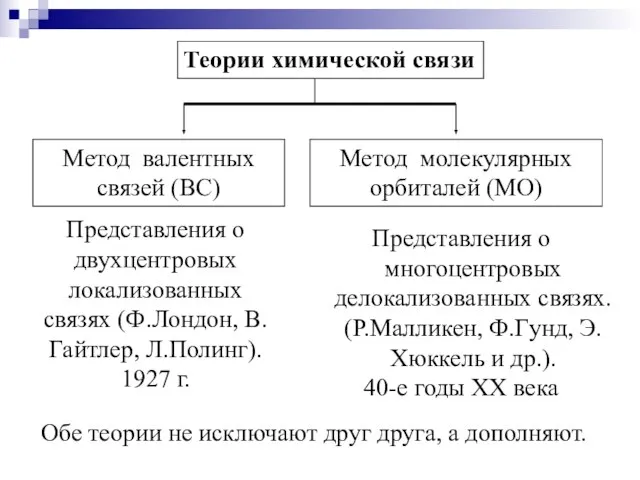
- 9. Теории химической связи Метод валентных связей (ВС) Метод молекулярных орбиталей (МО) Представления о двухцентровых локализованных связях
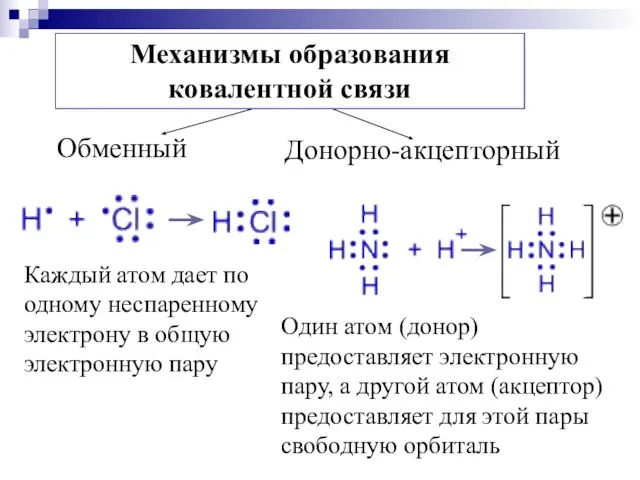
- 10. Основные положения метода ВС 1. Х. с. между атомами образуется в результате обобществления валентных электронов, т.е.
- 11. 5. В пространстве х. с. располагается в том направлении, в котором возможность перекрывания АО наибольшая. 6.
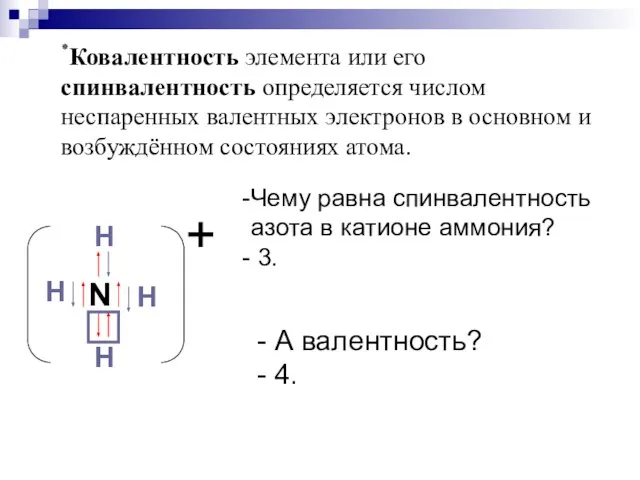
- 12. ٭Ковалентность элемента или его спинвалентность определяется числом неспаренных валентных электронов в основном и возбуждённом состояниях атома.
- 13. Каждый атом дает по одному неспаренному электрону в общую электронную пару Один атом (донор) предоставляет электронную
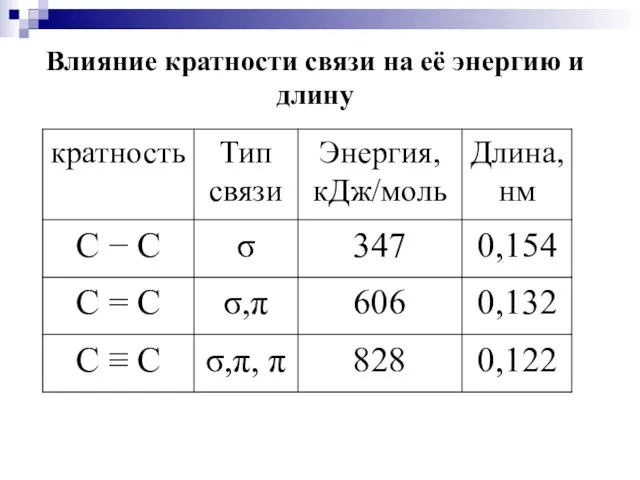
- 14. Свойства ковалентной химической связи 1. Энергия связи 2. Длина связи 3. Кратность связи 4. Насыщаемость 5.
- 15. Влияние кратности связи на её энергию и длину
- 16. Насыщаемость связи -… II период – макс. валентность не более IV III период (s- и p-)
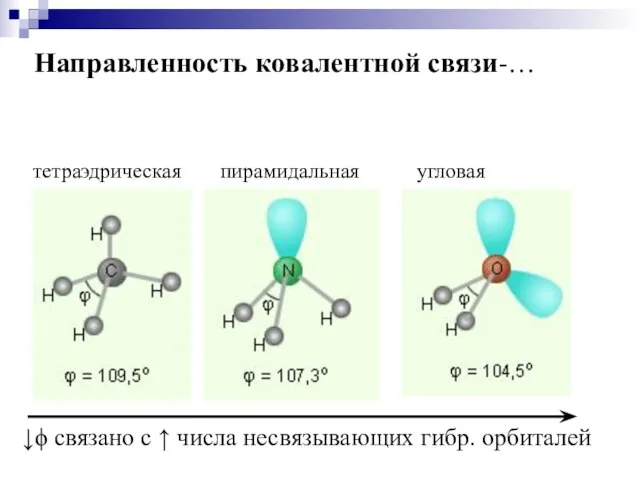
- 17. Направленность ковалентной связи-…
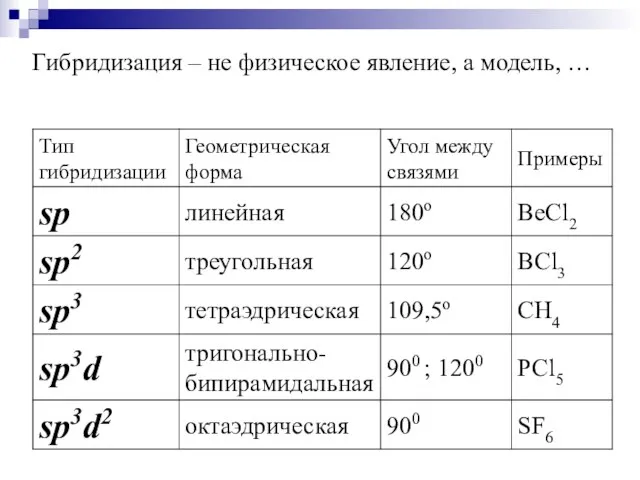
- 18. Гибридизация – не физическое явление, а модель, …
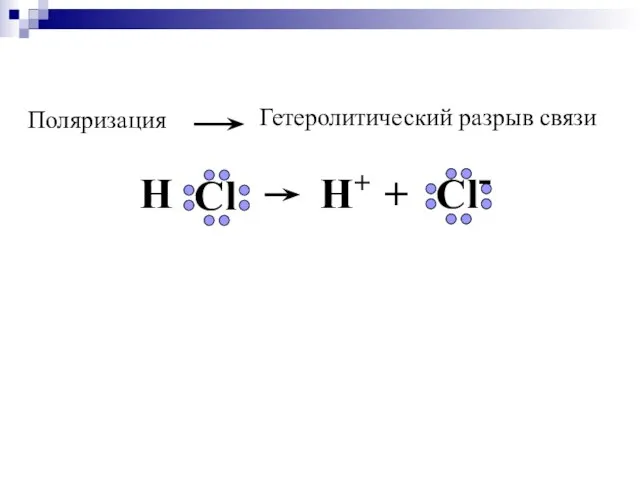
- 19. Полярность связи-… Чем ↑Δ ОЭО, тем ↑ полярность х.с Если ΔОЭО = 0 , то связь
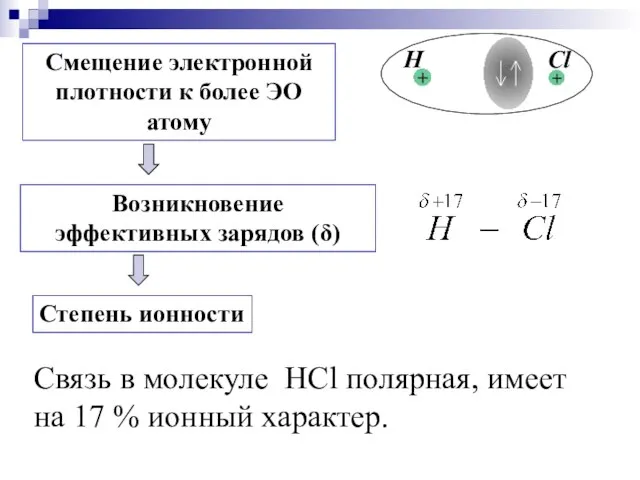
- 20. Cвязь в молекуле HCl полярная, имеет на 17 % ионный характер.
- 21. т.е. степень ионности равна 83%. Полного перетягивания связующих пар электронов от более электроположительного к более электроотрицательному
- 22. Дипольный момент связи (μ) Эффективный заряд Длина связи
- 23. Неполярные молекулы Молекула неполярна, если суммарный μ всех связей = 0.
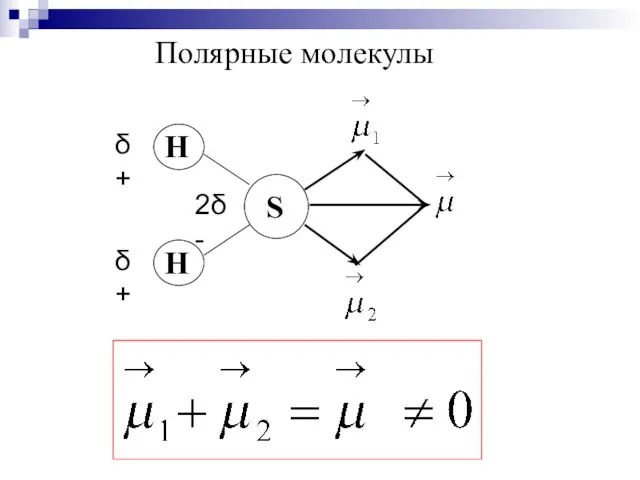
- 24. Полярные молекулы
- 25. Дипольный момент молекулы зависит: ∙от полярности связей; ∙от геометрии молекулы; ∙от наличия неподелённых пар электронов.
- 26. Поляризуемость Поляризуемость ковалентной связи – это … Полярярностью и поляризуемостью обусловленно межмолекулярное взаимодействие, например,
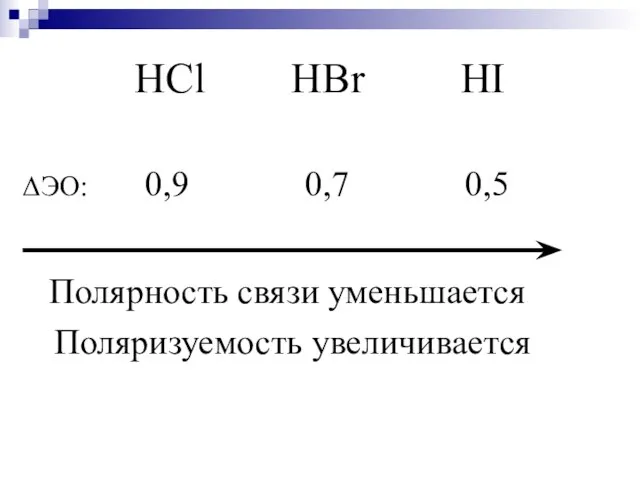
- 27. HCl HBr HI ΔЭО: 0,9 0,7 0,5 Полярность связи уменьшается Поляризуемость увеличивается
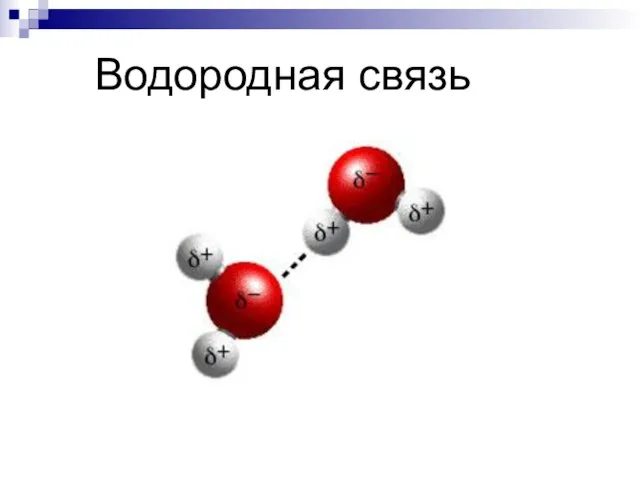
- 29. Водородная связь
- 30. Взаимодействие между молекулами НХ: сильно ЭО элемент: F, O, N, (Cl, S )
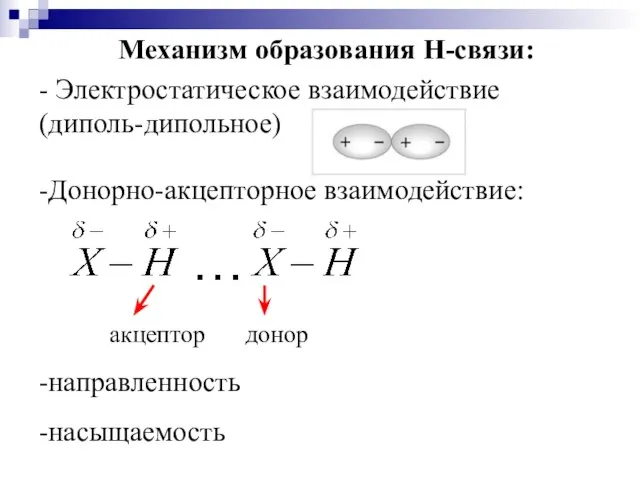
- 31. Механизм образования Н-связи: - Электростатическое взаимодействие (диполь-дипольное) -Донорно-акцепторное взаимодействие: -направленность -насыщаемость
- 32. Есвязи, кДж/моль ковалентная 100-400 водородная 4-50 межмолекулярная 0,1 -5 Энергия Н-связи
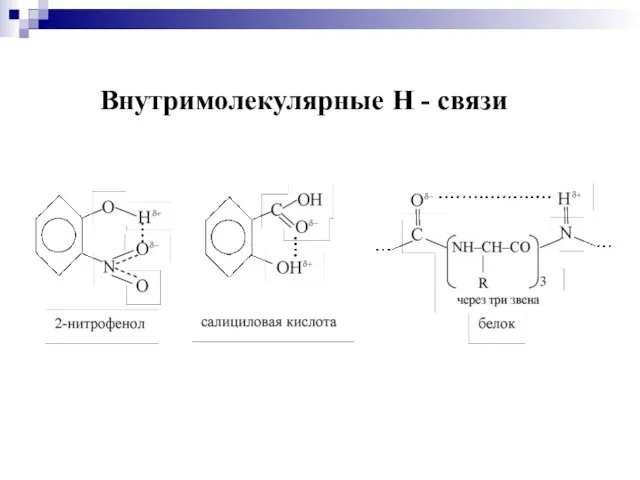
- 33. Внутримолекулярные Н - связи
- 34. Основные положения метода молекулярных орбиталей (ММО) 1. При образовании молекулы по ММО изменяют своё состояние не
- 35. 3.Для получения МО используют метод линейной комбинации атомных орбиталей МЛКАО. Из двух АО разных атомов образуется
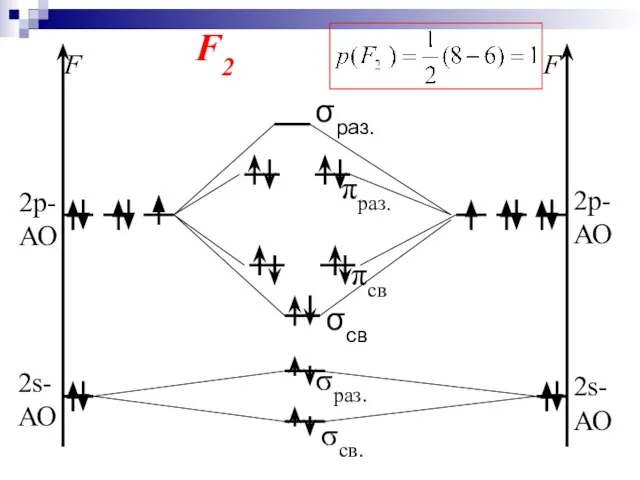
- 36. 6. Химическая связь в ММО характеризуется энергией связи и кратностью. Кратность связи (р) определяется по формуле:
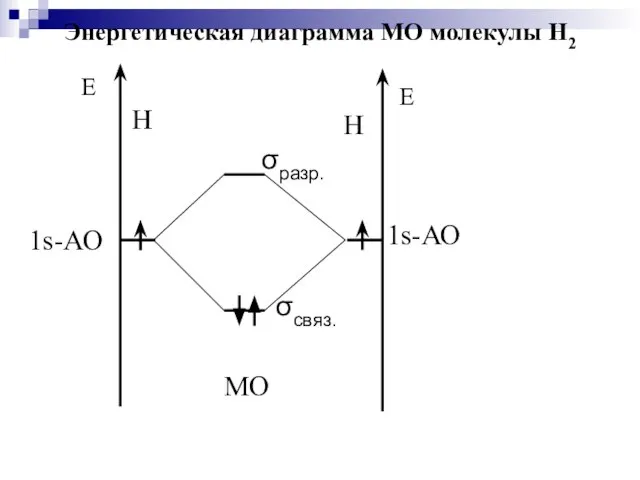
- 37. σсвяз. МО σразр. Энергетическая диаграмма МО молекулы Н2
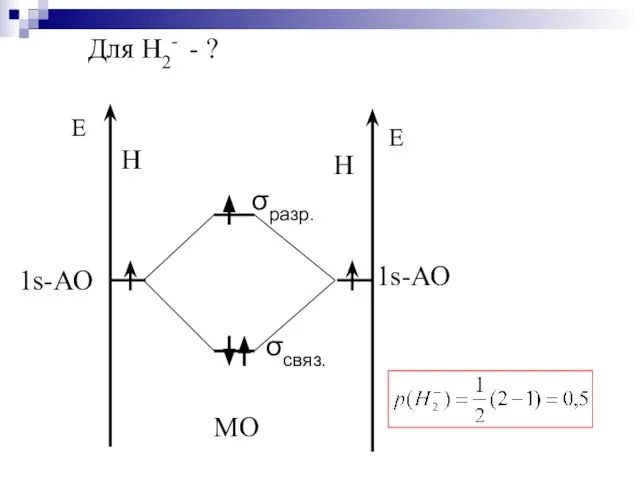
- 38. Для Н2- - ?
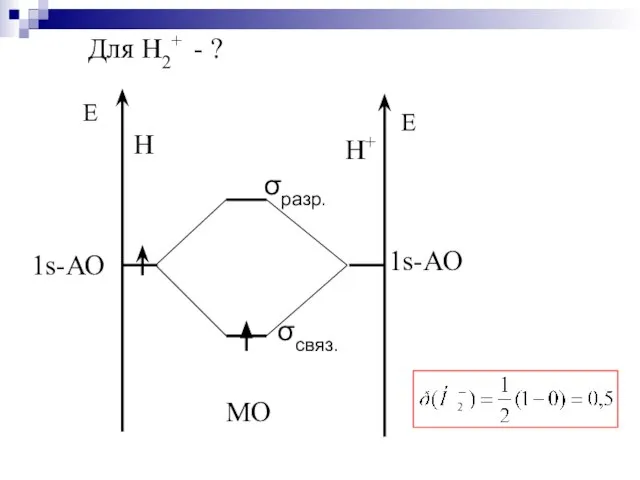
- 39. Для Н2+ - ?
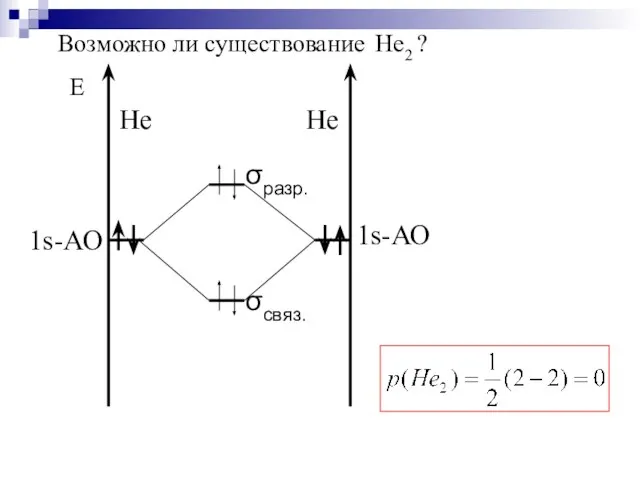
- 40. Возможно ли существование Не2 ?
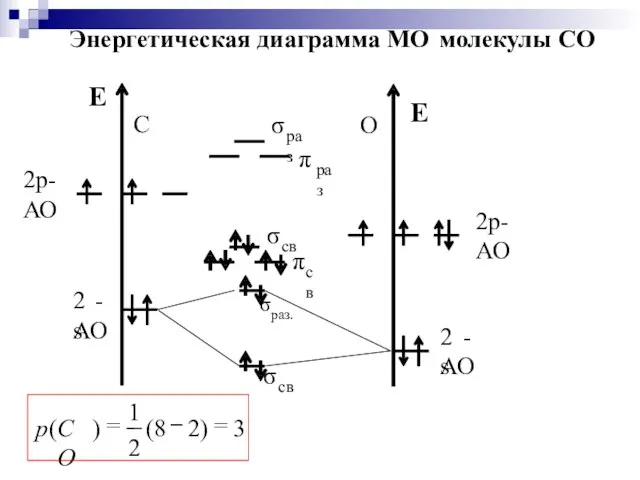
- 42. F2
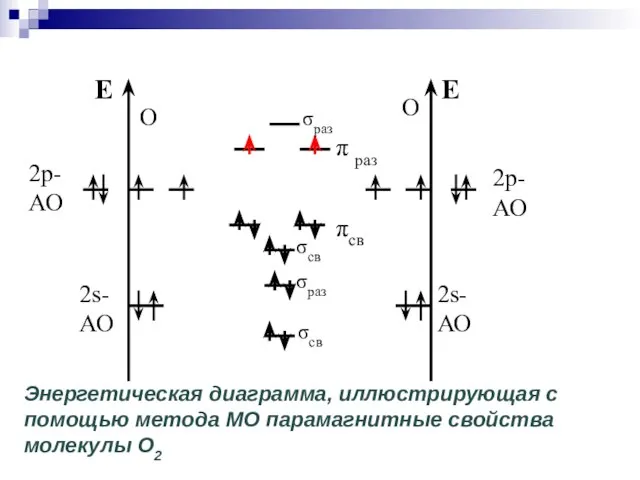
- 43. σcв σcв σраз Энергетическая диаграмма, иллюстрирующая с помощью метода МО парамагнитные свойства молекулы O2 π раз
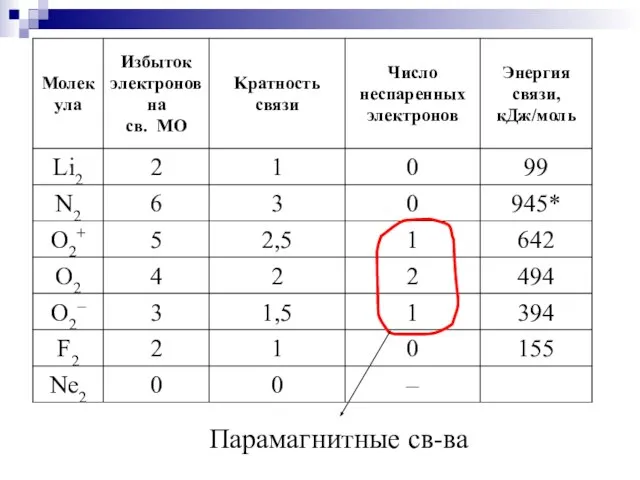
- 44. Наличие спаренных или неспаренных электронов в атомах, молекулах и кристаллах устанавливается экспериментально путем изучения магнитных свойств
- 45. Парамагнитные св-ва
- 46. Сравнительная характеристика методов: ВС и МО ВС достоинства: нагляден; описывает геометрию молекул недостатки: ∙не рассматривает вклад
- 48. Скачать презентацию






















 Самовольные постройки. Проблемы оформления незаконных построек
Самовольные постройки. Проблемы оформления незаконных построек Йоль. Символика Йоля
Йоль. Символика Йоля Вирусная реклама
Вирусная реклама Класта эш Яҙ етте
Класта эш Яҙ етте В Германии считается, что свинья приносит счастье. Как вариант подходит и свинка-копилка, которая непременно будет способствовать
В Германии считается, что свинья приносит счастье. Как вариант подходит и свинка-копилка, которая непременно будет способствовать  СГУТИКД
СГУТИКД Комплекс маркетинга: продвижение
Комплекс маркетинга: продвижение Презентация на тему Интересные факты из жизни великого учёного Д. И. Менделеева
Презентация на тему Интересные факты из жизни великого учёного Д. И. Менделеева Презентация по литературе на тему:В.Маяковский (7,13 июля 1893 - 14 апреля 1930)
Презентация по литературе на тему:В.Маяковский (7,13 июля 1893 - 14 апреля 1930) Анализ на бюджет 2011
Анализ на бюджет 2011 Presentation Title
Presentation Title  От Парижа до Сочи. Россия на Олимпийских Играх современности
От Парижа до Сочи. Россия на Олимпийских Играх современности Текстильные открытки (способы изготовления)
Текстильные открытки (способы изготовления) Общее описание подсистемы Управление строительным производством
Общее описание подсистемы Управление строительным производством Знаете ли вы правила дорожного движения?
Знаете ли вы правила дорожного движения? Страна сказок Х.К. Андерсена
Страна сказок Х.К. Андерсена Aroma Sementi
Aroma Sementi Паркеты. Правильные, полуправильные
Паркеты. Правильные, полуправильные Анатомо-физиологические особенности носа и околоносовых пазух
Анатомо-физиологические особенности носа и околоносовых пазух Времена года в изобразительном искусстве
Времена года в изобразительном искусстве Педагогический проект Роль дидактической игры в формировании учебно-познавательной компетенции младших школ
Педагогический проект Роль дидактической игры в формировании учебно-познавательной компетенции младших школ село Егоровка Болотнинский район Новосибирская область
село Егоровка Болотнинский район Новосибирская область Создание изделий из текстильных материалов Швейная машина
Создание изделий из текстильных материалов Швейная машина Дымковская игрушка. Городецкая роспись
Дымковская игрушка. Городецкая роспись Успешные люди работают с нами!. О НАС: Мы первая в Украине компания, которая предоставляет полный спектр услуг, связанных с продвиже
Успешные люди работают с нами!. О НАС: Мы первая в Украине компания, которая предоставляет полный спектр услуг, связанных с продвиже Профессия инженер
Профессия инженер Курс лекций История экономической мысли
Курс лекций История экономической мысли Все, что вы хотели знать о религии, но боялись… Ивар Максутов председатель Московского религиоведческого общества на Философском факультете МГУ Главный редактор портала Religo.Ru
Все, что вы хотели знать о религии, но боялись… Ивар Максутов председатель Московского религиоведческого общества на Философском факультете МГУ Главный редактор портала Religo.Ru