Содержание
- 2. Задачи урока: Изучить виды химической связи в теме «строение вещества», на данном уроке разобрать причины и
- 3. Этапы урока: Организационный момент: поставить цели и задачи урока. Изучение нового материала.(см. слайды) Закрепление нового материала.
- 4. Это взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. 4 типа химических связей: Ионная
- 5. Это связь, образовавшаяся за счет электростатического притяжения катионов к анионам. Главный закон химической реакции - заполнение
- 6. Натрий - Na, щелочной металл (группа IA). Электронная конфигурация: 1s22s22p63s1 Как видим, натрий имеет один валентный
- 7. Хлор - Cl, галоген (группа VIIA). Электронная конфигурация: 1s22s22p63s23p5 Как видим, хлор имеет 7 валентных электронов
- 8. почему "дружны" атомы хлора и натрия?
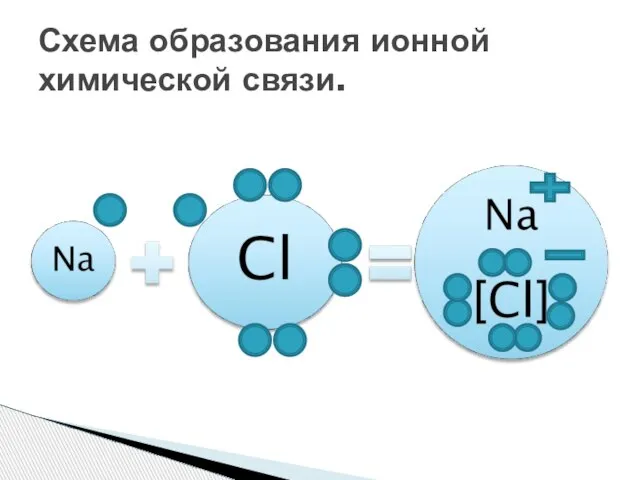
- 9. Схема образования ионной химической связи.
- 10. На внешнем энергетическом уровне атома натрия находится один электрон. Для перехода в стабильное состояние, натрий должен:
- 11. Так что же, натрий превратился в неон? Вовсе нет - не забывайте о протонах! Их по-прежнему;
- 12. Подведем итог: атом натрия и его катион отличаются одним электроном; катион натрия имеет меньший размер, поскольку
- 13. Хлор Cl У хлора ситуация прямо противоположная - на внешнем энергетическом уровне у него находится семь
- 14. Подведем итог: атом хлора примет один электрон и станет отрицательно заряженным анионом (17 протонов и 18
- 15. В результате перемещения электрона образуются ионы: катион натрия (Na+) и анион хлора (Cl-). Поскольку противоположные заряды
- 16. Другие соли образуются по аналогичному принципу, что и хлорид натрия. Металл отдает электроны, а неметалл их
- 17. элементы группы VIIA (галогены) принимают один электрон и образуют анион с зарядом 1-; элементы группы VIA
- 18. Li+ Катион лития Na+ Катион натрия K+ Катион калия Be2+ Катион бериллия Mg2+ Катион магния Ca2+
- 19. F- Анион фтора Cl- Анион хлора Br- Анион брома I- Анион йода O2- Анион кислорода S2-
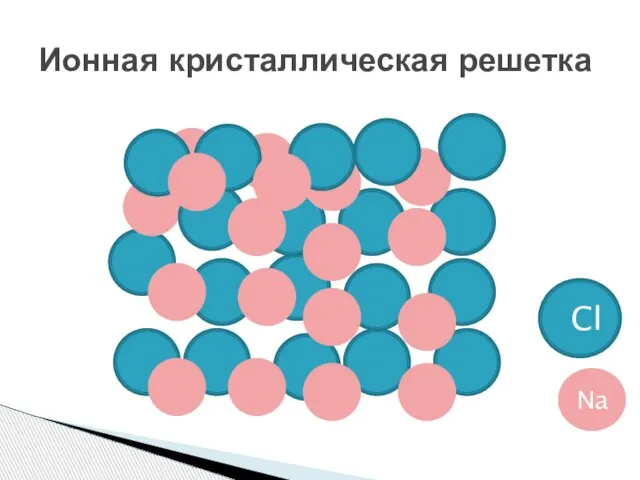
- 20. Ионная кристаллическая решетка Cl Na
- 21. Ионная кристаллическая решетка В кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл
- 22. Ионная кристаллическая решетка Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга
- 23. Ионная кристаллическая решетка Кальцит CaCO3 Галенит PbS Галит NaCl
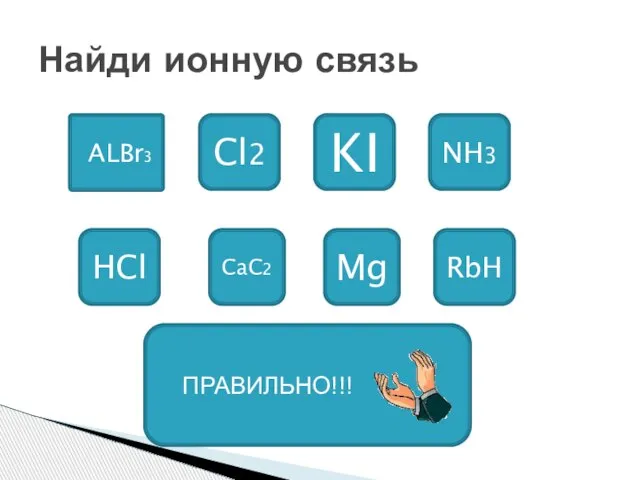
- 24. Найди ионную связь ALBr3 Cl2 KI NH3 HCl CaC2 Mg RbH ПРАВИЛЬНО!!!
- 25. Спасибо за внимание! Презентацию подготовила и провела учитель химии Бойкова А.А.
- 27. Скачать презентацию





















 Центр образования,исследований и разработок «ИНО Томск’2020»
Центр образования,исследований и разработок «ИНО Томск’2020» London's architectural ensembles of the XI-XX centuries as the fixed music
London's architectural ensembles of the XI-XX centuries as the fixed music На зарядку становись!
На зарядку становись! Планы на счастье. Ведущая тренинга
Планы на счастье. Ведущая тренинга Культура и быт народов Северного Кавказа
Культура и быт народов Северного Кавказа Как слово наше отзовется
Как слово наше отзовется ПРИРОДНЫЕ ГЕПАТОПРОТЕКТОРЫ
ПРИРОДНЫЕ ГЕПАТОПРОТЕКТОРЫ g?c суперфрукт Содержит липокаротины tm
g?c суперфрукт Содержит липокаротины tm Стекло
Стекло Историческое культурное наследие Белгородской области в 19 веке
Историческое культурное наследие Белгородской области в 19 веке Презентация на тему Строение электронных оболочек атомов
Презентация на тему Строение электронных оболочек атомов Этнокультурные особенности Германии
Этнокультурные особенности Германии Викторина. Году театра посвящается. Г. Сыктывкар
Викторина. Году театра посвящается. Г. Сыктывкар ВЕГЕТАТИВНЫЕ ОРГАНЫ РАСТЕНИЙ
ВЕГЕТАТИВНЫЕ ОРГАНЫ РАСТЕНИЙ Проверка домашнего задания
Проверка домашнего задания Межрегиональный фестиваль чувашской эстрадной песни Виръял Шевлисем, 25 летие
Межрегиональный фестиваль чувашской эстрадной песни Виръял Шевлисем, 25 летие A day in London
A day in London Приоритетный национальный проект «Образование» в нашей школе
Приоритетный национальный проект «Образование» в нашей школе ИНФОРМАЦИОННО-ТЕХНИЧЕСКОЕ УСТРОЙСТВО – СИСТЕМА МОВС-1-АФИ ГНУ АФИ РОССЕЛЬХОЗАКАДЕМИИ Система МОВС-1-АФИ – малогабаритная оптимиз
ИНФОРМАЦИОННО-ТЕХНИЧЕСКОЕ УСТРОЙСТВО – СИСТЕМА МОВС-1-АФИ ГНУ АФИ РОССЕЛЬХОЗАКАДЕМИИ Система МОВС-1-АФИ – малогабаритная оптимиз Використання МОБІЛЬНИХ ЗАСТОСУНКІВ ДЛЯ РЕЄСТРАЦІЇ ПОКАЗНИКІВ ФІЗИЧНОГО СТАНУ Кардаш
Використання МОБІЛЬНИХ ЗАСТОСУНКІВ ДЛЯ РЕЄСТРАЦІЇ ПОКАЗНИКІВ ФІЗИЧНОГО СТАНУ Кардаш Умножение и деление чисел (2 класс)
Умножение и деление чисел (2 класс) Курс семинаров. Интернет-маркетинг. Старт
Курс семинаров. Интернет-маркетинг. Старт Всемирный фестиваль молодёжи и студентов 2017
Всемирный фестиваль молодёжи и студентов 2017 пороки разв уха детей
пороки разв уха детей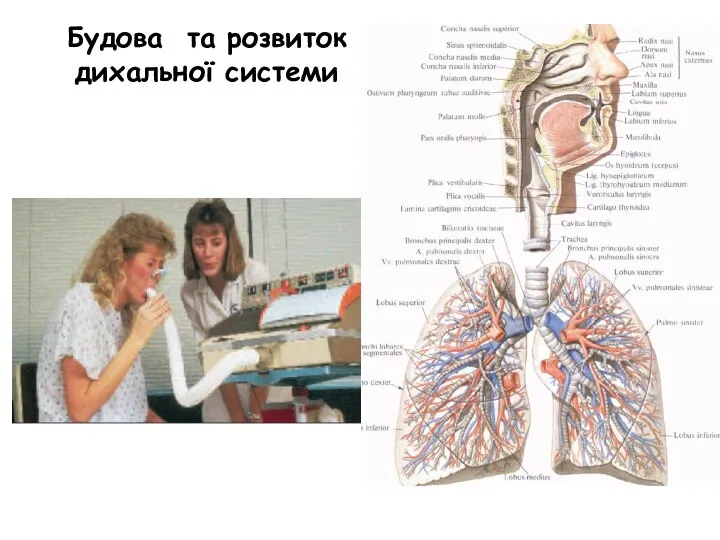 № 1-2-2 Будова та розвиток дихальної системи
№ 1-2-2 Будова та розвиток дихальної системи Общаться с ребенком. Как?
Общаться с ребенком. Как? Трансформация природной формы в дизайн-форму
Трансформация природной формы в дизайн-форму Моё хобби - ГЕОГРАФИЯ
Моё хобби - ГЕОГРАФИЯ