Содержание
- 2. Основные понятия Химическая термодинамика рассматривает энергетические аспекты различных процессов и определяет условия их самопроизвольного протекания.
- 3. Системой называют отдельное тело или группу тел, фактически или мысленно отделенных от окружающей среды. Окружающая среда
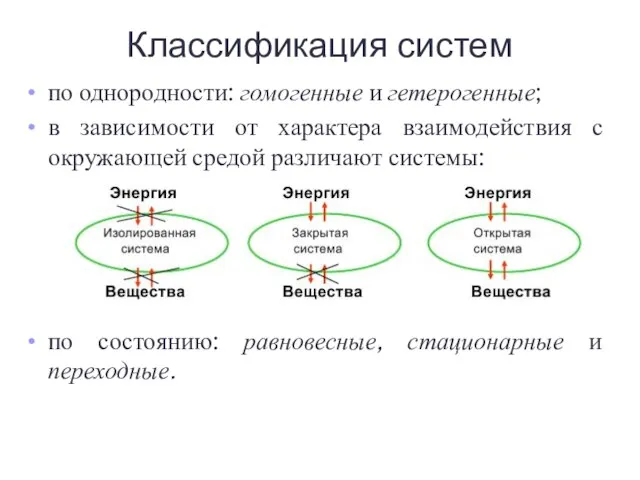
- 4. по однородности: гомогенные и гетерогенные; в зависимости от характера взаимодействия с окружающей средой различают системы: по
- 5. Т/д равновесное состояние характеризуется постоянством всех свойств во времени и отсутствием потока вещества и энергии в
- 6. Совокупность всех физических и химических свойств системы называют состоянием системы. Его характеризуют термодинамическими параметрами, которые бывают:
- 7. Термодинамические процессы Если в системе в течение некоторого времени изменяется хотя бы один из термодинамических параметров,
- 8. Внутренняя энергия Внутренняя энергия (U) характеризует общий запас энергии системы. Она включает все виды энергии движения
- 9. Теплота и работа Теплота (Q) - неупорядоченный (хаотический) вид передачи энергии. Работа (W) - упорядоченный (организованный)
- 10. Первое начало термодинамики
- 11. Формулировки 1.Энергия не исчезает бесследно и не возникает из ничего, переход ее из одного вида в
- 12. Математический вид: Q=ΔU + W= ΔU + pΔV, Количество теплоты, подведенное к системе, идет на изменение
- 13. Первый закон термодинамики в применении к некоторым процессам 1. Изотермические процессы. Т = const. Q=ΔU +
- 14. Закон Гесса
- 15. Следствия из закона Гесса. 1. ΔНr 298 =∑νiΔ H0f 298(прод) -∑ νiΔH0f 298(исх) Стандартной энтальпией образования
- 16. 2. ΔНr 298 =∑νiΔ H0f 298(исх) -∑νi ΔH0f 298(прод) Стандартной энтальпией сгорания называют изменение энтальпии в
- 17. Второе начало термодинамики
- 18. I закон термодинамики дает данные лишь о тепловыделении и говорит о превращении одной формы энергии в
- 19. Новая функция состояния: энтропия (S, Дж/моль·К) – мера беспорядка системы. Является критерием направленности процессов в изолированной
- 20. Термодинамические потенциалы являются критерием направленности процессов в открытой и закрытой системах: энергия Гиббса (ΔGT,P энергия Гельмгольца
- 21. Биохимические реакции, сопровождающиеся уменьшением энергии Гиббса, называются экзэргоническими реакциями. Биохимические реакции, сопровождающиеся увеличением энергии Гиббса, называются
- 22. Кинетика и катализ
- 23. Химическая кинетика изучает скорость и механизм химических реакций и зависимость их от различных факторов.
- 24. Основные понятия химической кинетики. Скорость химической реакции – изменение количества вещества в единицу времени в единице
- 25. Закон действующих масс для скоростей Скорость химической реакции пропорциональна произведению концентраций всех реагентов в соответствующих степенях:
- 26. Молекулярность реакции определяется числом молекул (частиц), участвующих в элементарном акте реакции. По молекулярности различают реакции: Одномолекулярные:
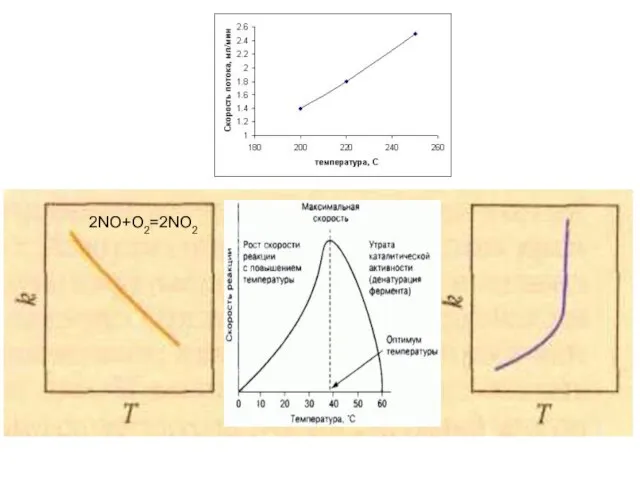
- 27. Зависимость скорости реакции от температуры
- 28. 2NO+О2=2NO2
- 29. Правило Вант – Гоффа: При обычных температурах (Т где γ = 2 ÷ 4 (температурный коэффициент).
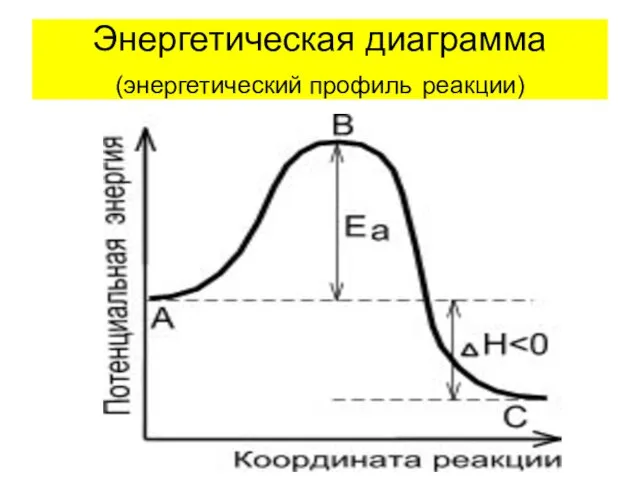
- 30. Энергетическая диаграмма (энергетический профиль реакции)
- 31. Энергия активации Еак – величина, показывающая тот необходимый избыток энергии выше средней, которым должны обладать молекулы,
- 33. Катализ
- 34. Катализ бывает: Положительный и отрицательный, (когда скорость реакции уменьшается, в таком случае катализатор называют ингибитором). Гетерогенный
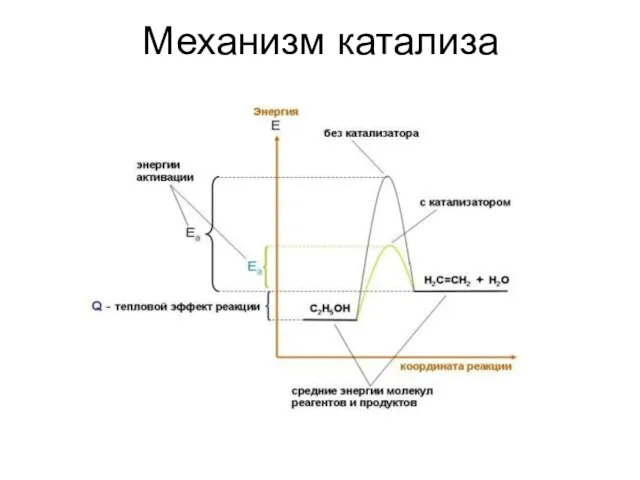
- 35. Механизм катализа
- 36. Ферментативный катализ Катализ биохимических процессов (пищеварение, брожение спиртов, биологическое окисление). Ферменты – это белковые молекулы, которые
- 37. Специфические свойства ферментов Размер. Относительная молекулярная масса ферментов составляет от 105 до 107, поэтому ферменты выделяют
- 38. Высокая специфичность. Под специфичностью фермента понимается его свойство изменять скорость реакций одного типа и не влиять
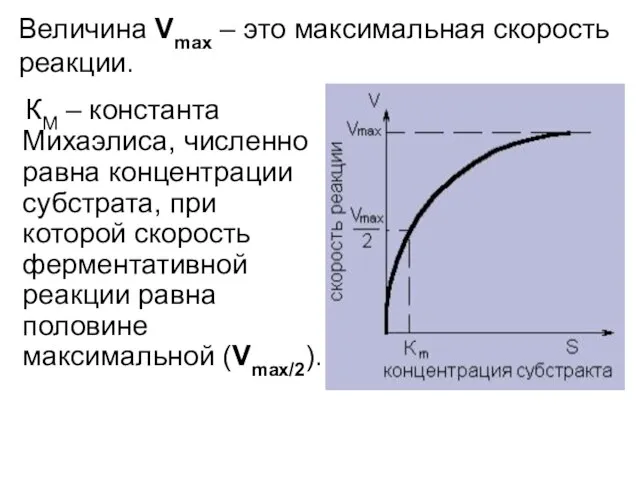
- 39. Кинетика ферментативного катализа описывается уравнением: Уравнение Михаэлиса – Ментен.
- 40. КМ – константа Михаэлиса, численно равна концентрации субстрата, при которой скорость ферментативной реакции равна половине максимальной
- 42. Скачать презентацию


































 Владимир Владимир Маяковский
Владимир Владимир Маяковский  Кукольный спектакль Зайкина тётя
Кукольный спектакль Зайкина тётя Презентация на тему Язык HTML
Презентация на тему Язык HTML Культура во второй половине XX-начале XXI века.
Культура во второй половине XX-начале XXI века. Сделай свое лето со 2 июня по 3 августа 2019 года включительно (период действия каталогов №№8–10 2019 года)
Сделай свое лето со 2 июня по 3 августа 2019 года включительно (период действия каталогов №№8–10 2019 года) Презентация на тему: Информация, как основная сущность теории информации
Презентация на тему: Информация, как основная сущность теории информации Тип губки
Тип губки использование религиозных символов в коммерческой рекламе
использование религиозных символов в коммерческой рекламе Prezentatsia1
Prezentatsia1 A real professional. What does it mean?
A real professional. What does it mean? Santa Claus
Santa Claus Внутренняя политика России в начале XXI века – восстановление государства
Внутренняя политика России в начале XXI века – восстановление государства Общественная жизнь России при Николае I
Общественная жизнь России при Николае I Le frasi ridicole
Le frasi ridicole Предложения по подготовке специалистовдля реализации проектов по коммерциализации товаров и услуг ГНСС «ГЛОНАСС»
Предложения по подготовке специалистовдля реализации проектов по коммерциализации товаров и услуг ГНСС «ГЛОНАСС» Создание культурной среды при обучении младших школьников иностранному языку
Создание культурной среды при обучении младших школьников иностранному языку Технические кодексы установившейся практики в области охраны окружающей среды и природопользования
Технические кодексы установившейся практики в области охраны окружающей среды и природопользования Одуванчик
Одуванчик Введение в теорию производства
Введение в теорию производства "ПО ДОРОГАМ ГРАЖДАНСКОЙ ВОЙНЫ"
"ПО ДОРОГАМ ГРАЖДАНСКОЙ ВОЙНЫ" Как фотографировать высокое сооружение
Как фотографировать высокое сооружение Презентация на тему Роль права в жизни государства
Презентация на тему Роль права в жизни государства Презентация на тему Деревья леса
Презентация на тему Деревья леса l_sapr_1-7
l_sapr_1-7 Эффективные способы использования заемных средств, способствующие развитию бизнеса.
Эффективные способы использования заемных средств, способствующие развитию бизнеса. Алиса в стране чудес
Алиса в стране чудес Добровольцы мы (3 раза) В армии Христа. Смело мы идем за своим Вождем, С Ним мы победим врага.
Добровольцы мы (3 раза) В армии Христа. Смело мы идем за своим Вождем, С Ним мы победим врага. Особенности проведенияЕГЭв штатном режиме
Особенности проведенияЕГЭв штатном режиме