Содержание
- 2. СПИСОК ЛИТЕРАТУРЫ: Бухаркина Т.В., Дигуров Н.Г. Химия природных энергоносителей и углеродных материалов. – М.: РХТУ, 1999
- 3. ВВЕДЕНИЕ Химия природных энергоносителей и углеродных материалов рассматривает сырьевые материалы – природные энергоносители (горючие ископаемые ГИ):
- 4. ВВЕДЕНИЕ В первом приближении фазовое состояние ГИ может быть сопоставлено с соотношением Н/С максимум водорода содержат
- 5. ОСНОВНЫЕ РАЗДЕЛЫ КУРСА: Физические и химические свойства углерода Термодинамика и основные стадии процессов термической деструкции Твердые
- 6. УГЛЕРОД. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ УГЛЕРОДА Аллотропия – способность атомов одного и того же элемента существовать в виде
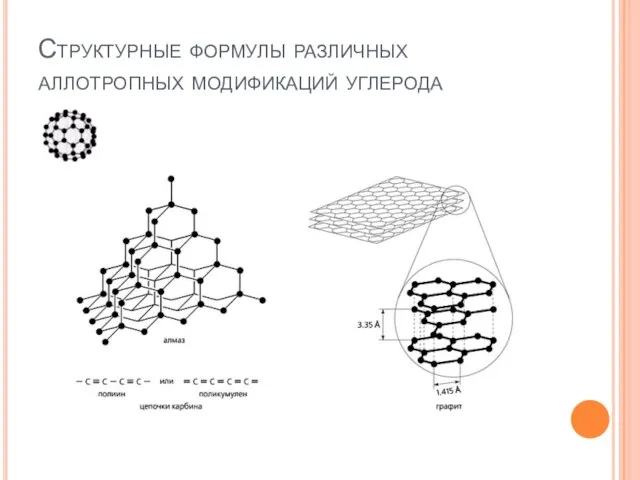
- 7. Структурные формулы различных аллотропных модификаций углерода
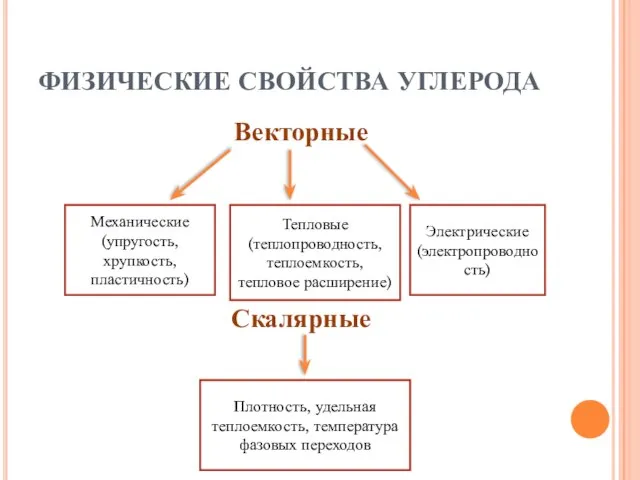
- 8. ФИЗИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА Векторные Скалярные Механические (упругость, хрупкость, пластичность) Тепловые (теплопроводность, теплоемкость, тепловое расширение) Электрические (электропроводность)
- 9. ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА При низких температурах углеродные материалы достаточно инертны ко многим реагентам, однако при высоких
- 10. СЛОИСТЫЕ СОЕДИНЕНИЯ Непроводящие: Получают при обработке графита смесью HNO3 и H2SO4, дымящей H2SO4 или др. сильными
- 11. ТЕРМОДИНАМИКА ПРОЦЕССОВ ТЕРМИЧЕСКОЙ ДЕСТРУКЦИИ Термодинамическая вероятность протекания хим. реакции определяется величиной изменения свободной энергии Гиббса ∆G
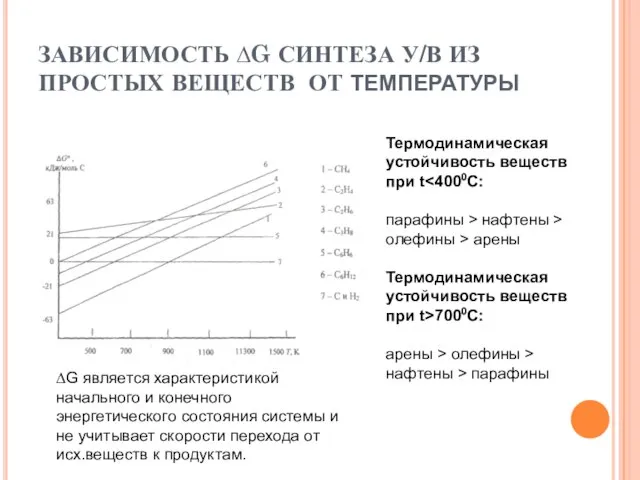
- 12. ЗАВИСИМОСТЬ ∆G СИНТЕЗА У/В ИЗ ПРОСТЫХ ВЕЩЕСТВ ОТ ТЕМПЕРАТУРЫ Термодинамическая устойчивость веществ при t парафины >
- 13. ЭНЕРГИЯ РАЗРЫВА СВЯЗЕЙ В ОРГАНИЧЕСКОМ ВЕЩЕСТВЕ Из сравнения энергий связи следует, что в первую очередь будут
- 14. СИНТЕЗ УГЛЕРОДА Материалы, состоящие из атомов углерода могут быть получены высокотемпературной обработкой углеродсодержащих веществ как в
- 15. СИНТЕЗ УГЛЕРОДА ИЗ ПЕКОВ Пеки - конденсированные ароматические и нафтеновые структуры. Стадии синтеза: Деструкция по связям
- 17. Скачать презентацию











 Примерный эскиз баннера. Kronomir
Примерный эскиз баннера. Kronomir Глава 3. Экономика фирмы
Глава 3. Экономика фирмы Гончарова Ирина Алексеевна
Гончарова Ирина Алексеевна Оценка стоимости бренда
Оценка стоимости бренда Латинская Америка
Латинская Америка Психологическая служба школы«Ни себя, нм других нельзя изучать иначе как в деятельности и общении. Нельзя изучать человека холод
Психологическая служба школы«Ни себя, нм других нельзя изучать иначе как в деятельности и общении. Нельзя изучать человека холод Необычные факты о птицах
Необычные факты о птицах Классификация и категории автомобильных дорог
Классификация и категории автомобильных дорог Этикет 4 класс
Этикет 4 класс Влияние вредных привычек на сердечно-сосудистую и дыхательную системы
Влияние вредных привычек на сердечно-сосудистую и дыхательную системы Воля. Виды и содержания волевых процессов
Воля. Виды и содержания волевых процессов Э-74 Против курения
Э-74 Против курения Агентство по ипотечному жилищному кредитованию
Агентство по ипотечному жилищному кредитованию Возрождение Руси. Иван Калита
Возрождение Руси. Иван Калита Растительные сообщества и взаимосвязи в них
Растительные сообщества и взаимосвязи в них Чтение слов и предложений с буквой Ц
Чтение слов и предложений с буквой Ц Презентация на тему Древние германцы и Римская империя
Презентация на тему Древние германцы и Римская империя  Системный анализ предметной области кандидатской диссертации
Системный анализ предметной области кандидатской диссертации School subjects
School subjects Архимедова сила (7 класс)
Архимедова сила (7 класс) Здравствуй, милая картошка!
Здравствуй, милая картошка! Три среды обитания. Наземно-воздушная среда
Три среды обитания. Наземно-воздушная среда Формованный эластичный ППУ для автомобильной промышленности
Формованный эластичный ППУ для автомобильной промышленности Расшифровка моделей Indesit
Расшифровка моделей Indesit Выполнение эскиза в точечной технике
Выполнение эскиза в точечной технике Особенности питания студентов
Особенности питания студентов Портфолио педагога
Портфолио педагога Воспитательные традиции в системе дополнительного образования
Воспитательные традиции в системе дополнительного образования