Содержание
- 2. Цель работы: Провести реакции, характеризующие общие химические свойства солей.
- 3. 1. Взаимодействие солей с щелочами Оборудование и реактивы: штатив для пробирок, пробирки (3 шт.), спиртовка, спички,
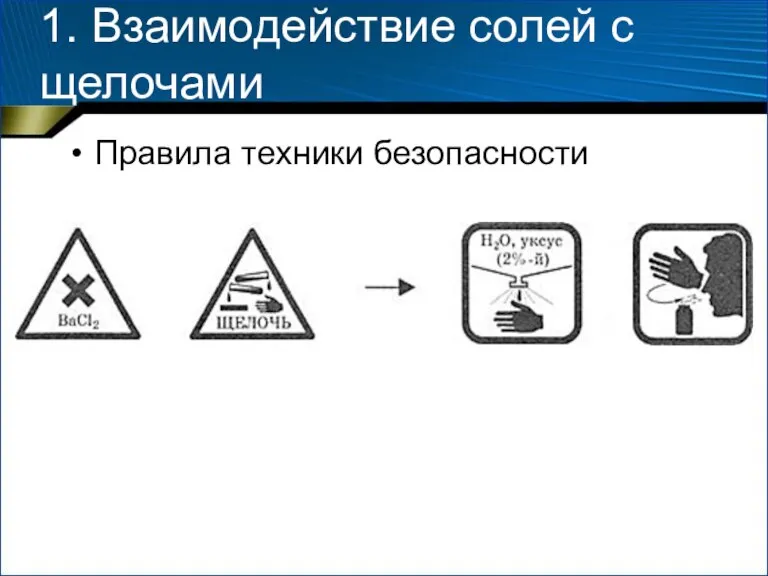
- 4. 1. Взаимодействие солей с щелочами Правила техники безопасности
- 5. 1. Взаимодействие солей с щелочами Содержание и порядок выполнения опыта 1. В трех пробирках слейте попарно
- 6. 1. Взаимодействие солей с щелочами Fe2(SO4)3 NaOH KOH (NH4)2SO4 KOH Ba(NO3)2 NaOH + Fe2(SO4)3 =Na2SO4 +Fe(OH)3
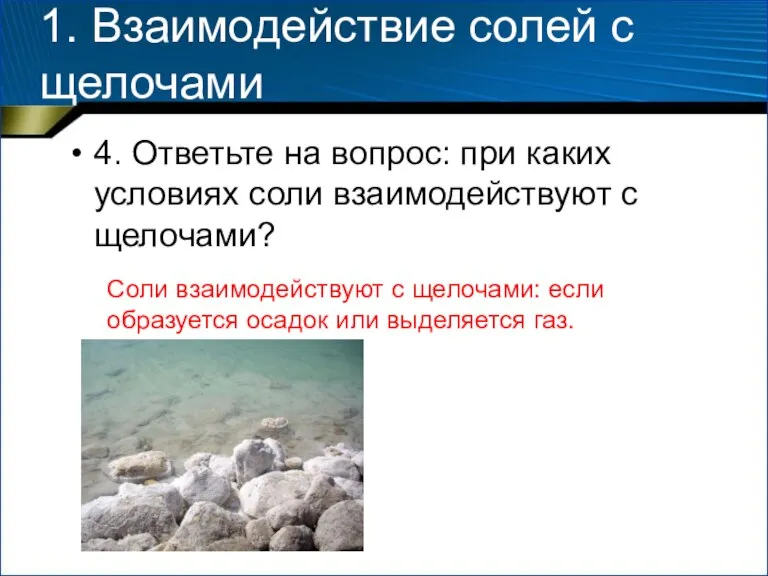
- 7. 1. Взаимодействие солей с щелочами 4. Ответьте на вопрос: при каких условиях соли взаимодействуют с щелочами?
- 8. 2. Взаимодействие солей с кислотами Оборудование и реактивы: штатив для пробирок, пробирки (3 шт.), растворы силиката
- 9. 2. Взаимодействие солей с кислотами Правила техники безопасности
- 10. 2. Взаимодействие солей с кислотами Содержание и порядок выполнения опыта 1. В трех пробирках слейте попарно
- 11. 2. Взаимодействие солей с кислотами
- 12. 2. Взаимодействие солей с кислотами 3. Ответьте на вопрос: при каких условиях соли взаимодействуют с кислотами?
- 13. 3. Взаимодействие солей с солями Оборудование и реактивы: штатив для пробирок, пробирки (2 шт.); растворы хлорида
- 14. 3. Взаимодействие солей с солями Правила техники безопасности
- 15. 3. Взаимодействие солей с солями Содержание и порядок выполнения опыта 1. Проведите качественные реакции, подтверждающие состав
- 16. 3. Взаимодействие солей с солями
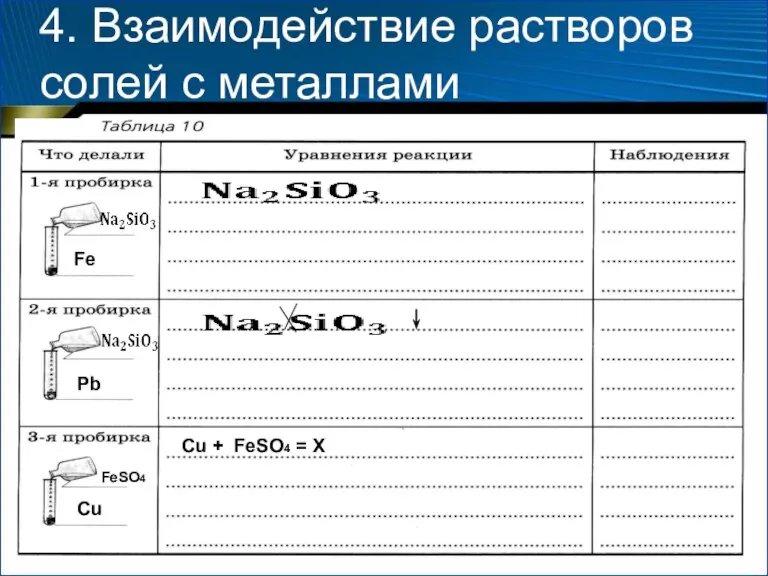
- 17. 4. Взаимодействие растворов солей с металлами Оборудование и реактивы: штатив для пробирок, пробирки (3 шт.), пинцет;
- 18. 4. Взаимодействие растворов солей с металлами Правила техники безопасности
- 19. 4. Взаимодействие растворов солей с металлами Содержание и порядок выполнения опыта 1. Возьмите три пробирки. В
- 20. 4. Взаимодействие растворов солей с металлами Fe Pb Cu FeSO4 Cu + FeSO4 = X
- 21. 4. Взаимодействие растворов солей с металлами 6. Сделайте вывод о взаимодействии растворов солей с металлами, вставив
- 22. Задание на дом: Прочитать §41, Выполнить упр. 1—5, Повторить §§ 38 – 40 , Подготовиться к
- 24. Скачать презентацию


















 Инструкция по аудиту касс арендаторов (ККТ)
Инструкция по аудиту касс арендаторов (ККТ) Колумбия (10 класс)
Колумбия (10 класс) Особенности применения специальных налоговых режимов в РФ
Особенности применения специальных налоговых режимов в РФ Выборка записей из БД по составным условиям
Выборка записей из БД по составным условиям Мозаика успеха
Мозаика успеха Skiing
Skiing Лоскутная техника
Лоскутная техника Презентация на тему Авиньонские девицы Пабло Пикассо
Презентация на тему Авиньонские девицы Пабло Пикассо  Лаборатория литературоведческих исследований филфака МаГУКафедра русской литературы ХХ века им. проф. Л.А. Заманского
Лаборатория литературоведческих исследований филфака МаГУКафедра русской литературы ХХ века им. проф. Л.А. Заманского 7 дз класс алгебра (3)
7 дз класс алгебра (3) Тематический топиарный парк НОЕВ КОВЧЕГ
Тематический топиарный парк НОЕВ КОВЧЕГ Доступно для инвалидов всех категорий
Доступно для инвалидов всех категорий Дошкольное отделение при ГОУ СОШ № 498
Дошкольное отделение при ГОУ СОШ № 498 Королю сказок посвящается
Королю сказок посвящается Сувенирные фантазии
Сувенирные фантазии Презентация на тему Исламский мир
Презентация на тему Исламский мир  Борис Заходер (1918-2000)
Борис Заходер (1918-2000) PODEKO_C05_Rozvaha_ABZ
PODEKO_C05_Rozvaha_ABZ Руководство молодому ритору
Руководство молодому ритору Что мы знаем о законе
Что мы знаем о законе Отчёт о ходе реализации приоритетного национального проекта «Образование» в г. Трехгорном по итогам 2011 года
Отчёт о ходе реализации приоритетного национального проекта «Образование» в г. Трехгорном по итогам 2011 года Проблема анализа, прогноза и алгоритма работы психолога с клиентами ГЛ
Проблема анализа, прогноза и алгоритма работы психолога с клиентами ГЛ Приложение № 4 к ВХ.3196 от 02.07.2020 09_35_35 (58638459 v1)
Приложение № 4 к ВХ.3196 от 02.07.2020 09_35_35 (58638459 v1) Прямоугольный параллелепипед. Куб (5 класс)
Прямоугольный параллелепипед. Куб (5 класс) Золотая осень
Золотая осень Gastric caner
Gastric caner Доклад
Доклад реклама на телевидении
реклама на телевидении