Содержание
- 2. Характеристика элементов I-Б группы Электронная формула этих элементов: (n-1)d9nS2 Для стабилизации наблюдается «провал» электрона и электронная
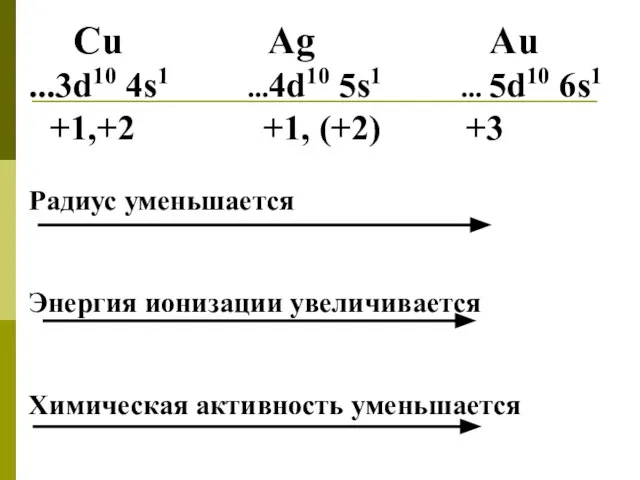
- 3. Cu Ag Au ...3d10 4s1 ...4d10 5s1 ... 5d10 6s1 +1,+2 +1, (+2) +3 Радиус уменьшается
- 4. ХИМИЧЕСКИЕ СВОЙСТВА CuCI + 2NH3 = [Cu(NH3)2]CI Au(OH)+NaOH→ Na[Au(OH)4]
- 5. Cu, Ag, Au – малоактивные металлы, стоят в ряду напряжения после водорода Cu, Ag – взаимодействуют
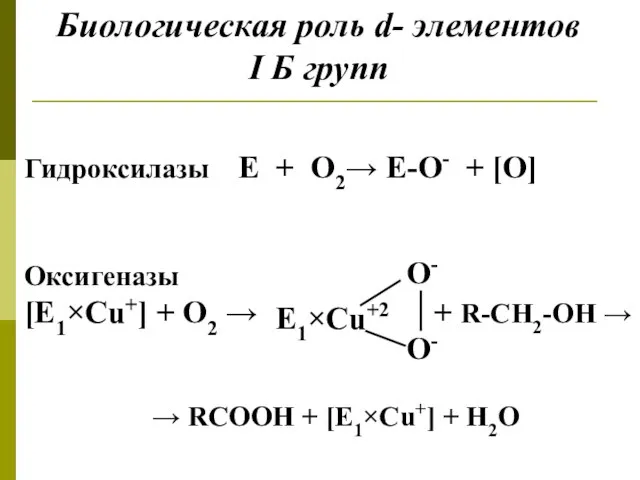
- 6. Биологическая роль d- элементов I Б групп Гидроксилазы Е + О2→ Е-О- + [O] Оксигеназы [E1×Cu+]
- 7. Биологическая роль d-элементов I-Б группы СОД (супероксиддисмутаза) [СОД×Сu2+]+ О2- → [СОД×Cu+] + O2 [СОД×Сu+]+O2- +2H+→[СОД×Сu+2] +H2O2
- 8. Биологическая роль d-элементов I-Б группы O2+4e-+4H+ Fe+2 + [ЦП×Сu+2] → Fe+3 + [ЦП×Cu+] → 2H2O ЦП
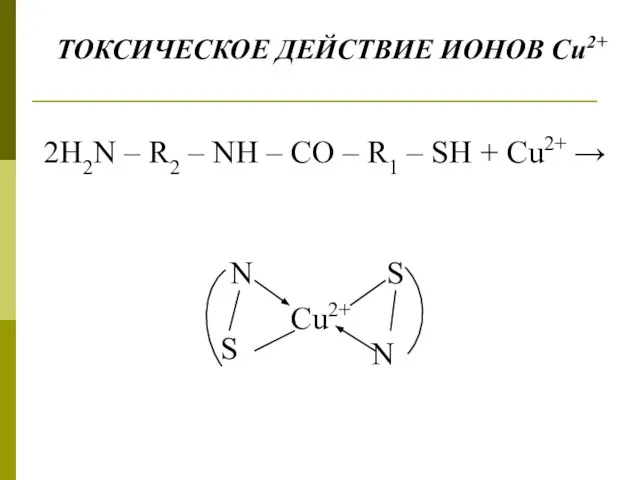
- 9. 2Н2N – R2 – NH – CO – R1 – SH + Cu2+ → ТОКСИЧЕСКОЕ ДЕЙСТВИЕ
- 10. Электронное строение элементов II-Б группы (n-1)d10 nS2
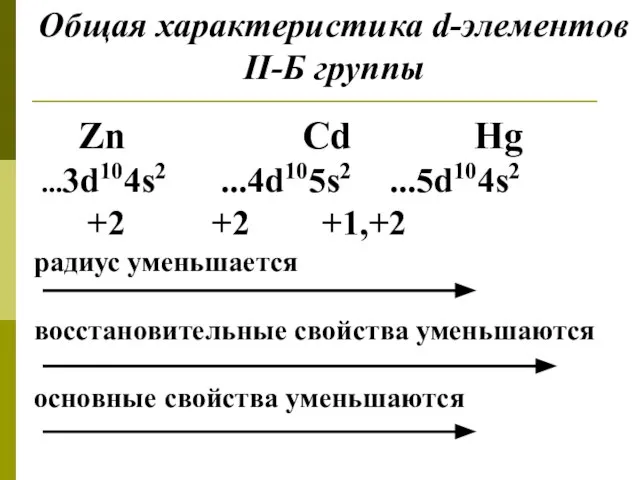
- 11. Общая характеристика d-элементов II-Б группы Zn Cd Hg ...3d104s2 ...4d105s2 ...5d104s2 +2 +2 +1,+2 радиус уменьшается
- 12. ХИМИЧЕСКИЕ СВОЙСТВА ZnO + 2HCI +3H2O = [Zn(H2O)4]CI2 ZnO + 2NaOH + H2O = Na2[Zn(OH)4] Cd(OH)2
- 13. Из солей ртути известны: Hg2Cl2 – каломель ( практически не растворима в воде) Hg+2Cl2 – сулема
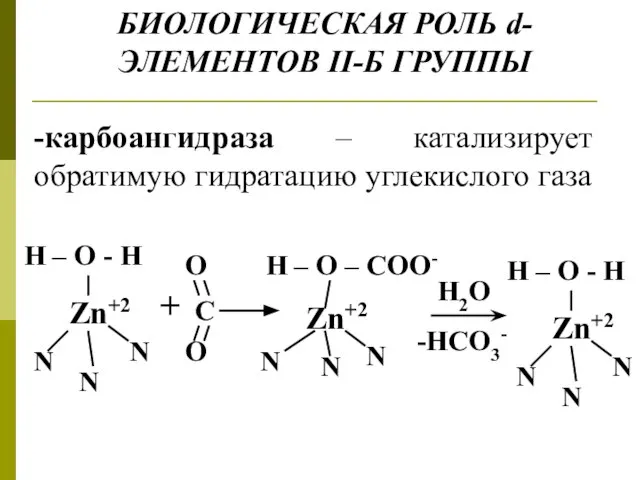
- 14. БИОЛОГИЧЕСКАЯ РОЛЬ d-ЭЛЕМЕНТОВ II-Б ГРУППЫ H2O -HCO3- -карбоангидраза – катализирует обратимую гидратацию углекислого газа
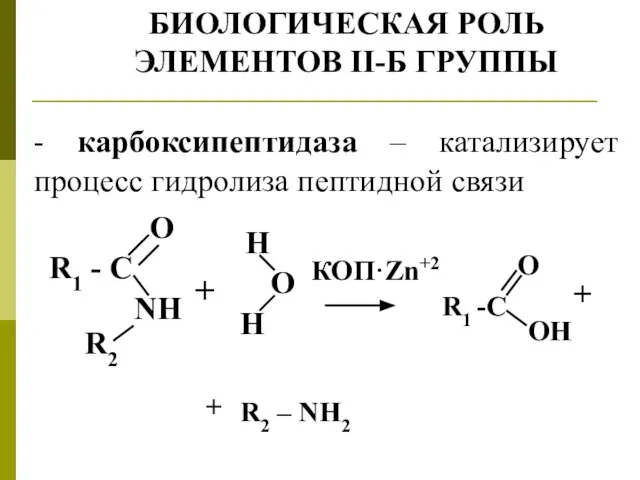
- 15. БИОЛОГИЧЕСКАЯ РОЛЬ ЭЛЕМЕНТОВ II-Б ГРУППЫ - карбоксипептидаза – катализирует процесс гидролиза пептидной связи + КОП·Zn+2 O
- 16. ОБЩАЯ ХАРАКТЕРИСТИКА d-ЭЛЕМЕНТОВ VI- Б ГРУППЫ (n – 1) danSb, где а = от 1 до
- 17. ОБЩАЯ ХАРАКТЕРИСТИКА d-ЭЛЕМЕНТОВ VI- Б ГРУППЫ Cr Mo W ̣̣̣̣̣̣̣̣̣̣̣̣̣̣ ̣̣...3d54s1 ...4d55s1 ...5d46s2 +2,+3,+6 +6 +6
- 18. Свойства соединений элементов VI-Б группы В низшей степени окисления – основные и восстановительные свойства – Cr+2O,
- 19. Свойства соединений VI –Б группы В промежуточой степени окисления –амфотерные свойства - Cr2O3 Cr(OH)3 – гидроксид
- 20. В высшей степени окисления – кислотные и окислительные свойства - CrO3 Свойства соединений VI –Б группы
- 21. БИОЛОГИЧЕСКАЯ РОЛЬ VI-Б ГРУППЫ R – COH + КОКС·Мо+6 +Н2О → →H3O ... OCR - КОКС·Мо+4
- 22. ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII –Б ГРУППЫ Mn Tc Re ...3d54s2 ...4d55s2 ...5d56s2 +2,+3,+4,+6,+7 +4,+7 Степень окисления Mn:
- 23. ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII-Б ГРУППЫ Степень окисления Mn: +4 MnO2, Mn(OH)4 H4MnO4- орто-марганцеватистая H2MnO3 – мета-марганцеватистая
- 24. ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII-Б ГРУППЫ Степень окисления : +6 MnO3 H2MnO4 –марганцовистая к-та К2MnO4- манганат калия соединения
- 25. ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII-Б ГРУППЫ Степень окисления : +7 Mn2O7 -оксид марганца (VII) HMnO4 –марганцовая к-та (соли
- 26. БИОЛОГИЧЕСКАЯ РОЛЬ МАРГАНЦА В организме находится в степени окисления Mn+2 1. Образует комплексы с нуклеиновыми кислотами
- 27. ПРИМЕНЕНИЕ СОЕДИНЕНИЙ МАРГАНЦА В МЕДИЦИНЕ KMnO4 – 5% дезинфицирующее средство, как кровоостанавливающее MnSO4 – при лечении
- 28. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VIII-Б ГРУППЫ Fe Co Ni ...3d64s2 ...3d74s2 ... 3d84s2 +2,+3,+6; +2,+3,+5; +2,+3,+4; В
- 29. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VIII-Б ГРУППЫ Степень окисления +3 Fe2O3, Co2O3, Ni2O3 Fe(OH)3 – амфотерное соединение Fe(OH)3
- 30. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VIII-Б ГРУППЫ Степень окисления : +6 FeO3 – оксид железа (VI) H2FeO4 –
- 31. Применение в медицине Железо восстановленное, при лечении анемии Ферамид [Fe(C6H5CONH2)2CI2] FeCI2 наружное –кровоостанавливающее и дезинфицирующее
- 33. Скачать презентацию

![ХИМИЧЕСКИЕ СВОЙСТВА CuCI + 2NH3 = [Cu(NH3)2]CI Au(OH)+NaOH→ Na[Au(OH)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376521/slide-3.jpg)

![Биологическая роль d-элементов I-Б группы СОД (супероксиддисмутаза) [СОД×Сu2+]+ О2- → [СОД×Cu+] + O2 [СОД×Сu+]+O2- +2H+→[СОД×Сu+2] +H2O2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376521/slide-6.jpg)
![Биологическая роль d-элементов I-Б группы O2+4e-+4H+ Fe+2 + [ЦП×Сu+2] → Fe+3 +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376521/slide-7.jpg)

![ХИМИЧЕСКИЕ СВОЙСТВА ZnO + 2HCI +3H2O = [Zn(H2O)4]CI2 ZnO + 2NaOH +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376521/slide-11.jpg)
















![Применение в медицине Железо восстановленное, при лечении анемии Ферамид [Fe(C6H5CONH2)2CI2] FeCI2 наружное –кровоостанавливающее и дезинфицирующее](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376521/slide-30.jpg)
 Магаданская область
Магаданская область Контурные судомодели
Контурные судомодели Трудности в жизни детей
Трудности в жизни детей My body
My body Еж
Еж Составление пропорций
Составление пропорций При согласии малые дела растут, при раздорах и величайшие гибнут (Гай Саллюстий).
При согласии малые дела растут, при раздорах и величайшие гибнут (Гай Саллюстий). политические режимы 2
политические режимы 2 Мемориал «Дети войны, доиграем за вас!»
Мемориал «Дети войны, доиграем за вас!» ПОВТОРИТЕЛЬНО-ОБОБЩАЮЩИЙ УРОК БИОЛОГИИВ 9 КЛАССЕПО ТЕМЕ «БИОСФЕРНЫЙ УРОВЕНЬ ЖИЗНИ»
ПОВТОРИТЕЛЬНО-ОБОБЩАЮЩИЙ УРОК БИОЛОГИИВ 9 КЛАССЕПО ТЕМЕ «БИОСФЕРНЫЙ УРОВЕНЬ ЖИЗНИ» Меценаты России
Меценаты России ОТЕЧЕСТВЕННЫЕ ТЕХНОЛОГИЧЕСКИЕ СИСТЕМЫ ДЛЯ МИКРООБРАБОТКИ: ВОЗМОЖНОСТИ ДЛЯ ИННОВАЦИОННОГО ПРОРЫВА
ОТЕЧЕСТВЕННЫЕ ТЕХНОЛОГИЧЕСКИЕ СИСТЕМЫ ДЛЯ МИКРООБРАБОТКИ: ВОЗМОЖНОСТИ ДЛЯ ИННОВАЦИОННОГО ПРОРЫВА Политическая система общества и её основные элементы
Политическая система общества и её основные элементы День знакомства
День знакомства Процессуальное право: уголовный процесс
Процессуальное право: уголовный процесс Организация международной торговли
Организация международной торговли Дослідження енергоефективного керування пасажирським ліфтом
Дослідження енергоефективного керування пасажирським ліфтом ФАКУЛЬТЕТ ПРАВО
ФАКУЛЬТЕТ ПРАВО Торф
Торф Особенности демонстрационного вариантапо математике на 2007 год и рекомендации по подготовке учащихся к ЕГЭ.
Особенности демонстрационного вариантапо математике на 2007 год и рекомендации по подготовке учащихся к ЕГЭ. Современный Дед Мороз
Современный Дед Мороз Покрытосеменные растения (6 класс)
Покрытосеменные растения (6 класс) Beruflicher Hautschutz
Beruflicher Hautschutz Стили речи. Введение в стилистику
Стили речи. Введение в стилистику Дмитрий Иванович Менделеев - ученый с мировым именем
Дмитрий Иванович Менделеев - ученый с мировым именем Облик земного шара
Облик земного шара Разработка маршрута обработки детали (МОД)
Разработка маршрута обработки детали (МОД) МГЛУ - площадка для международной коммуникации
МГЛУ - площадка для международной коммуникации