Содержание
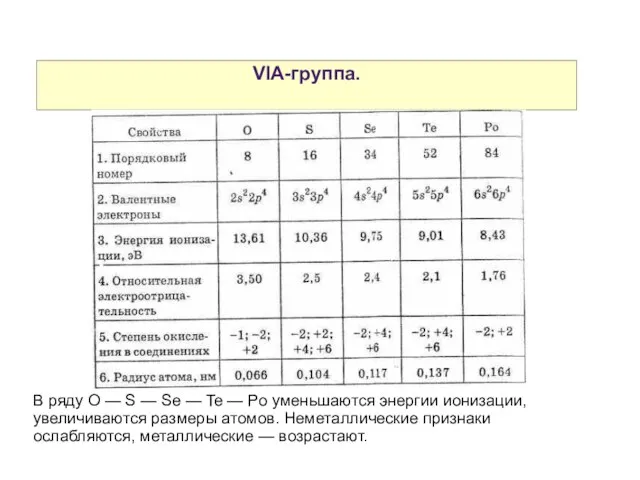
- 2. VIA-группа. В ряду O — S — Se — Te — Po уменьшаются энергии ионизации, увеличиваются
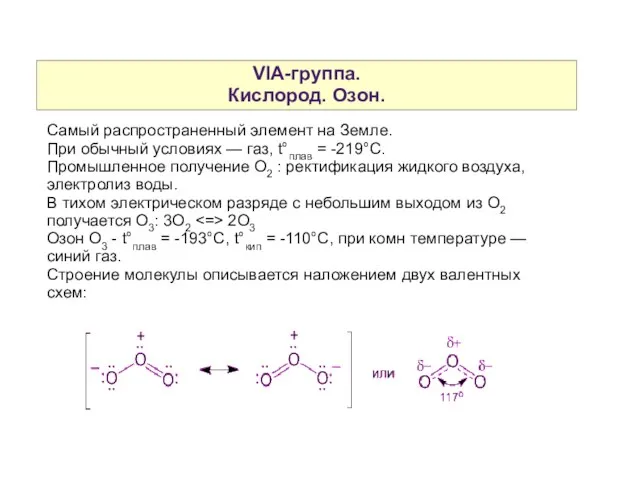
- 3. VIA-группа. Кислород. Озон. Самый распространенный элемент на Земле. При обычный условиях — газ, t°плав = -219°С.
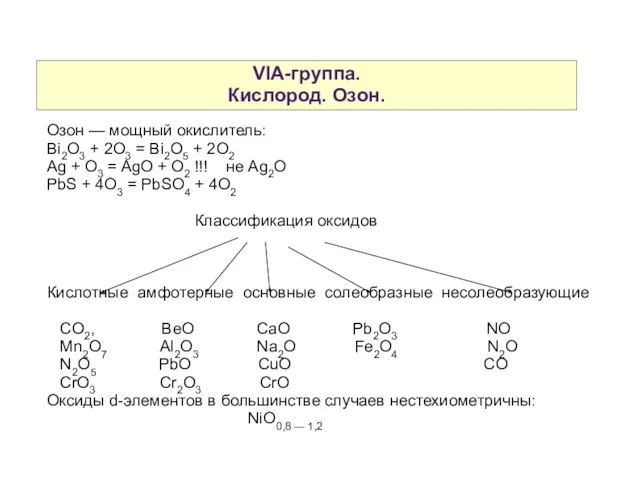
- 4. VIA-группа. Кислород. Озон. Озон — мощный окислитель: Bi2O3 + 2O3 = Bi2O5 + 2O2 Ag +
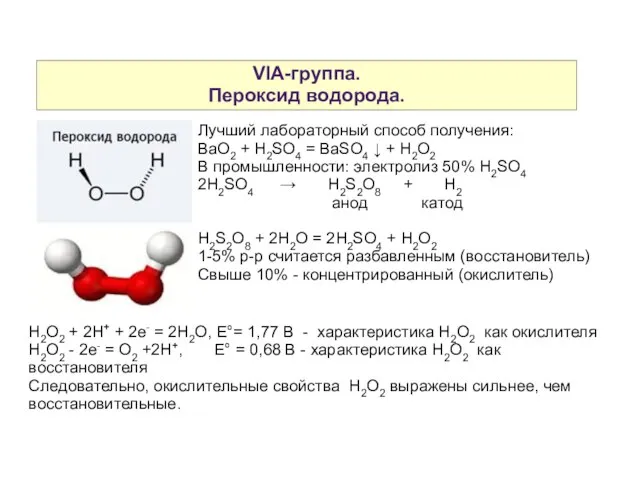
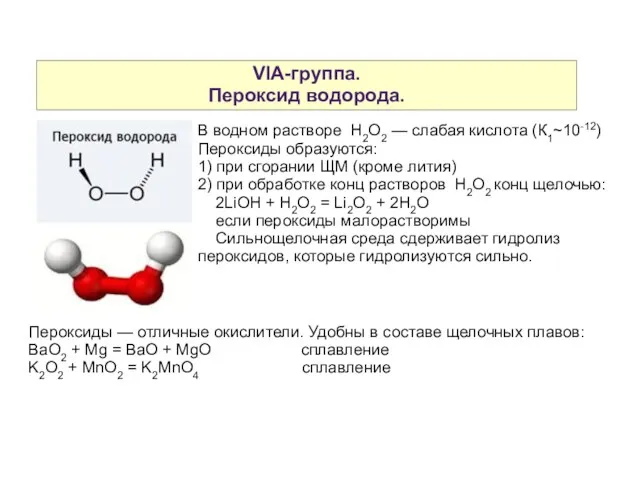
- 5. VIA-группа. Пероксид водорода. Лучший лабораторный способ получения: BaO2 + H2SO4 = BaSO4 ↓ + H2O2 В
- 6. VIA-группа. Пероксид водорода. В водном растворе H2O2 — слабая кислота (К1~10-12) Пероксиды образуются: 1) при сгорании
- 7. VIA-группа. Сера. Содержание в природе. Самородная сера Сульфиды: пирит FeS2 цинковая обманка ZnS (сфалерит) Сульфаты: Глауберова
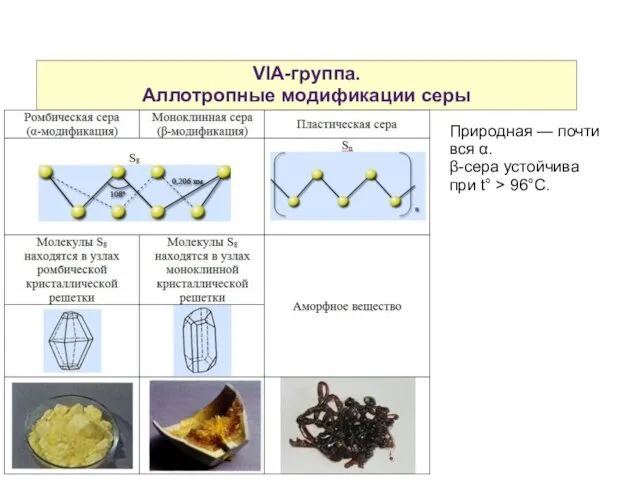
- 8. VIA-группа. Аллотропные модификации серы Природная — почти вся α. β-сера устойчива при t° > 96°C.
- 9. VIA-группа. Сера. Химические свойства. Валентность: II, IV, VI. Степени окисления: -2, (+2), +4, +6. Все Нерастворима
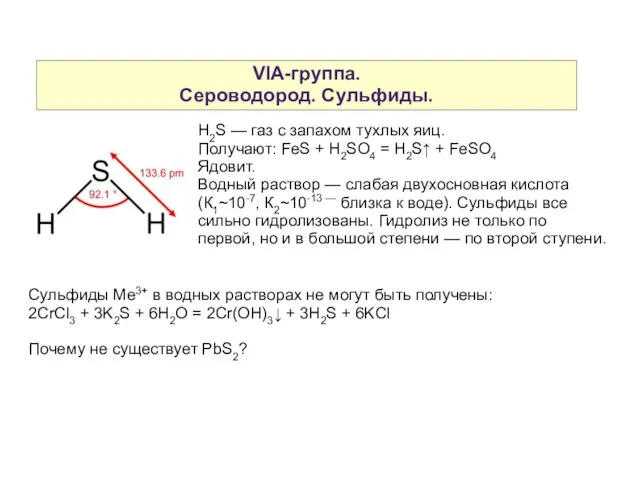
- 10. VIA-группа. Сероводород. Сульфиды. H2S — газ с запахом тухлых яиц. Получают: FeS + H2SO4 = H2S↑
- 11. VIA-группа. Сероводород. Сульфиды. H2S и сульфиды — исключительные восстановители. Окисляются, как правило, до S0. 5H2S +
- 12. VIA-группа. Сероводород. Сульфиды. Классификация сульфидов Растворимые растворимые нерастворимые в воде в минеральных в минеральных K2S кислотах
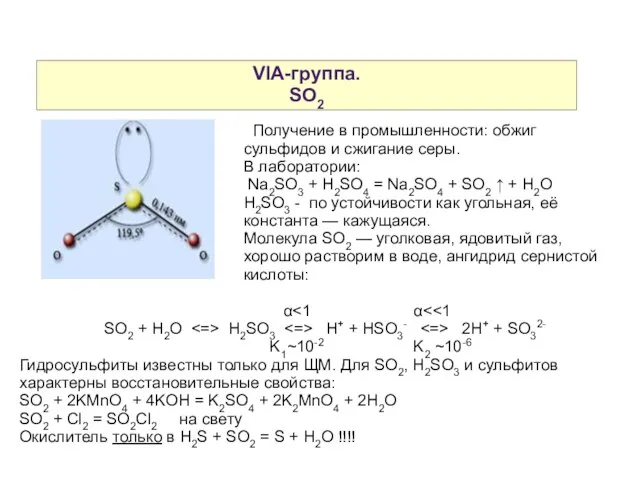
- 13. VIA-группа. SO2 Получение в промышленности: обжиг сульфидов и сжигание серы. В лаборатории: Na2SO3 + H2SO4 =
- 14. VIA-группа. SO2 При хранении сульфиты легко окисляются кислородом воздуха и портятся. Сульфиты и гидросульфиты при нагревании
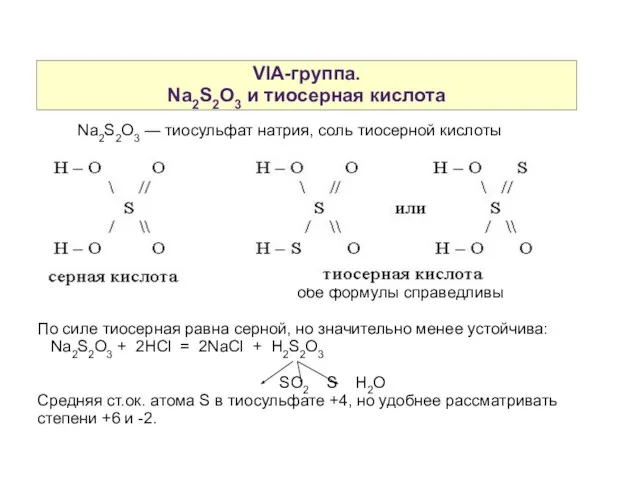
- 15. VIA-группа. Na2S2O3 и тиосерная кислота Na2S2O3 — тиосульфат натрия, соль тиосерной кислоты обе формулы справедливы По
- 16. VIA-группа. Na2S2O3 и тиосерная кислота При недостатке окислителя S2- окисляется до S0, а при избытке —
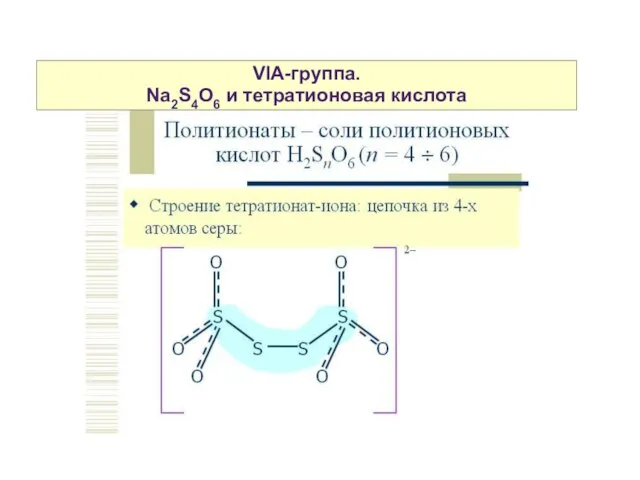
- 17. VIA-группа. Na2S4O6 и тетратионовая кислота
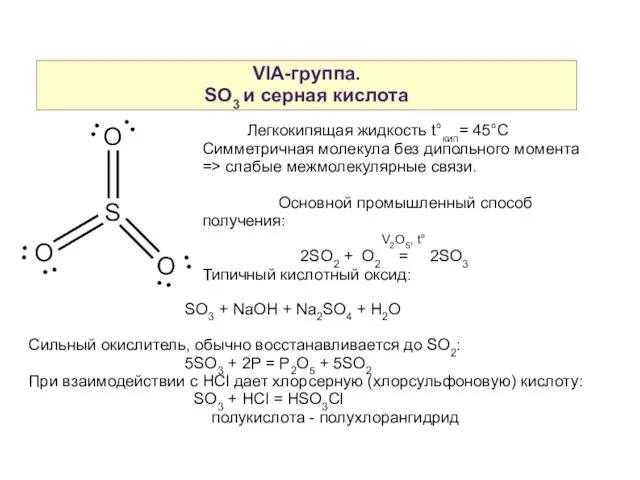
- 18. VIA-группа. SO3 и серная кислота Легкокипящая жидкость t°кип= 45°С Симметричная молекула без дипольного момента => слабые
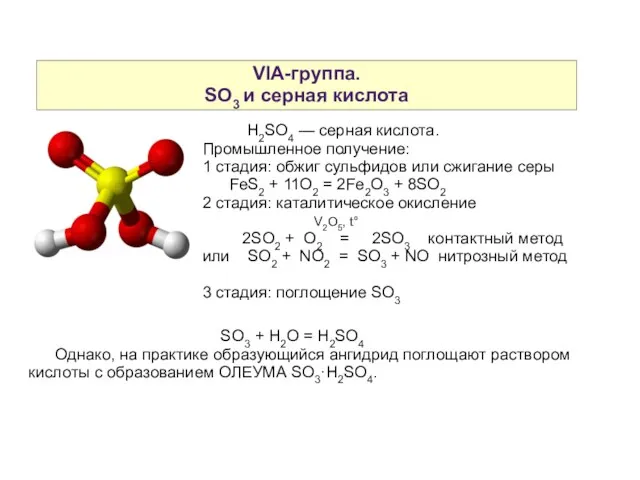
- 19. VIA-группа. SO3 и серная кислота H2SO4 — серная кислота. Промышленное получение: 1 стадия: обжиг сульфидов или
- 20. VIA-группа. SO3 и серная кислота
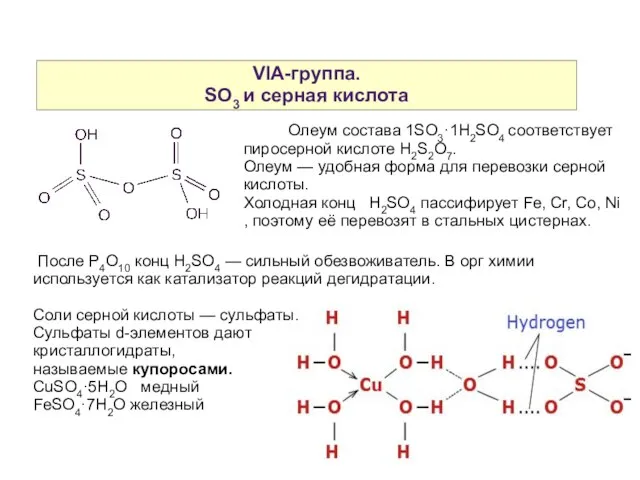
- 21. VIA-группа. SO3 и серная кислота Олеум состава 1SO3·1H2SO4 соответствует пиросерной кислоте H2S2O7. Олеум — удобная форма
- 22. VIA-группа. Селен теллур полоний Основной источник — шламы электролизеров, в которых чистят медь и никель. Примеси
- 23. VIA-группа. Селен, теллур, полоний: химические свойства. Тенденция проявляется своеобразно: Se и Те стремятся перейти не просто
- 24. VIA-группа. Селен, теллур, полоний: химические свойства. H2S H2Se H2Te Рост силы кислот в водном растворе Рост
- 25. VIA-группа. Селен, теллур, полоний: химические свойства. H2SeO4 (селеновая), H6TeО6 (Те(ОН)6 или формально Н2ТеО4 — теллуровая H2SeO4
- 26. VIA-группа. Галогены В природе входят в состав очень многих минералов: Каменная соль Карналлит Плавиковый шпат, флюорит
- 27. VIA-группа. Галогены. Получение. Химические свойства. F2: электролиз расплава KHF2 Cl2: электролиз расплавов и растворов хлоридов ЩМ
- 28. VIA-группа. Галогены. Получение. Химические свойства. F2: при tкомн реагирует со всеми простыми веществами, кроме O2, N2
- 29. VIA-группа. Галогены. Получение. Химические свойства. Равновесие в щелочном растворе сдвигается вправо за счет нейтрализации кислот: Г2
- 30. VIA-группа. Галогены. Соединения. HF и HCl получают: фторид/хлорид + H2SO4(конц, t°) Получение HBr и HI таким
- 31. VIA-группа. Галогенводороды. HF HCl HBr HI 1) снижается термодинамическая устойчивость 2) уменьшается термическая устойчивость 3) возрастает
- 32. VIA-группа. Кислородные кислоты галогенов Галоген в степени окисления +1: галогеноватистые, соли — гипогалогениты. Кислоты малостабильны, известны
- 33. VIA-группа. Кислородные кислоты галогенов Соли — гипогалогениты — более стабильны. В нейтральных растворах не проявляют окислительных
- 34. VIA-группа. Кислородные кислоты галогенов HOCl HOBr HOI Сила кислот уменьшается Окислительная активность уменьшается Образование HOI термодинамически
- 35. VIA-группа. Кислородные кислоты галогенов Галогены в степени окисления +5: галогеноватые кислоты, соли — галогенаты. Известны все
- 36. VIA-группа. Кислородные кислоты галогенов Иодноватые кислоты могут содержать разные количества воды и находится в форме: +H2O
- 37. VIA-группа. Кислородные кислоты галогенов Галогены в степени окисления +7: галогенные кислоты, соли — пергалогенаты. Известны все
- 38. VIA-группа. Бинарные соединения галогенов Правило: вышестоящий галоген вытесняет нижестоящий из бинарных соединений. А в кислородсодержащих будет
- 40. Скачать презентацию
























 Характеристика історичної особи. Сандро Боттічелі
Характеристика історичної особи. Сандро Боттічелі OBZh_9A
OBZh_9A ТРАНСПОРТНАЯ ЛОГИСТИКА
ТРАНСПОРТНАЯ ЛОГИСТИКА  Современный русский язык и культура речи: практический курс
Современный русский язык и культура речи: практический курс ПРАВА ЧЕЛОВЕКА
ПРАВА ЧЕЛОВЕКА Основы теории всеобщего управления качеством (tqm) Принципы tqm
Основы теории всеобщего управления качеством (tqm) Принципы tqm Тема урока: Социальный проект
Тема урока: Социальный проект Интересные факты компании Paulig
Интересные факты компании Paulig Все различны – все равны
Все различны – все равны ОБЩЕСТВЕННЫЙ ПРОГРЕСС
ОБЩЕСТВЕННЫЙ ПРОГРЕСС Оскорбления в сети
Оскорбления в сети Social Ecology Sustainable Development Lecture III Sustainable
Social Ecology Sustainable Development Lecture III Sustainable Игра «Крестики - нолики»
Игра «Крестики - нолики» Языковой центр Speak Up
Языковой центр Speak Up Поправки к Конституции РФ
Поправки к Конституции РФ Нет наркомании
Нет наркомании Комплексная оценка эффективности системы образования Бурятии как ресурс развития региона
Комплексная оценка эффективности системы образования Бурятии как ресурс развития региона Хищные растения
Хищные растения Представление числовой информации с помощью систем счисления
Представление числовой информации с помощью систем счисления Ключові зміни в спрощеній системі оподаткування у 2011 році та особливості роботи з 72 КВЕДом
Ключові зміни в спрощеній системі оподаткування у 2011 році та особливості роботи з 72 КВЕДом Тенденции реформирования системы обеспечения безопасности труда на основе менеджмента рисков
Тенденции реформирования системы обеспечения безопасности труда на основе менеджмента рисков By Dr. Steven Williams
By Dr. Steven Williams "Умники и умницы"
"Умники и умницы" Подготовка к научному проекту
Подготовка к научному проекту  Привет, Весна!
Привет, Весна! Предложение фирмы «Проектика» по производству и поставке торгового оборудования Рязань 2012 Россия, 390029, г.Рязань, ул.Чкалова, 68А Тел
Предложение фирмы «Проектика» по производству и поставке торгового оборудования Рязань 2012 Россия, 390029, г.Рязань, ул.Чкалова, 68А Тел Справочно-правовые системы
Справочно-правовые системы Т
Т