Содержание
- 2. Хлор (Cl) ((греч.) ((греч. χλωρός) — «зелёный») — 17-й элемент периодической системы элементов Д. И. Менделеева)
- 3. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе
- 4. Плотность газообразного Хлора при нормальных условиях 3,214 г/л; насыщенного пара при 0°С 12,21 г/л; жидкого Хлора
- 5. Химически Хлор очень активен, непосредственно соединяется почти со всеми металлами (с некоторыми только в присутствии влаги
- 6. Производимый хлор храняится в специальных «танках», или закачивается в стальные баллоны высокого давления. Баллоны с жидким
- 7. Хлор применяют во многих отраслях промышленности, науки и бытовых нужд: Основным компонентом отбеливателей является хлорная вода
- 8. При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания
- 9. Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог Хлор — токсичный удушливый газ,
- 10. Пути поступления хлора в организм В организм он поступает в основном вместе с натрием в виде
- 11. При умеренном дефиците хлора отмечаются вялость, сонливость, ослабление памяти, мышечная слабость, сухость во рту, потеря вкусовых
- 12. Превышение допустимой концентрации этого газа может оказать на человека весьма пагубное влияние. Особенно опасен газообразный хлор,
- 13. Первая помощь пострадавшим включает в себя: - промывание глаз, носа, рта 2% раствором питьевой соды; -
- 14. Метод Шееле в настоящее время используют только во время лекционных демонстраций. В лабораториях для получения хлора
- 16. Скачать презентацию













 Презентация на тему Пищеварение в ротовой полости
Презентация на тему Пищеварение в ротовой полости  Межкультурная компетенция
Межкультурная компетенция Миссия бренда
Миссия бренда Виртуальные книжные выставки: особенность технологии создания
Виртуальные книжные выставки: особенность технологии создания Способы образования глаголов
Способы образования глаголов Этапы развития коммерческого права в России
Этапы развития коммерческого права в России Профессиональное определение и его факторы
Профессиональное определение и его факторы Электронный учебникКак понимать и как применять
Электронный учебникКак понимать и как применять Графическое решение физических задач
Графическое решение физических задач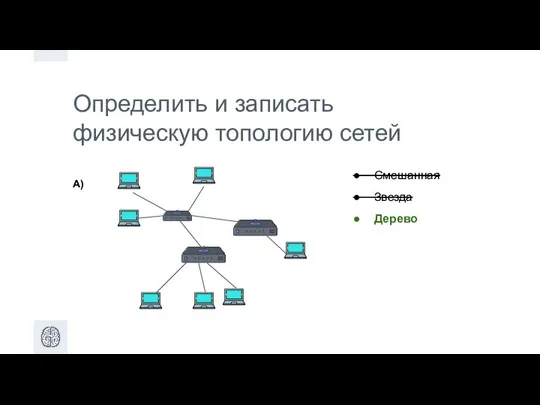 ДЗ Урок 1
ДЗ Урок 1 Big Apple International Group
Big Apple International Group Как приготовить манты
Как приготовить манты Диалекты в китайском языке
Диалекты в китайском языке СТРАТЕГИЧЕСКОЕ ПЛАНИРОВАНИЕ И УПРАВЛЕНИЕ РАЗВИТИЕМ ТЕРРИТОРИАЛЬНОЙ ЕДИНИЦЫБАЙДАКОВ СЕРГЕЙ ЛЬВОВИЧЗАМЕСТИТЕЛЬ МЭРА МОСКВЫ
СТРАТЕГИЧЕСКОЕ ПЛАНИРОВАНИЕ И УПРАВЛЕНИЕ РАЗВИТИЕМ ТЕРРИТОРИАЛЬНОЙ ЕДИНИЦЫБАЙДАКОВ СЕРГЕЙ ЛЬВОВИЧЗАМЕСТИТЕЛЬ МЭРА МОСКВЫ  Тесты по русскому языку №1
Тесты по русскому языку №1 Зонирование образовательного процесса: - зона двигательной активности - естественно научная зона - географическая зона
Зонирование образовательного процесса: - зона двигательной активности - естественно научная зона - географическая зона Презентация на тему Современные педагогические технологии
Презентация на тему Современные педагогические технологии Познавательные процессы (память)
Познавательные процессы (память) Ремкомплекты суппортов Moniva (страна-производитель Турция)
Ремкомплекты суппортов Moniva (страна-производитель Турция) Конституция - основной закон жизни
Конституция - основной закон жизни Птицы - наши друзья!
Птицы - наши друзья! Культура второй половины XX в
Культура второй половины XX в Требования к фасилитатору
Требования к фасилитатору Закон Российской Федерации о техническом регулировании и европейский подход
Закон Российской Федерации о техническом регулировании и европейский подход Ассорти по-русски
Ассорти по-русски Услышь меня. Мастер-класс
Услышь меня. Мастер-класс Серебряный век Русской литературы
Серебряный век Русской литературы Техническое обслуживанием ремонт трехфазных силовых трансформаторов
Техническое обслуживанием ремонт трехфазных силовых трансформаторов