Содержание
- 2. Ферменты (от лат. fermentum - закваска), или энзимы (от греч. en - внутри, zym - закваска)
- 3. Отличие ферментов от небиологических катализаторов 1. Высокая эффективность действия (скорость ферментативных реакций в 106-1012 раз выше,
- 4. Подобно всем белкам ферменты избирательно присоединяют определенные вещества – лиганды . Лиганд, присоединяющийся к ферменту и
- 5. Активный центр фермента: 1. Участок молекулы фермента, сформированный на уровне третичной структуры, ответственный за связывание с
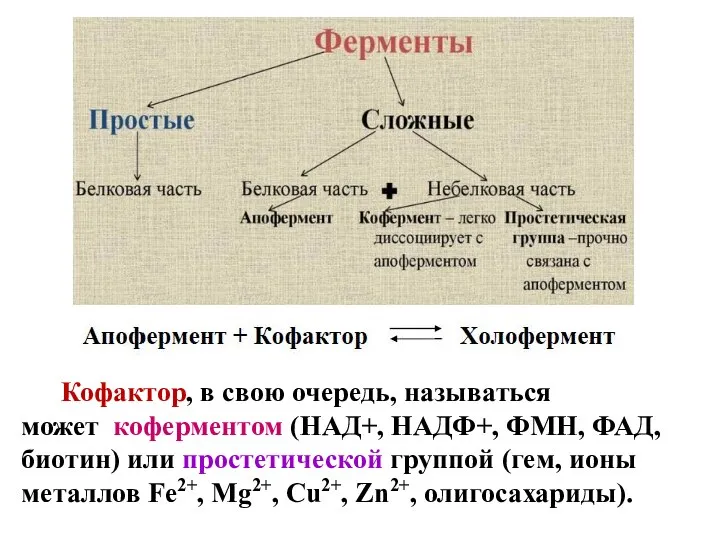
- 6. Кофактор, в свою очередь, называться может коферментом (НАД+, НАДФ+, ФМН, ФАД, биотин) или простетической группой (гем,
- 7. Деление на коферменты и простетические группы не всегда однозначно: - если связь кофактора с белком прочная,
- 8. Апоферменты синтезируются в организме, термолабильны и определяют специфичность ферментов. Кофактор термостабилен, не всегда может образоваться в
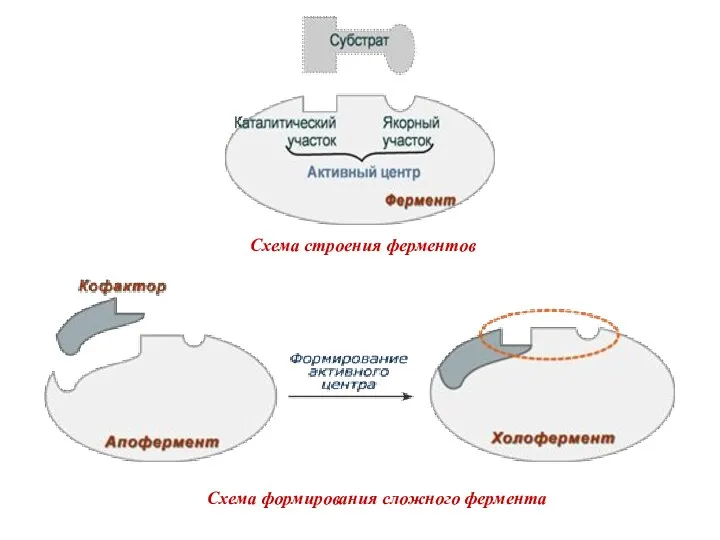
- 9. Схема строения ферментов Схема формирования сложного фермента
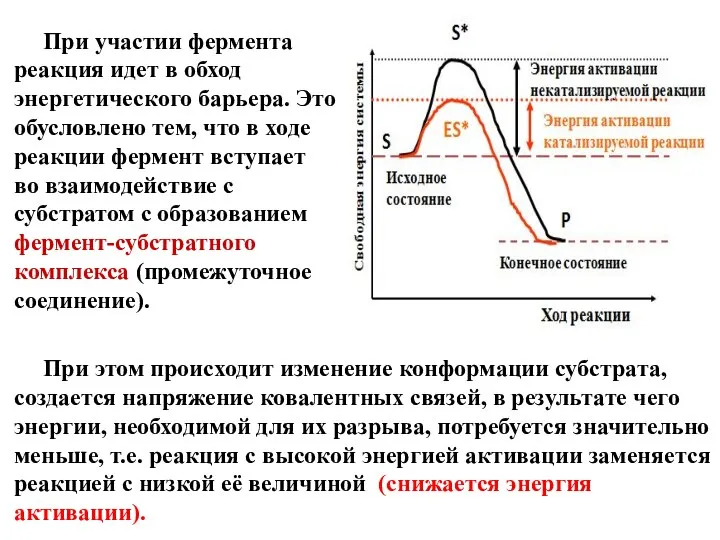
- 10. Механизм действия ферментов В химическую реакцию могут вступить лишь те молекулы, которые имеют определенный запас энергии.
- 11. При участии фермента реакция идет в обход энергетического барьера. Это обусловлено тем, что в ходе реакции
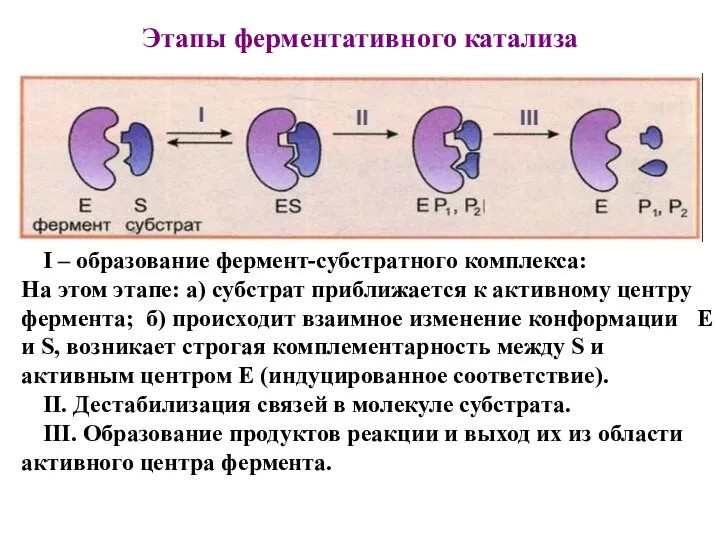
- 12. Этапы ферментативного катализа I – образование фермент-субстратного комплекса: На этом этапе: а) субстрат приближается к активному
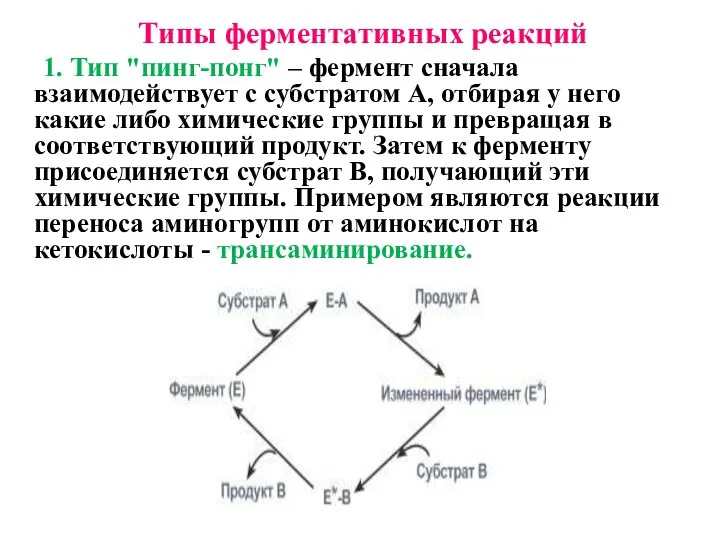
- 13. Типы ферментативных реакций 1. Тип "пинг-понг" – фермент сначала взаимодействует с субстратом А, отбирая у него
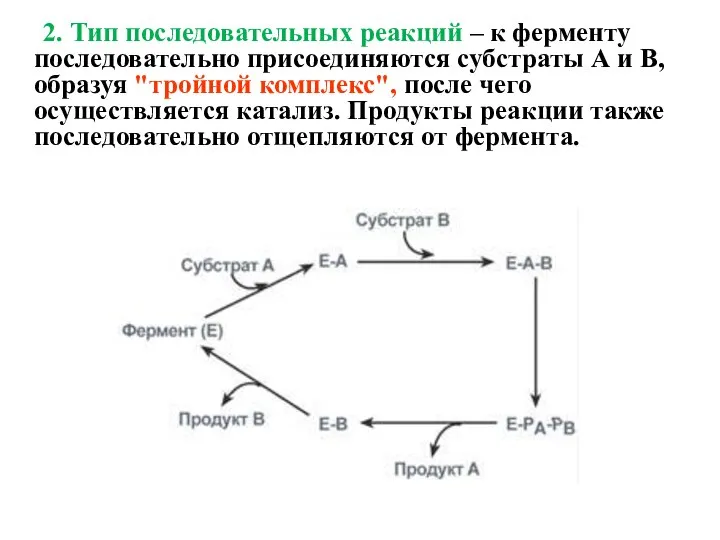
- 14. 2. Тип последовательных реакций – к ферменту последовательно присоединяются субстраты А и В, образуя "тройной комплекс",
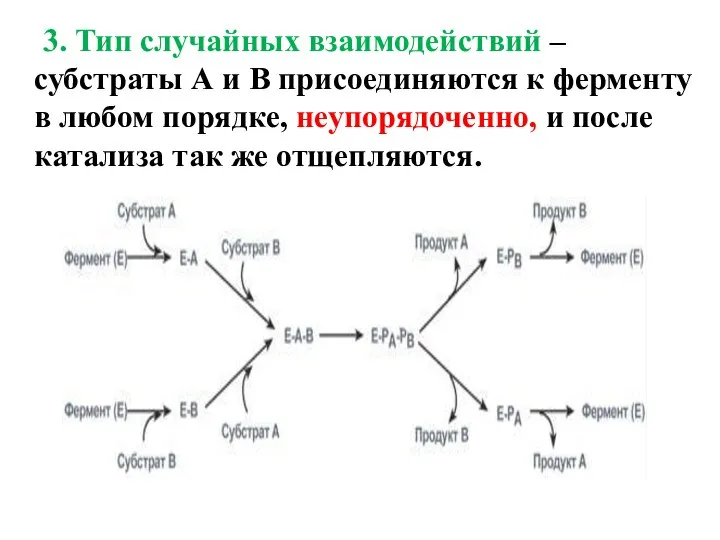
- 15. 3. Тип случайных взаимодействий – субстраты А и В присоединяются к ферменту в любом порядке, неупорядоченно,
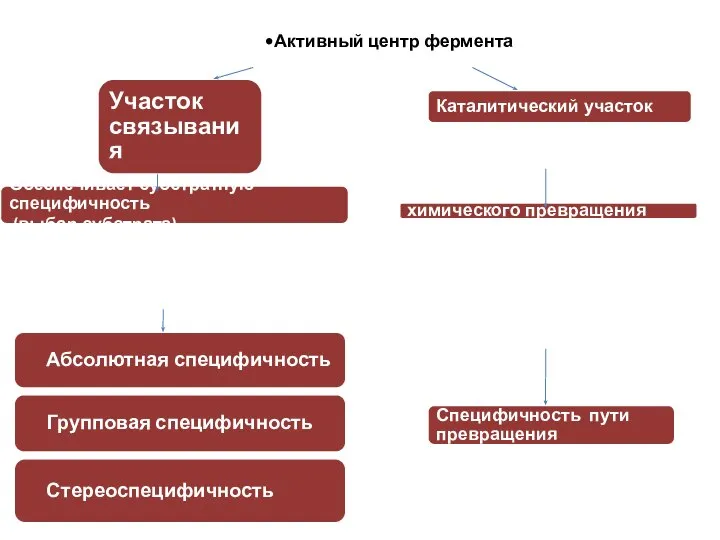
- 16. Абсолютная специфичность Групповая специфичность Стереоспецифичность Активный центр фермента Участок связывания Обеспечивает субстратную специфичность (выбор субстрата) Обеспечивает
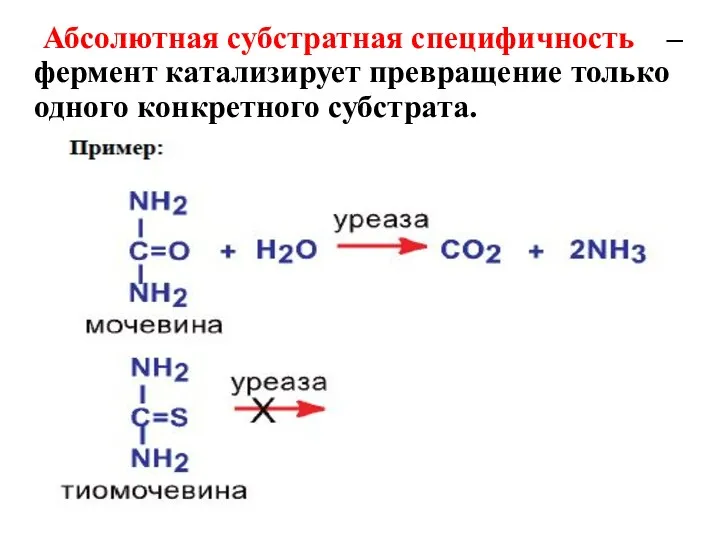
- 17. Абсолютная субстратная специфичность – фермент катализирует превращение только одного конкретного субстрата.
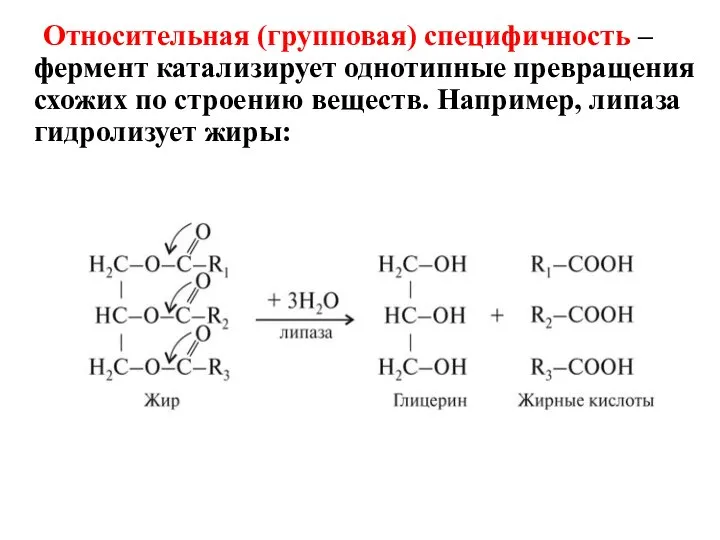
- 18. Относительная (групповая) специфичность – фермент катализирует однотипные превращения схожих по строению веществ. Например, липаза гидролизует жиры:
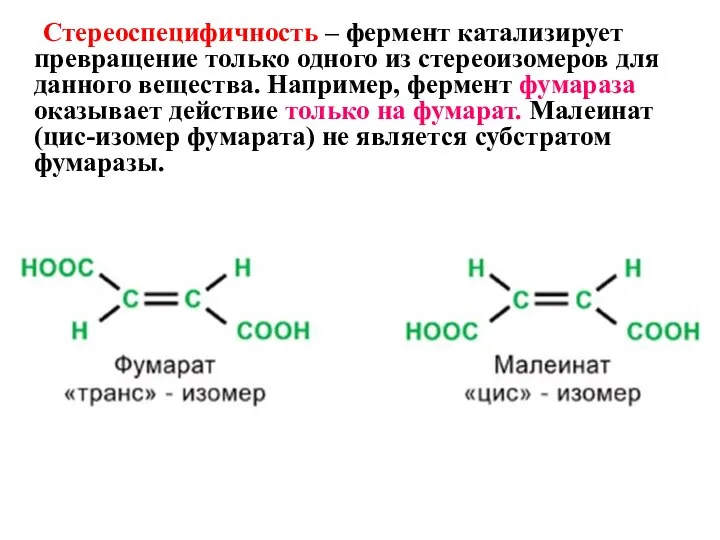
- 19. Стереоспецифичность – фермент катализирует превращение только одного из стереоизомеров для данного вещества. Например, фермент фумараза оказывает
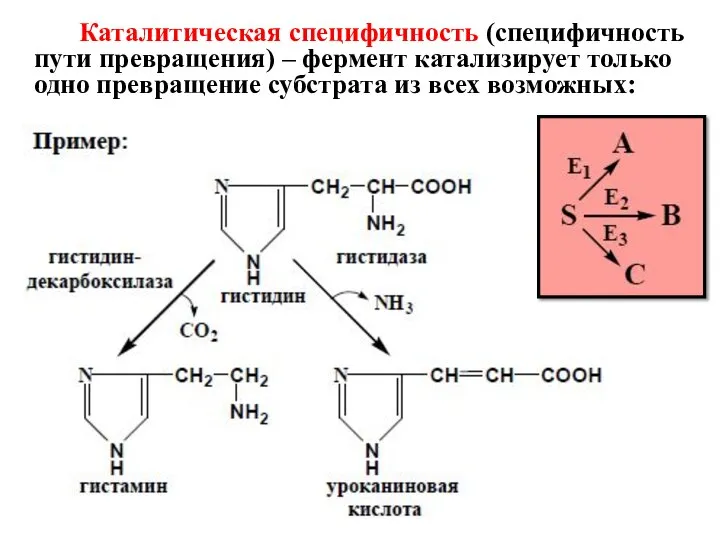
- 20. Каталитическая специфичность (специфичность пути превращения) – фермент катализирует только одно превращение субстрата из всех возможных:
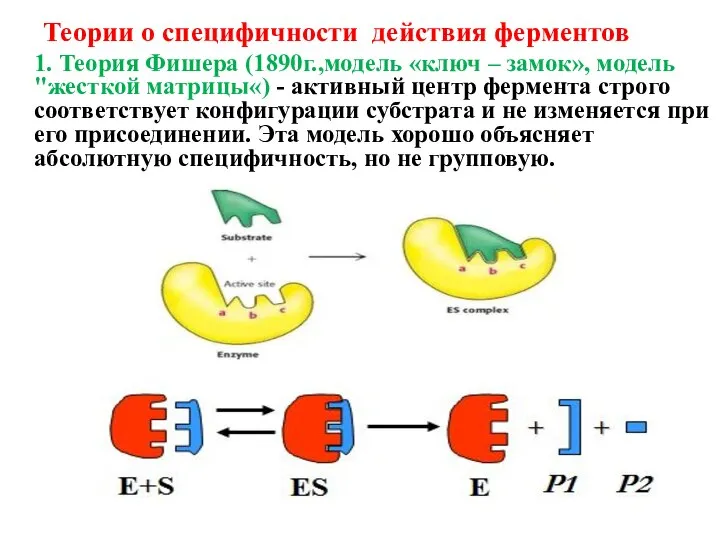
- 21. Теории о специфичности действия ферментов 1. Теория Фишера (1890г.,модель «ключ – замок», модель "жесткой матрицы«) -
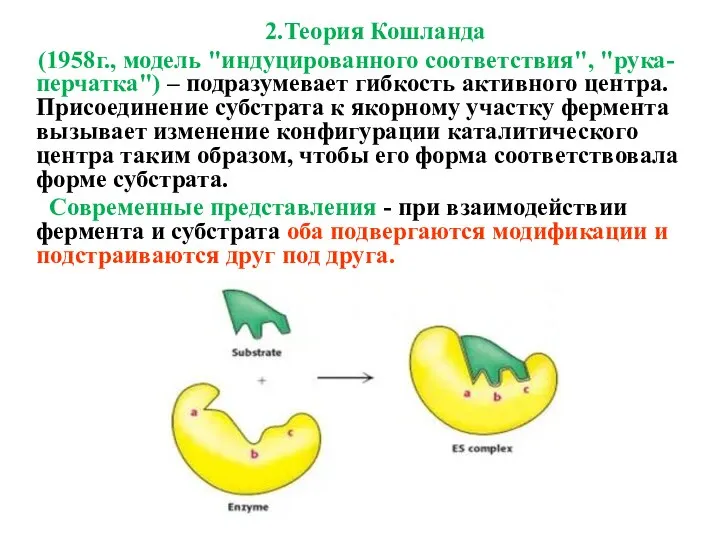
- 22. 2.Теория Кошланда (1958г., модель "индуцированного соответствия", "рука-перчатка") – подразумевает гибкость активного центра. Присоединение субстрата к якорному
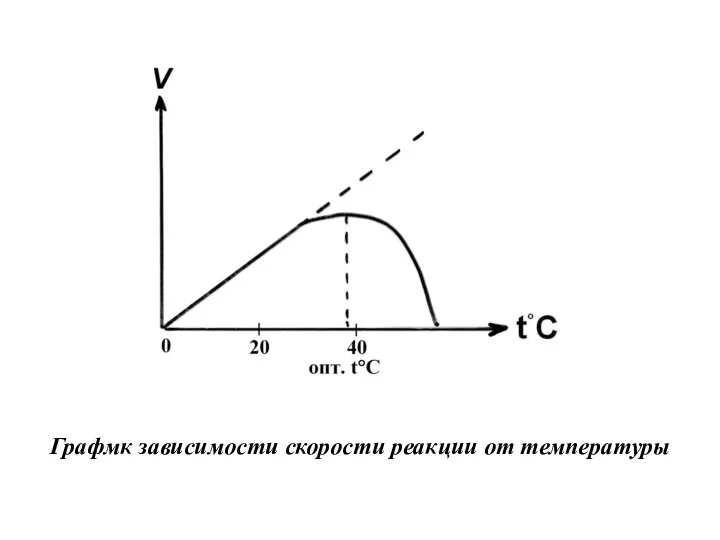
- 23. Кинетика ферментативных реакций Зависимость скорости ферментативной реакции от температуры среды Скорость химической реакции, катализируемая ферментами, имеет
- 24. Графмк зависимости скорости реакции от температуры
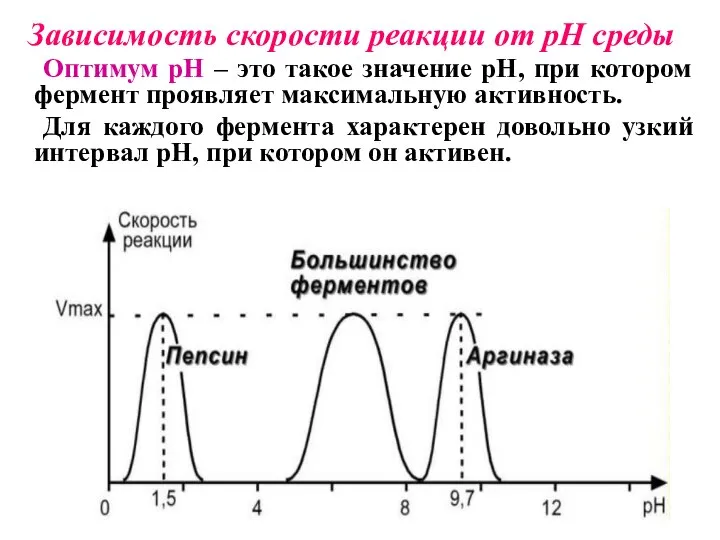
- 25. Зависимость скорости реакции от pH среды Оптимум pH – это такое значение pH, при котором фермент
- 26. При изменении pH среды в сторону от оптимума активность фермента уменьшается, т.к. происходит изменение ионизации функциональных
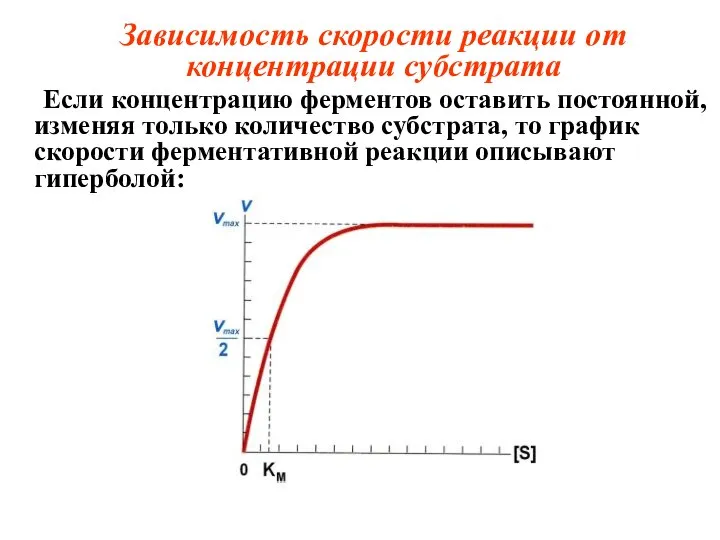
- 27. Зависимость скорости реакции от концентрации субстрата Если концентрацию ферментов оставить постоянной, изменяя только количество субстрата, то
- 28. Vmax – это такая скорость ферментативной реакции, при которой достигается полное насыщение фермента субстратом, т.е. когда
- 29. Зависимость скорости реакции от концентрации фермента В условиях избытка субстрата скорость ферментативной реакции прямо пропорциональна концентрации
- 30. Для того, чтобы оценить количество молекул фермента среди других белков данной ткани, определяют удельную активность. Удельная
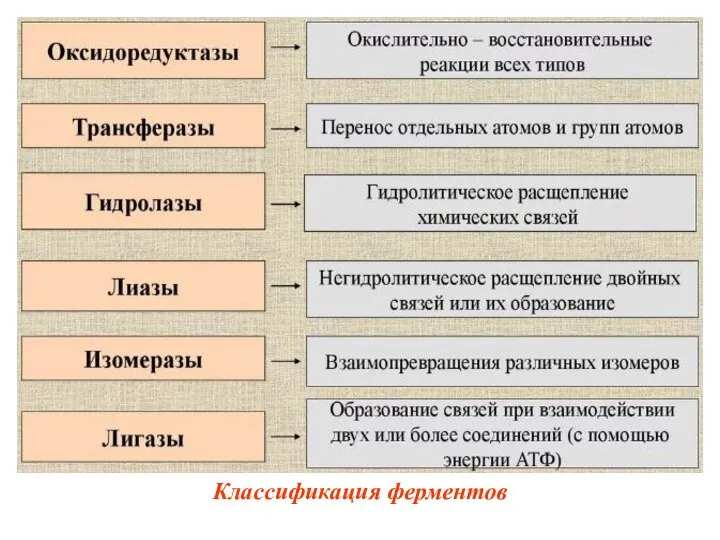
- 31. Классификация ферментов В 1961 г в Москве V Международный биохимический союз принял современную классификацию ферментов. В
- 32. Классификация ферментов
- 33. Шифр фермента Каждому ферменту присвоен четырехзначный классификационный номер(шифр - КФ), включающий класс, подкласс, подподкласс и порядковый
- 34. Название фермента Систематическое – согласно современной классификации, применяемое для однозначной идентификации фермента. Рабочее - добавляется окончание
- 35. 1. Оксидоредуктазы Катализирует различные окислительно-восстановительные реакции с участием двух субстратов (перенос электронов или атомов водорода с
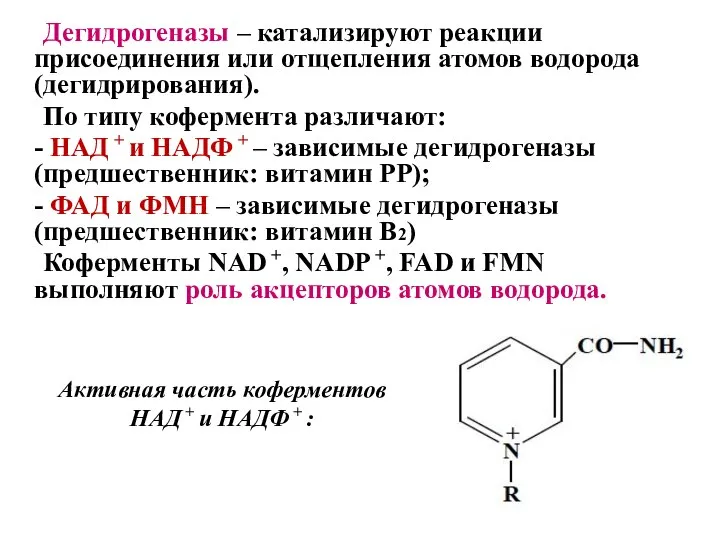
- 36. Дегидрогеназы – катализируют реакции присоединения или отщепления атомов водорода (дегидрирования). По типу кофермента различают: - НАД
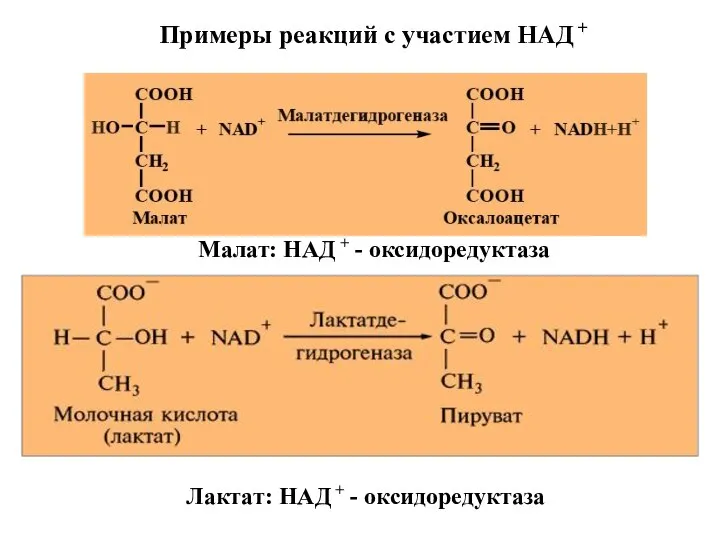
- 37. Примеры реакций с участием НАД + Малат: НАД + - оксидоредуктаза Лактат: НАД + - оксидоредуктаза
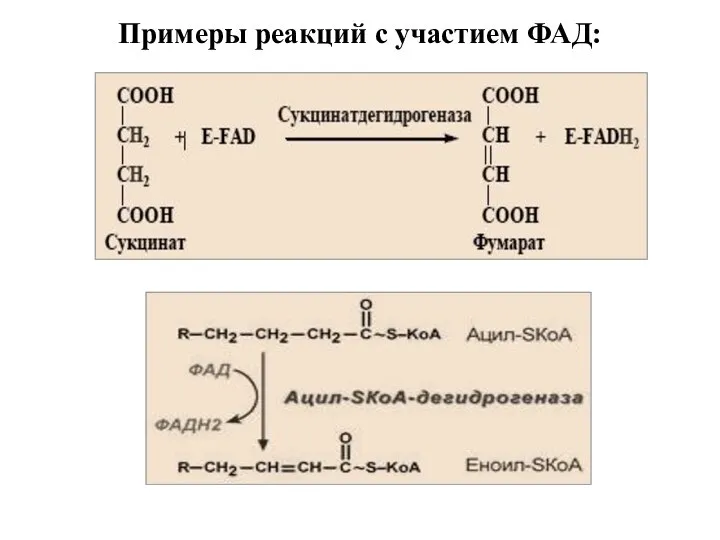
- 38. Примеры реакций с участием ФАД:
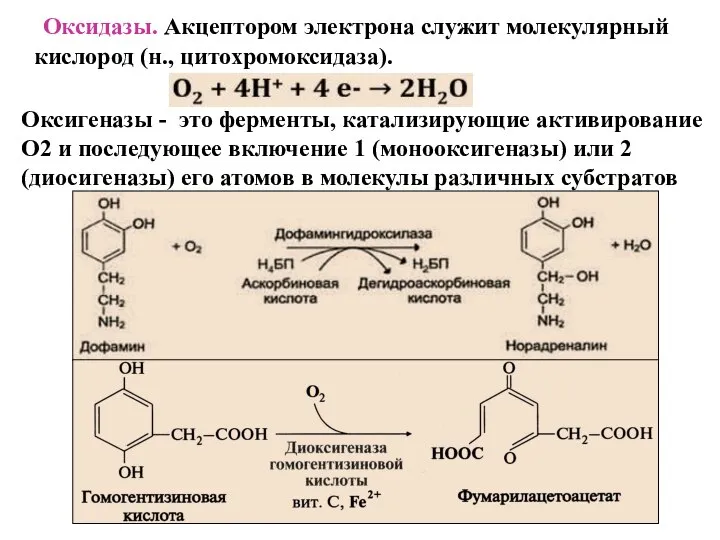
- 39. Оксидазы. Акцептором электрона служит молекулярный кислород (н., цитохромоксидаза). Оксигеназы - это ферменты, катализирующие активирование О2 и
- 40. 2. Трансферазы. Катализируют перенос функциональных групп от одного соединения к другому. Подразделяют в зависимости от переносимой
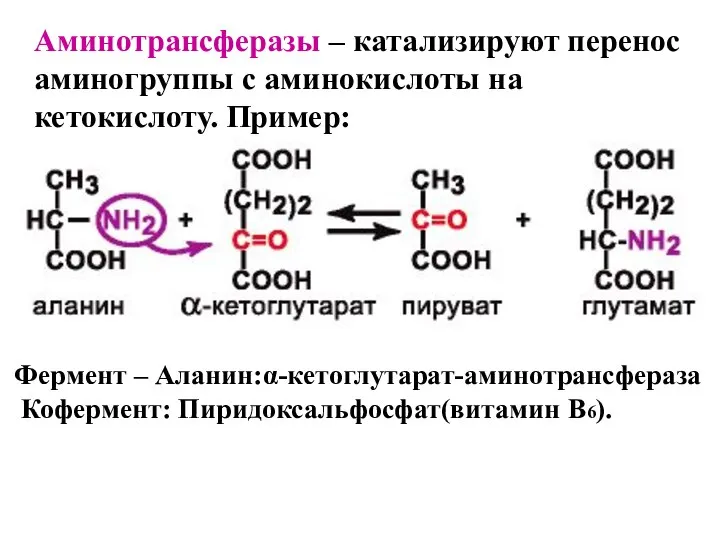
- 41. Аминотрансферазы – катализируют перенос аминогруппы с аминокислоты на кетокислоту. Пример: Фермент – Аланин:α-кетоглутарат-аминотрансфераза Кофермент: Пиридоксальфосфат(витамин B6).
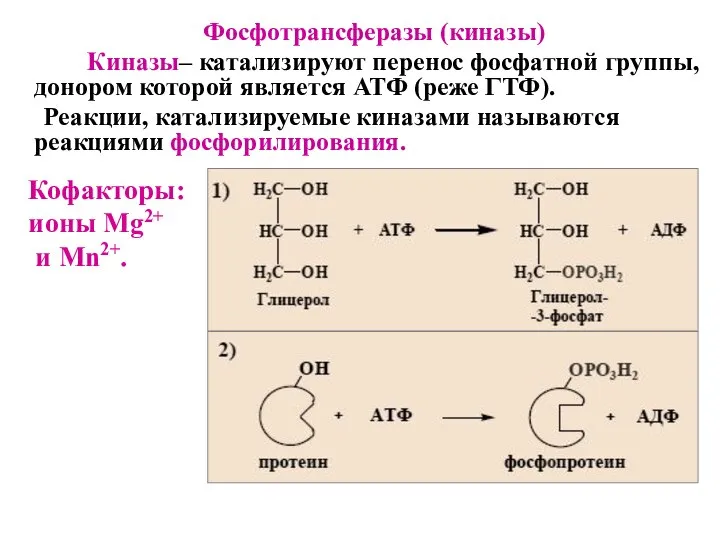
- 42. Фосфотрансферазы (киназы) Киназы– катализируют перенос фосфатной группы, донором которой является АТФ (реже ГТФ). Реакции, катализируемые киназами
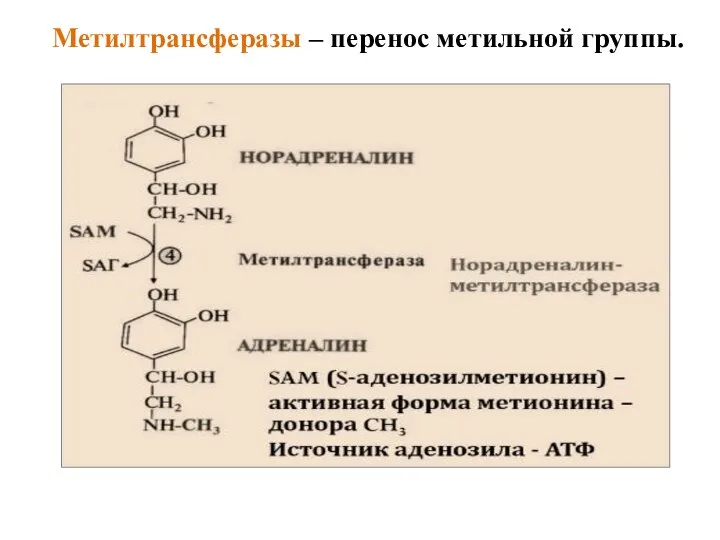
- 43. Метилтрансферазы – перенос метильной группы.
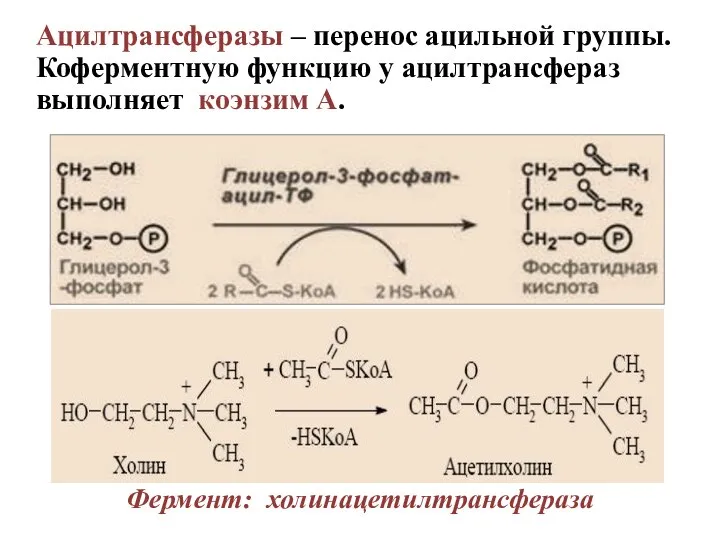
- 44. Ацилтрансферазы – перенос ацильной группы. Коферментную функцию у ацилтрансфераз выполняет коэнзим А. Фермент: холинацетилтрансфераза
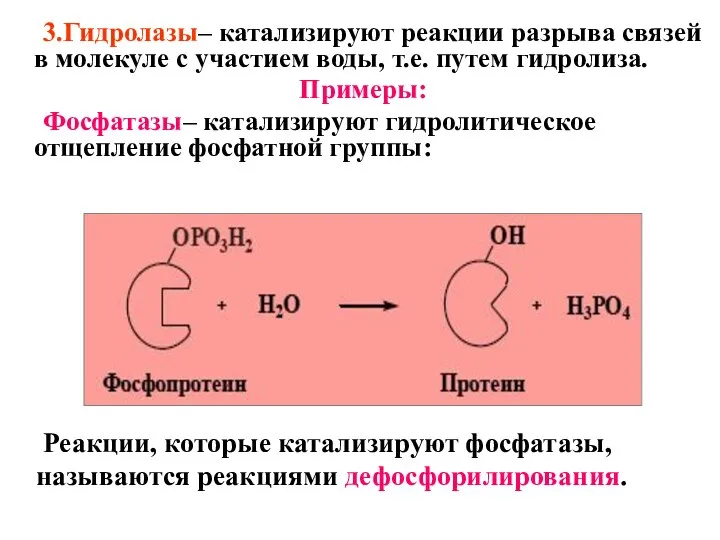
- 45. 3.Гидролазы– катализируют реакции разрыва связей в молекуле с участием воды, т.е. путем гидролиза. Примеры: Фосфатазы– катализируют
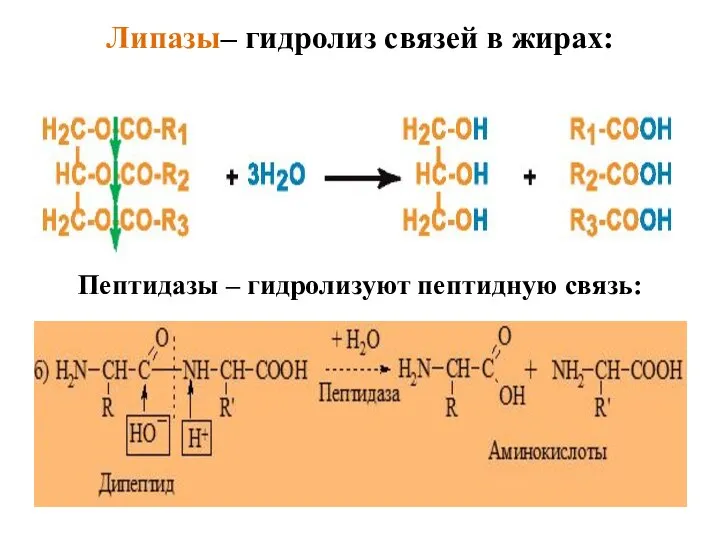
- 46. Липазы– гидролиз связей в жирах: Пептидазы – гидролизуют пептидную связь:
- 47. 4. Лиазы К лиазам относят ферменты, отщепляющие от субстратов негидролитическим путем определенную группу (при этом могут
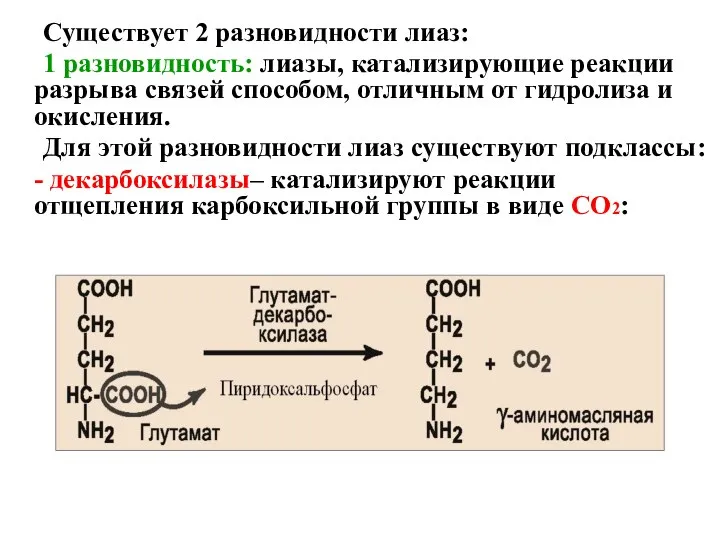
- 48. Существует 2 разновидности лиаз: 1 разновидность: лиазы, катализирующие реакции разрыва связей способом, отличным от гидролиза и
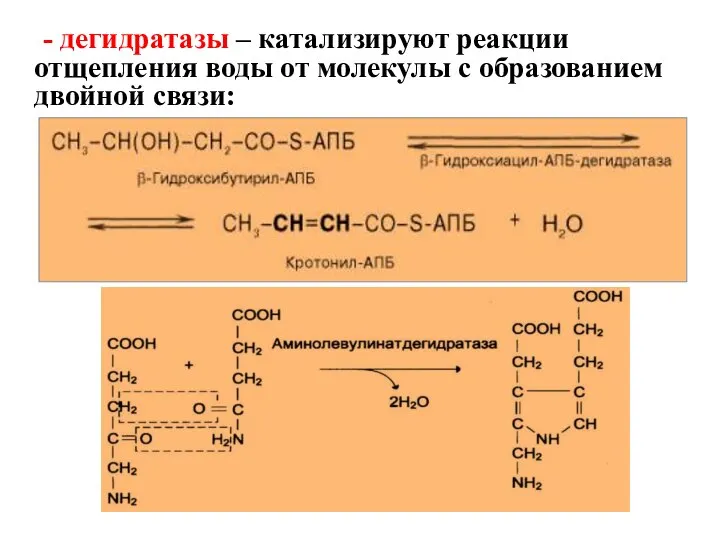
- 49. - дегидратазы – катализируют реакции отщепления воды от молекулы с образованием двойной связи:
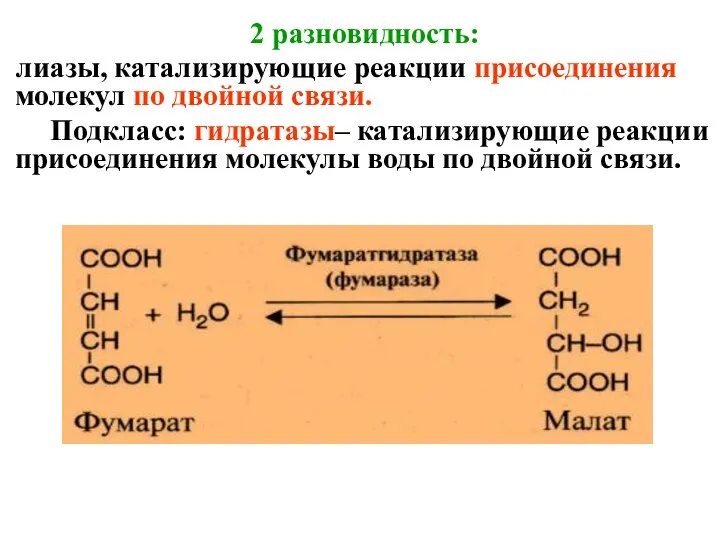
- 50. 2 разновидность: лиазы, катализирующие реакции присоединения молекул по двойной связи. Подкласс: гидратазы– катализирующие реакции присоединения молекулы
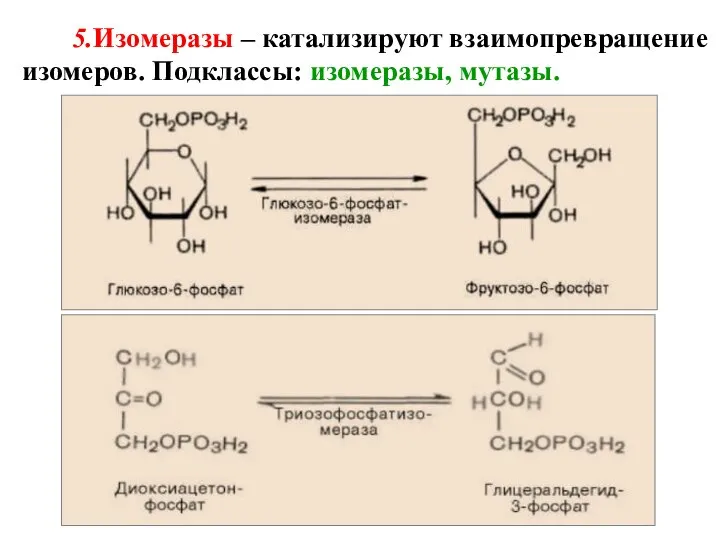
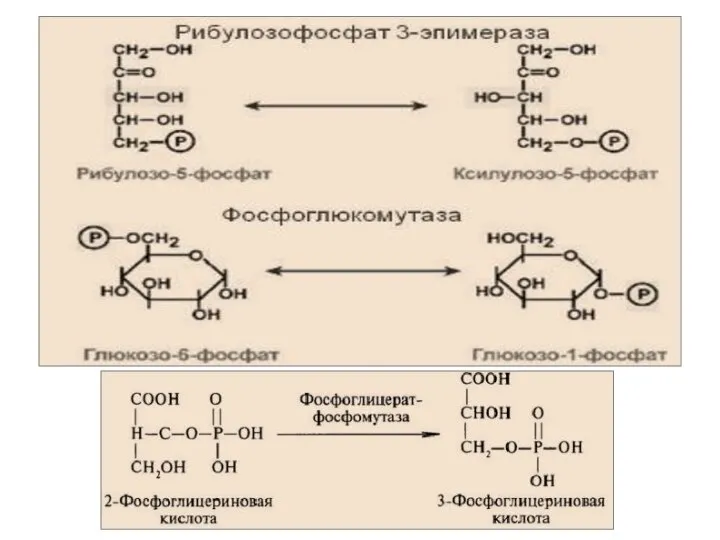
- 51. 5.Изомеразы – катализируют взаимопревращение изомеров. Подклассы: изомеразы, мутазы.
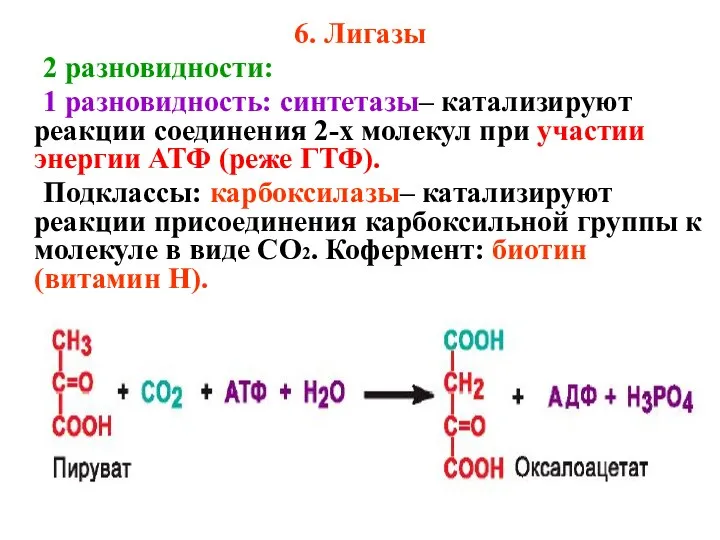
- 53. 6. Лигазы 2 разновидности: 1 разновидность: синтетазы– катализируют реакции соединения 2-х молекул при участии энергии АТФ
- 55. Скачать презентацию


















 Сердечно-сосудистая система человека
Сердечно-сосудистая система человека Бонсай
Бонсай Функции жиров
Функции жиров Эколого-биологический центр Кима Андреева. Животные мини-зоопарка
Эколого-биологический центр Кима Андреева. Животные мини-зоопарка Биосинтез белка. Центральная догма
Биосинтез белка. Центральная догма Анатомия. Структура скелета человека
Анатомия. Структура скелета человека Характеристика лабораторных технологий, основанных на иммунологических методах анализа
Характеристика лабораторных технологий, основанных на иммунологических методах анализа Кожа - пограничник организма
Кожа - пограничник организма Презентация на тему Кольчатые черви
Презентация на тему Кольчатые черви  Строение растительной и животной клетки. Прокариоты и эукариоты
Строение растительной и животной клетки. Прокариоты и эукариоты енетика пола и наследование, сцепленное с полом
енетика пола и наследование, сцепленное с полом Отряд воробьиных (Американский воробей)
Отряд воробьиных (Американский воробей) Злаковые
Злаковые Археи. Общие особенности, экология, эволюционное значение
Археи. Общие особенности, экология, эволюционное значение Вегетативное размножение растений. План самостоятельной работы по биологии 7 класс
Вегетативное размножение растений. План самостоятельной работы по биологии 7 класс Интерактивная игра Букварь природы
Интерактивная игра Букварь природы Ценные породы рыб
Ценные породы рыб Экосистемы суши, представителей флоры и фауны этих экосистем
Экосистемы суши, представителей флоры и фауны этих экосистем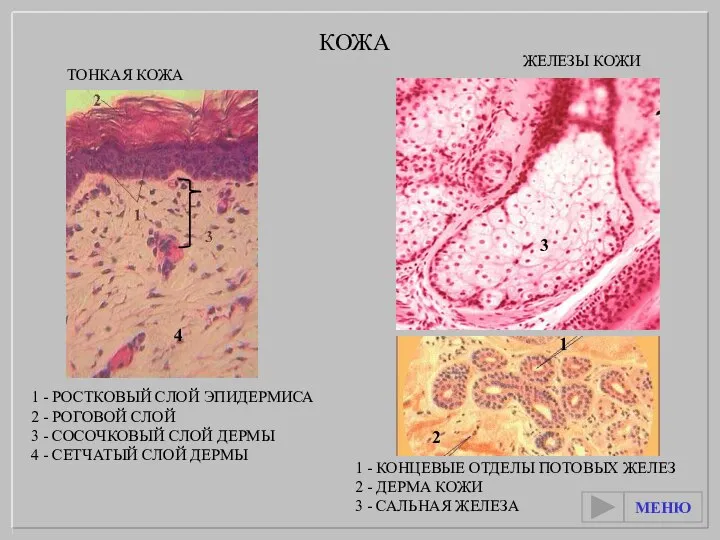 Кожа. Железы кожи. Тонкая кожа
Кожа. Железы кожи. Тонкая кожа Бактерии Прокариоты
Бактерии Прокариоты Способы размножения растений
Способы размножения растений Гипнопедия – методика обучения во сне
Гипнопедия – методика обучения во сне Презентация на тему Бесполое размножение (6 класс)
Презентация на тему Бесполое размножение (6 класс)  Цитоплазма и одномембранные органоиды клетки
Цитоплазма и одномембранные органоиды клетки Цветок одуванчик
Цветок одуванчик Клеточный цикл
Клеточный цикл Определите тип взаимоотношений между организмами
Определите тип взаимоотношений между организмами Нервная система
Нервная система