Слайд 2ОБЩИЕ ПРЕДСТАВЛЕНИЯ О ФЕРМЕНТАХ
Ферменты, или энзимы, – это биологические катализаторы, ускоряющие химические

реакции.
Общее число известных ферментов составляет несколько тысяч.
Практически все химические реакции, протекающие в живых организмах, осуществляются при их участии.
Слайд 3Ферменты ускоряют химические реакции в 108 – 1020 раз.
Слово фермент произошло

от латинского fermentum – закваска, энзим в переводе с греческого означает «в дрожжах».
В 1926 году Джеймс Самнер впервые получил очищенный фермент в кристаллическом виде – уреазу:
Слайд 4
Большинство ферментов по своей природе являются белками.
У некоторых РНК обнаружена способность

осуществлять катализ; такие РНК получили название рибозимов, или РНК-ферментов.
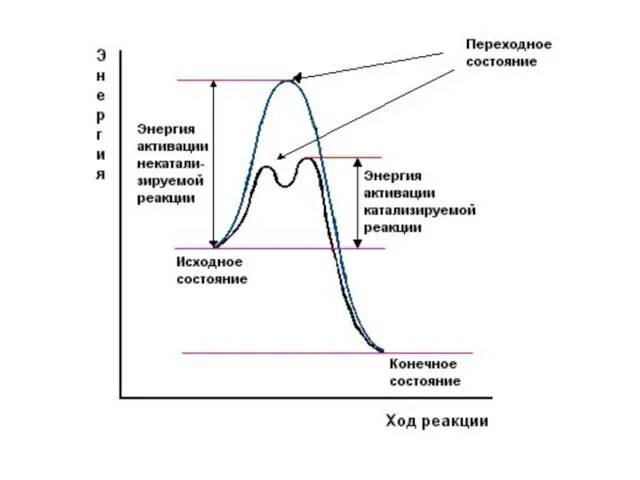
Слайд 5Ферменты имеют ряд общих свойств с химическими небелковыми катализаторами:
не расходуются в

процессе катализа и не претерпевают необратимых изменений;
ускоряют как прямую, так и обратную реакции, не смещая при этом химического равновесия;
катализируют только те реакции, которые могут протекать и без них;
повышают скорость химической реакции за счет снижения энергии активации
Слайд 7
Ферменты от химических катализаторов отличаются по ряду параметров:
ферменты обладают более высокой

эффективностью действия;
ферменты обладают более высокой специфичностью в сравнении с небелковыми катализаторами, они ускоряют более узкий круг химических реакций;
Слайд 8
ферменты эффективно действуют в мягких условиях: при температуре 0 – 40 оС,

при атмосферном давлении, при значениях рН, близких к нейтральным, в более жестких условиях ферменты денатурируют и не проявляют своих каталитических качеств;
активность ферментов регулируется активаторами и ингибиторами.
Слайд 9Структура ферментов
Относительная молекулярная масса ферментов может колебаться от 104 до 106 и

более.
Ферменты – это, как правило, глобулярные белки.
Одни ферменты являются простыми белками - состоят только из аминокислотных остатков (рибонуклеаза, пепсин, трипсин),
активность других зависит от дополнительных химических компонентов - кофакторов.
Слайд 10В качестве кофакторов могут выступать ионы металлов Fe2+, Mn2+, Mg2+, Zn2+
или
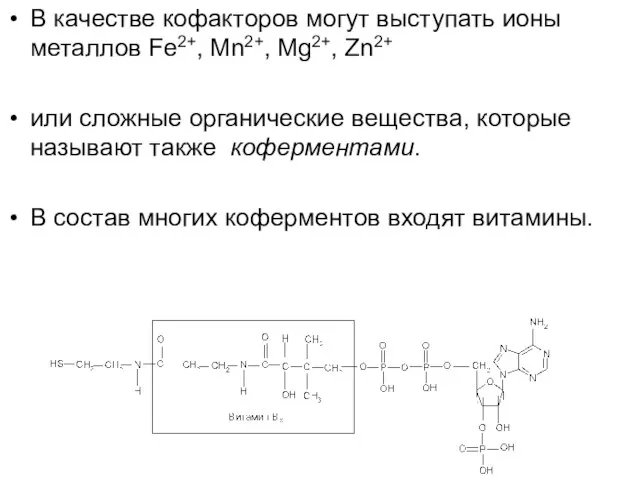
сложные органические вещества, которые называют также коферментами.
В состав многих коферментов входят витамины.
Слайд 11Если кофермент прочно связанный с ферментом называется простетической группой сложного белка.
Кофактор

легко диссоциируюет из комплекса с ферментом.
Кофакторы могут выполнять следующие функции:
участие в катализе;
осуществление взаимодействия между субстратом и ферментом;
стабилизация фермента.
Слайд 12
Каталитически активный комплекс фермент – кофактор называют холоферментом.
Отделение кофактора от холофермента

приводит к образованию неактивного апофермента:
Холофермент ↔ апофермент + кофактор.
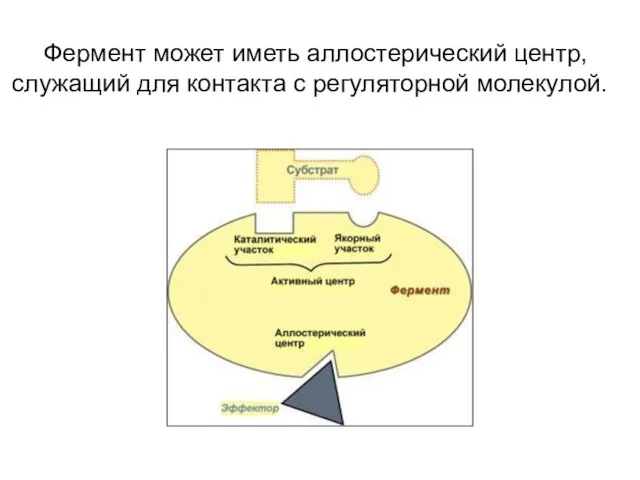
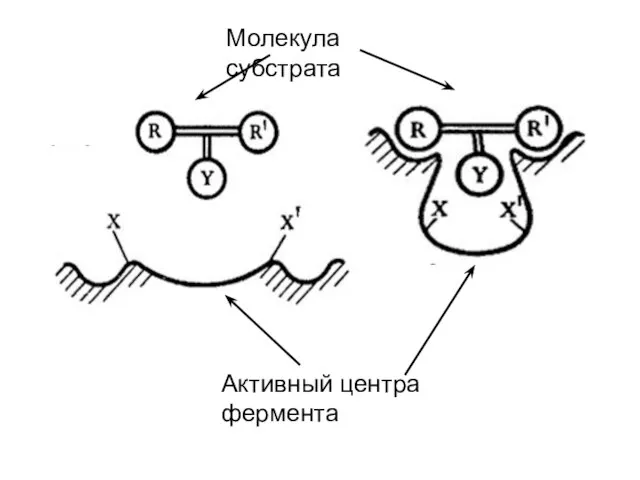
Слайд 13В молекуле фермента присутствует активный центр.
Активный центр – это область молекулы

фермента, в которой происходит связывание субстрата и его превращение в продукт реакции.
В активном центре выделяют два участка:
якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре,
каталитический – непосредственно отвечает за осуществление реакции.
Слайд 14
Фермент может иметь аллостерический центр, служащий для контакта с регуляторной молекулой.
Слайд 15
Активный центр образуют аминокислотные остатки полипептидной цепи.
В состав активного центра может

входить и небелковый компонент.
Наиболее часто в составе активного центра содержатся полярные (серин, треонин, цистеин) и заряженные (лизин, гистидин, глутаминовая и аспарагиновая кислоты) аминокислотные остатки.
Слайд 16Аминокислотные остатки, образующие активный центр, в полипептидной цепи находятся на значительном расстоянии
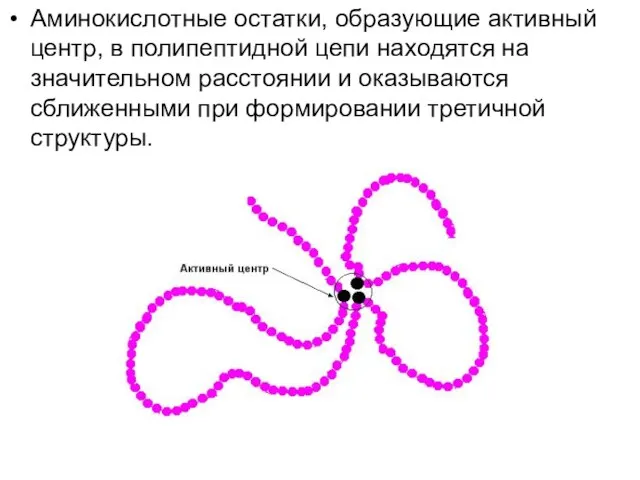
и оказываются сближенными при формировании третичной структуры.
Слайд 17
Некоторые ферменты синтезируются в неактивной форме в виде проферментов, которые затем под

действием определенных факторов активируются.
Например, пищеварительные ферменты химотрипсин и трипсин образуются в результате активации химотрипсиногена и трипсиногена.
Слайд 18Изоферменты – это группа ферментов, выполняющих идентичную каталитическую функцию у представителей одного

биологического вида, но отличающихся по структуре и физико-химическим свойствам (генетически детерминированы).
Множественные формы ферментов – это группа ферментов, выполняющих идентичную каталитическую функцию у представителей одного биологического вида, образовавшиеся в результате различных посттрансляционных модификаций.
Слайд 19Номенклатура и классификация ферментов
Тривиальная номенклатура.
Например,
пепсин (от греч. “пепсис” – “пищеварение”),

трипсин (от греч. “трипсис” – “разжижаю”),
папаин (от названия дынного дерева Carica papaja).
Слайд 20Рациональная номенклатура.
Название фермента составляется из названия субстрата и характерного окончания “-аза”.

Например,
амилаза - катализирует гидролиз крахмала (от греч. “амилон” – “крахмал”),
липаза - гидролиз липидов (от греч. “липос” – “жир”),
уреаза – гидролиз мочевины (от греч. “уреа” – “мочевина”) и т.д.
Слайд 21
Существуют и систематические названия ферментов, включающие названия субстратов и отражающие характер катализируемой

реакции:
АТФ + D-глюкоза ↔ АДФ + D-глюкоза – 6 – фосфат,
АТФ: гексоза 6-фосфотрансфераза.
Слайд 22В соответствии с катализируемой реакцией все ферменты делятся на 6 классов.
Оксидоредуктазы.
Катализируют

окислительно-восстановительные реакции
Трансферазы.
Катализируют реакции межмолекулярного переноса групп: АB + C = AC + B.
Гидролазы.
Катализируют реакции гидролиза:
АВ + Н2О = АОН + ВН.
Слайд 23Лиазы.
Катализируют реакции присоединения групп по двойным связям и обратные реакции.
Изомеразы.
Катализируют

реакции изомеризации (внутримолекулярный перенос групп).
Лигазы.
Катализируют реакции синтеза, сопряженные с распадом макроэргов (АТФ).
Слайд 24В свою очередь каждый класс подразделяют
на подклассы,
подклассы – на подподклассы.

Ферментам, образующим подподклассы, присваивается порядковый номер.
В итоге фермент имеет свой четырехзначный номер:
КФ 2.7.1.1. означает:
класс 2 – трансферазы;
подкласс 7 – перенос фосфата;
подподкласс 1 – алкогольная группа – акцептор фосфата. Название – гексокиназа, или АТФ:D-гексоза-6-фосфотрансфераза.
Слайд 25МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
Последовательность стадий катализа:
Взаимодействие субстрата с ферментом в активном центре.
Химическое превращение

субстрата в продукт реакции.
Освобождение продукта реакции из активного центра фермента.
Слайд 26Взаимодействие фермента Е с субстратом S приводит к образованию промежуточного фермент-субстратного комплексаES.

При взаимодействии фермента с субстратом, реагирующие вещества сближаются и удерживаются в таком положении, чтобы реакционноспособные группы могли провзаимодействовать;
Слайд 27Модель жесткой матрицы Э. Фишера (1894) (модель «ключ-замок») основана на теории существования
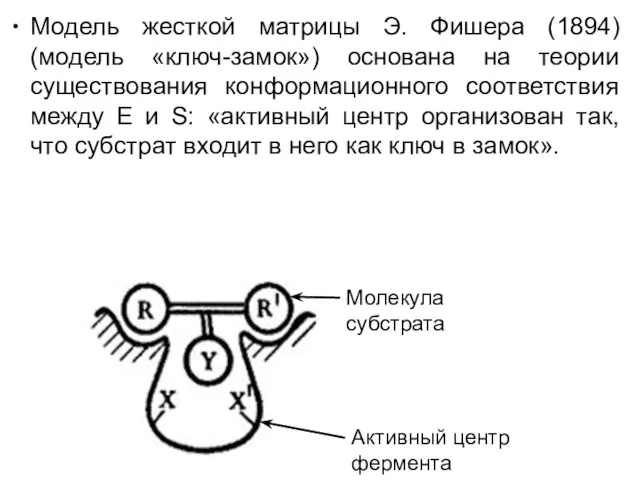
конформационного соответствия между Е и S: «активный центр организован так, что субстрат входит в него как ключ в замок».
Слайд 28Модель и теория индуцированного конформационного соответствия
между Е и S Д. Кошланда

(1958)
(модель «рука-перчатка»).
Взаимодействие субстрата с ферментом вызывает конформационные изменения в молекуле фермента: функциональные группы принимают ориентацию, необходимую для связывания субстрата и катализа.
Слайд 30
В катализе принимают участие:
функциональные группы, которые могут быть донорами или акцепторами Н+

(кислотами и основаниями);
группы, которые могут участвовать в образовании ковалентных связей с молекулами субстрата.
Слайд 31
КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Кинетика ферментативных реакций – наука о скоростях ферментативных реакций, их

зависимости от различных факторов.
Скорость ферментативной реакции:
v = Δс / t .
Скорость ферментативной реакции зависит от природы фермента, которая определяет его активность.
Слайд 32Способы выражения ферментативной активности:
Единица активности фермента – количество фермента, которое в стандартных

условиях катализирует превращение 1 мкмоль субстрата в 1 мин (1 МЕ = 1 мкмоль/мин).
1 КАТАЛ – количество фермента, способное в течение 1 с обеспечить превращение 1 моль субстрата в стандартных условиях.
1 КАТАЛ = 6 · 107 МЕ.
Слайд 33Удельная активность – число единиц ферментативной активности, приходящееся на 1 мг белка

(1 мкмоль/мин·мг белка).
Активность каталитического центра – число молекул субстрата, которые претерпевают превращение за 1 мин в расчете на 1 каталитический центр.
Число оборотов фермента – число молекул субстрата, претерпевающих превращение за 1 мин в расчете на 1 активный центр или 1 активную молекулу фермента.
Слайд 34
В процессе ферментативной реакции фермент (Е) взаимодействует с субстратом (S) с образованием

фермент-субстратный комплекс, который затем распадается с высвобождением фермента и продукта (Р) реакции:
E + S ←→ ES → E + P.
Скорость ферментативной реакции зависит от концентрации субстрата и фермента, температуры, рН среды, наличия различных регуляторных веществ.
Слайд 35Влияние концентрации субстрата на скорость ферментативной реакции
(Уравнение Михаэлиса-Ментен)
При низких концентрациях субстрата
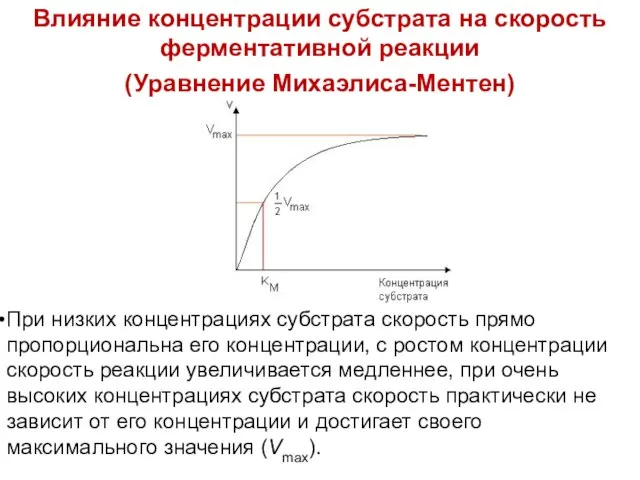
скорость прямо пропорциональна его концентрации, с ростом концентрации скорость реакции увеличивается медленнее, при очень высоких концентрациях субстрата скорость практически не зависит от его концентрации и достигает своего максимального значения (Vmax).
Слайд 36
При высоких концентрациях субстрата все молекулы фермента находятся в составе фермент-субстратного комплекса,

и достигается полное насыщение активных центров фермента, именно поэтому скорость реакции практически не зависит от концентрации субстрата.
Слайд 37График зависимости активности фермента от концентрации субстрата описывается уравнением Михаэлиса – Ментен,

которое получило название в честь выдающихся ученых Л.Михаэлиса и М.Ментен:
Vmax [S]
v = ___________,
KM + [S]
где v – скорость ферментативной реакции; [S] – концентрация субстрата; KM – константа Михаэлиса.
Слайд 38
Физический смысл константы Михаэлиса:
При условии, что v = ½ Vmax, получаем

KM = [S].
Константа Михаэлиса равна концентрации субстрата, при которой скорость реакции равна половине максимальной.
Слайд 39Зависимость скорости реакции
от концентрации субстрата
в двойных обратных
координатах (уравнение
Лайнуивера-Бэрка)
Определение
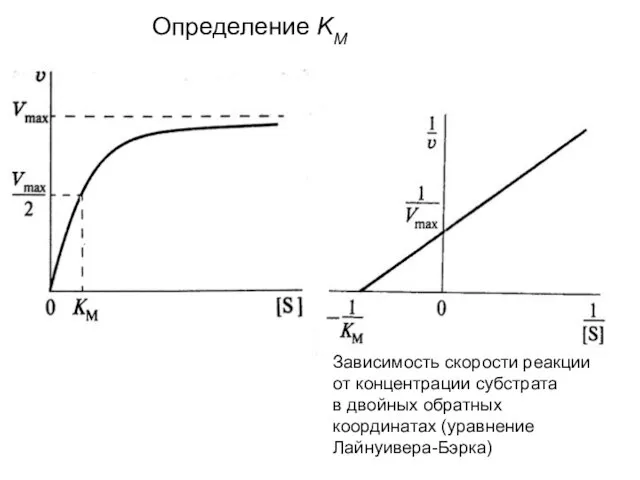
KM
Слайд 40Зависимость скорости реакции от концентрации фермента
Зависимость скорости реакции от концентрации фермента является
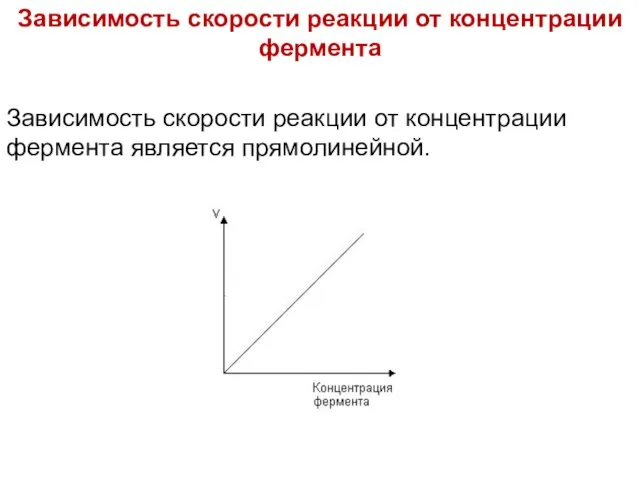
прямолинейной.
Слайд 41
Не прямолинейная зависимость
- при высоких концентрациях фермента наблюдается вследствие нехватки субстрата

или агрегации молекул фермента и др.,
- при небольших концентрациях фермента может быть результатом присутствия в инкубационной среде токсических примесей, связывающихся с ферментом и инактивирующих его.
Слайд 42Зависимость скорости ферментативной реакции от температуры
Зависимость скорости ферментативной реакции от температуры представлена
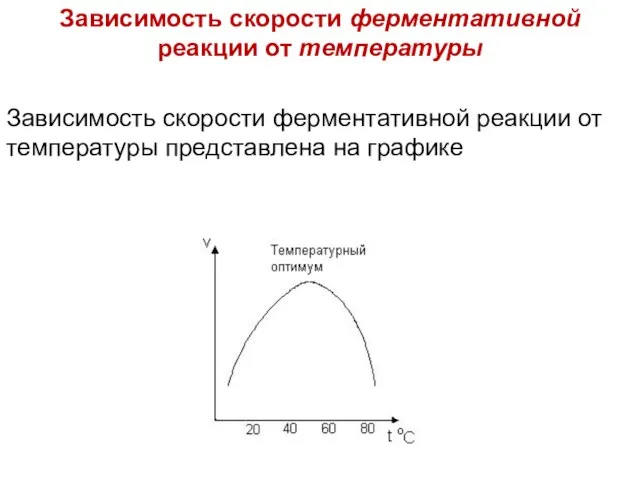
на графике
Слайд 43При низких температурах (приблизительно до 40 – 50 оС) повышение температуры на

каждые 10 оС в соответствии с правилом Вант-Гоффа сопровождается увеличением скорости химической реакции в 2 – 4 раза.
При высоких температурах более 55 – 60 оС активность фермента резко снижается из-за его тепловой денатурации.
Максимальная активность ферментов наблюдается обычно в пределах 40 – 60 оС.
Слайд 44
Температура, при которой активность фермента максимальна, называется температурным оптимумом.
Температурный оптимум ферментов

термофильных микроорганизмов находится в области более высоких температур.
Слайд 45Зависимость скорости ферментативной реакции от рН
График зависимости от рН имеет колоколообразную форму
Значение
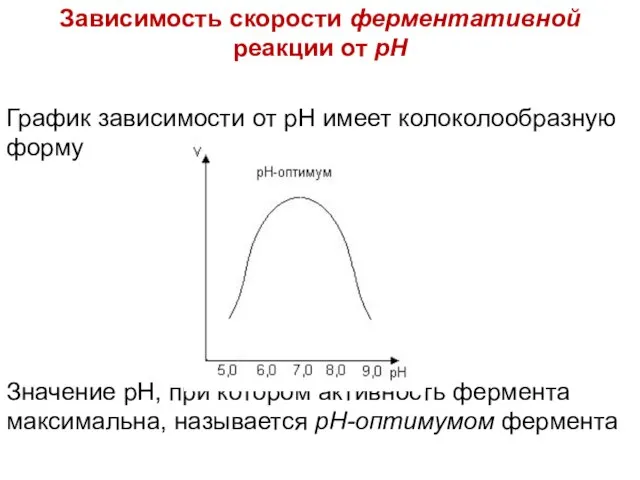
рН, при котором активность фермента максимальна, называется рН-оптимумом фермента
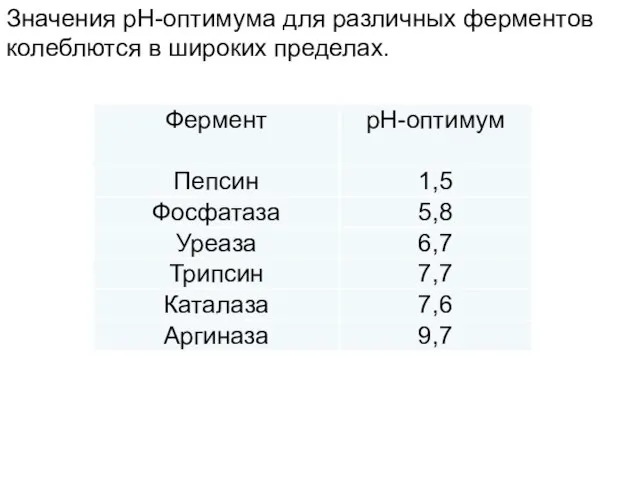
Слайд 46Значения рН-оптимума для различных ферментов колеблются в широких пределах.
Слайд 47Характер зависимости ферментативной реакции от рН определяется тем, что этот показатель оказывает

влияние на:
ионизацию аминокислотных остатков, участвующих в катализе,
ионизацию субстрата,
конформацию фермента и его активного центра.
Слайд 48Ингибирование ферментов
Скорость ферментативной реакции может быть снижена при участиии ингибиторов.
Ингибитор –

вещество, специфически уменьшающее скорость ферментативной реакции.
Различают ингибиторы:
связывающиеся с апоферментом,
образующие комплекс с субстратом,
связывающие кофермент,
связывающие активатор,
взаимодействующие с фермент-субстратными комплексами.
Слайд 49
Ингибиторы можно разделить на два основных типа: необратимые и обратимые.
Необратимые ингибиторы

(I) связываются с ферментом с образованием комплекса, диссоциация которого с восстановлением активности фермента невозможна:
E + I → EI.
Слайд 50
Примером необратимого ингибитора является диизопропилфторфосфат (ДФФ). ДФФ ингибирует фермент ацетилхолинэстеразу, играющего важную

роль в передаче нервного импульса. Этот ингибитор взаимодействует с серином активного центра фермента, блокируя тем самым активность последнего. Вследствие этого нарушается способность отростков нервных клеток нейронов проводить нервный импульс. ДФФ является одним из первых веществ нервно-паралитического действия. На его основе создан ряд относительно нетоксичных для человека и животных инсектицидов - веществ, ядовитых для насекомых.
Слайд 51
Обратимые ингибиторы при определенных условиях могут быть легко отделены от фермента.
Активность

последнего при этом восстанавливается:
E + I ←→ EI.
Обратимое ингибирование активности фермента подразделяется на: конкурентное, неконкурентное, бесконкурентное и смешанное.
Слайд 52Типы ингибирования
Конкурентное ингибирование.
Конкурентный ингибитор, являясь структурным аналогом субстрата, взаимодействует с активным центром

фермента и таким образом перекрывает доступ субстрата к ферменту.
При этом ингибитор не подвергается химическим превращениям и связывается с ферментом обратимо.
После диссоциации комплекса EI фермент может связаться либо с субстратом и преобразовать его, либо с ингибитором.
Поскольку и субстрат и ингибитор конкурируют за место в активном центре, такое ингибирование называется конкурентным.
Слайд 53
Конкурентные ингибиторы используются в медицине. Для борьбы с инфекционными болезнями ранее широко
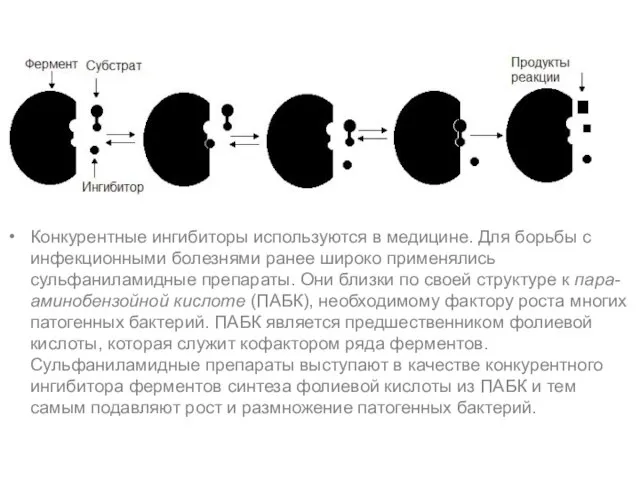
применялись сульфаниламидные препараты. Они близки по своей структуре к пара-аминобензойной кислоте (ПАБК), необходимому фактору роста многих патогенных бактерий. ПАБК является предшественником фолиевой кислоты, которая служит кофактором ряда ферментов. Сульфаниламидные препараты выступают в качестве конкурентного ингибитора ферментов синтеза фолиевой кислоты из ПАБК и тем самым подавляют рост и размножение патогенных бактерий.
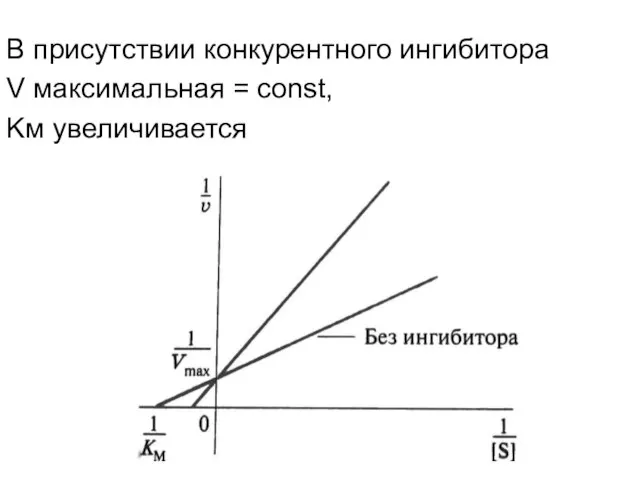
Слайд 54В присутствии конкурентного ингибитора
V максимальная = const,
Kм увеличивается
Слайд 55Неконкурентное ингибирование
Неконкурентные ингибиторы по структуре не сходны с субстратом и при образовании

EI взаимодействуют не с активным центром, а с другим участком фермента.
Взаимодействие ингибитора с ферментом приводит к изменению структуры последнего.
Образование EI-комплекса является обратимым, поэтому после его распада фермент вновь способен атаковать субстрат
Слайд 56
В качестве неконкурентного ингибитора может выступать цианид CN-. Он связывается с ионами
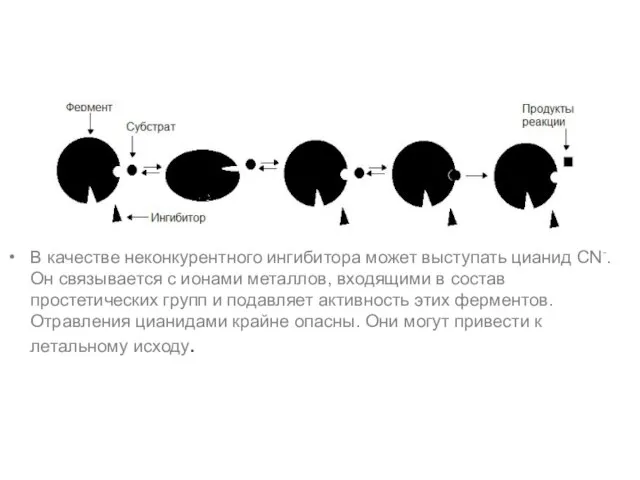
металлов, входящими в состав простетических групп и подавляет активность этих ферментов. Отравления цианидами крайне опасны. Они могут привести к летальному исходу.
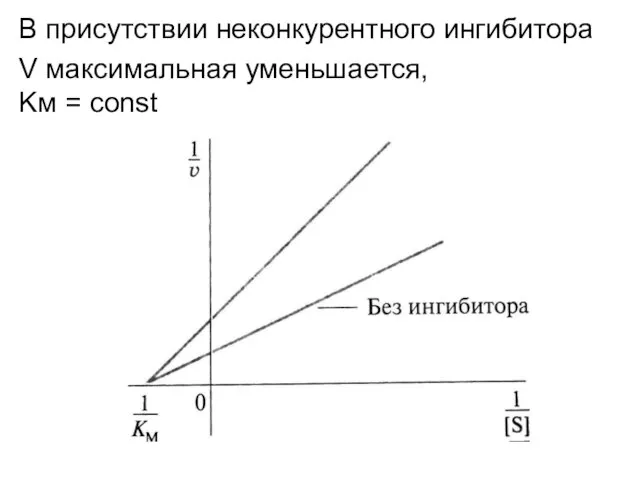
Слайд 57В присутствии неконкурентного ингибитора
V максимальная уменьшается,
Kм = const
Слайд 58
Бесконкурентное ингибирование
Ингибитор обратимо взаимодействует с ферментом только после образования фермент-субстратного комплекса.
Образующийся в

этом случае тройной комплекс фермент-субстрат-ингибитор не подвергается дальнейшему превращению.
Слайд 59Смешанное ингибирование
сочетает в себе конкурентное и неконкурентное торможение.
Ингибитор, присоединяется в

активном центре фермента, изменяет сродство фермента к субстрату и каталитическую активность фермента.
Слайд 60Регуляция каталитической активности ферментов
Регуляция путём посттрансляционной ковалентной модификации молекулы фермента (ограниченный протеолиз,

фосфорилирование, метилирование, гликозилирование и др.).
Изменение физико-химических условий внутриклеточной среды (рН, температура и др.).
Белок-белковое взаимодействие (регуляция специфическими белками).
Слайд 61Регуляция функционирования ферментных систем
Ферментные системы обладают способностью поддерживать необходимую скорость суммарного процесса

преобразования исходного субстрата в конечный продукт.
При накоплении конечного продукта он может оказывать ингибирующее действие на первый фермент системы. Происходит ингибирование по типу обратной связи, или ретро-ингибирование.
Слайд 62Регуляция биосинтеза ферментов
Индукция фермента (синтез de novo) происходит при повышении концентрации субстрата

в клетке.
Репрессия фермента (снижение скорости синтеза) происходит при повышении концентрации продуктов ферментативной реакции.
Сущность регуляции биосинтеза сводится к “включению” или “выключению” генов, ответственных за синтез фермента.
Слайд 63Аллостерические ферменты
Термин «аллостерический» происходит от греческих слов allo – другой, stereo –
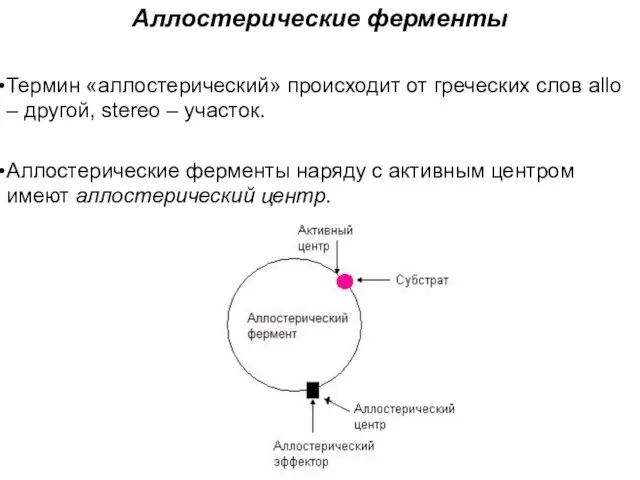
участок.
Аллостерические ферменты наряду с активным центром имеют аллостерический центр.
Слайд 64С аллостерическим центром связываются аллостерические эффекторы - вещества, способные изменять активность ферментов.

Эффекторы бывают
положительными, активирующими фермент,
отрицательными – ингибирующими фермент.
Некоторые аллостерические ферменты могут подвергаться действию двух и более эффекторов.
Слайд 65Регуляция мультиферментных систем
Некоторые ферменты действуют согласованно, объединяясь в мультиферментные системы, в которых

каждый фермент катализирует определенную стадию метаболитического пути:
Слайд 66В мультиферментной системе есть фермент, который определяет скорость всей последовательности реакций.
Этот

фермент, как правило, бывает аллостерическим и находится в начале матаболитического пути.
Он способен, получая различные сигналы, как повышать, так и понижать скорость катализируемой реакции, тем самым регулируя скорость всего процесса.
Слайд 67Применение ферментов
Отрасли промышленности, в которых применяются ферменты:
хлебопечение, пивоварение, виноделие, чайное, кожевенное и

меховое производства, сыроварение, кулинария (для обработки мяса) и т.д.;
в химической индустрии для разделения стереоизомеров;
сельском хозяйстве;
медицине.
Слайд 68Применение ферментов в медицине
Энзимопатология - изучает молекулярные основы развития патологического процесса, исходя

из данных о нарушениях механизмов регуляции активности или синтеза ферментов.
Энзимодиагностика– это использование ферментов в качестве избирательных реагентов для определения метаболитов, а также определение самих ферментов в биологических жидкостях при патологии.
Слайд 69Энзимотерапия – использование ферментов, активаторов и ингибиторов в качестве лекарственных средств.
Например: протеолитические

ферменты: пепсин, трипсин, химотрипсин и их смеси.


































































 Половое размножение
Половое размножение Нервная система
Нервная система Обмен веществ. Питание. Пищеварение
Обмен веществ. Питание. Пищеварение Лук-севок
Лук-севок Белки: строение и функции
Белки: строение и функции Рекорды хвойных растений
Рекорды хвойных растений Жизненный цикл у растений и животных
Жизненный цикл у растений и животных Полимеразная цепная реакция
Полимеразная цепная реакция PPT Energy-1
PPT Energy-1 Биосфера
Биосфера Презентация на тему Физиологические адаптации (9 класс)
Презентация на тему Физиологические адаптации (9 класс)  Презентация на тему СПОСОБНОСТИ МОЗГА
Презентация на тему СПОСОБНОСТИ МОЗГА  Обмен веществ и энергии в организме
Обмен веществ и энергии в организме Жизнедеятельность организмов. Размножение растений
Жизнедеятельность организмов. Размножение растений Эмбриология нервной системы
Эмбриология нервной системы Подражание Форма научения
Подражание Форма научения Строение и виды нейронов. Рефлекс, рефлекторная дуга
Строение и виды нейронов. Рефлекс, рефлекторная дуга Пищевые добавки и их влияние на организм человека Подготовила Коновалова Ольга
Пищевые добавки и их влияние на организм человека Подготовила Коновалова Ольга  Презентация на тему Мир динозавров
Презентация на тему Мир динозавров  ПЦР как основа геномных методик. Занятие №2
ПЦР как основа геномных методик. Занятие №2 Строение и функции кожи
Строение и функции кожи Собаки. Хаски
Собаки. Хаски Презентация на тему Дыхание и здоровье человека
Презентация на тему Дыхание и здоровье человека  Опасные насекомые - иксодовые клещи. Подготовил: Начальник отдела развития медицинской помощи детям и службы родовспоможения Ку
Опасные насекомые - иксодовые клещи. Подготовил: Начальник отдела развития медицинской помощи детям и службы родовспоможения Ку Природа Aлтайского края
Природа Aлтайского края Наследственная изменчивость
Наследственная изменчивость Pathogenesis of bacteria and viruses
Pathogenesis of bacteria and viruses Значение деления клетки для роста, развития и размножения клетки и организма в целом. Механизм митоза
Значение деления клетки для роста, развития и размножения клетки и организма в целом. Механизм митоза