Содержание
- 2. ФЕРМЕНТЫ (энзимы) - это высокоспецифичные белки, выполняющие функции биологических катализаторов. Катализатор - это вещество, которое ускоряет
- 3. Ферменты могут быть простыми или сложными белками. Если фермент - сложный белок, то его небелковую часть
- 4. Роль ионов металлов: Zn2+, Mg2+, Fe2+, Cu2+ и т.д. Механизмы участия ионов металлов в ферментативных реакциях
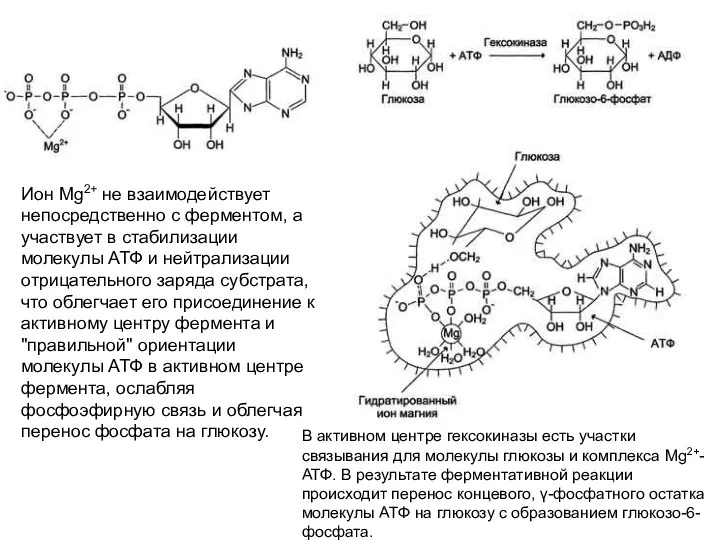
- 5. Ион Mg2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного
- 6. Поскольку ферменты - белковые молекулы, следовательно, они обладают всеми свойствами, характерными для белков. В то же
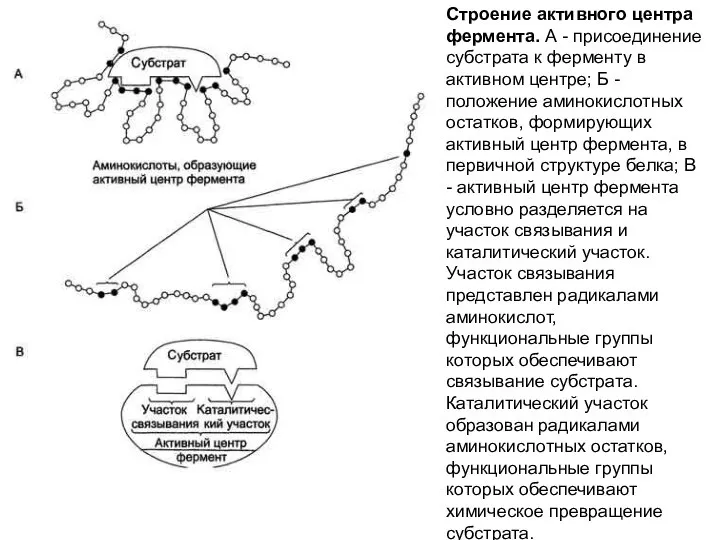
- 7. Активный центр ферментов - это определенный участок белковой молекулы, способный комплементарно связываться с субстратом и обеспечивающий
- 8. Строение активного центра фермента. А - присоединение субстрата к ферменту в активном центре; Б - положение
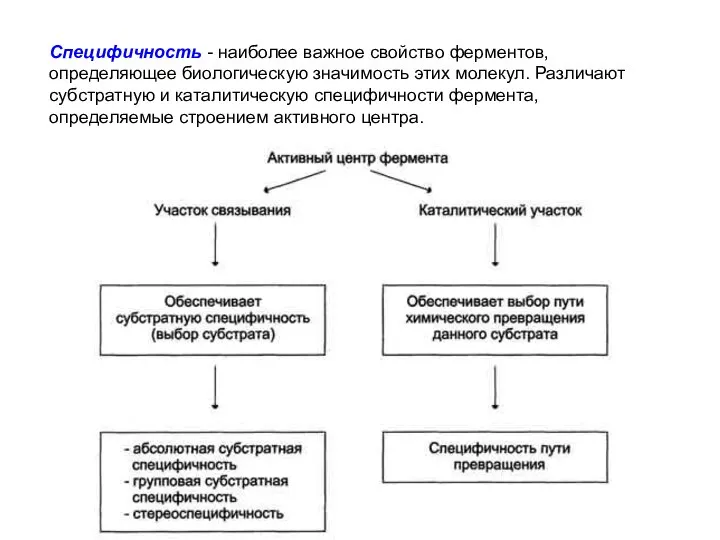
- 9. Специфичность - наиболее важное свойство ферментов, определяющее биологическую значимость этих молекул. Различают субстратную и каталитическую специфичности
- 10. Субстратная специфичность Под субстратной специфичностью понимают способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными
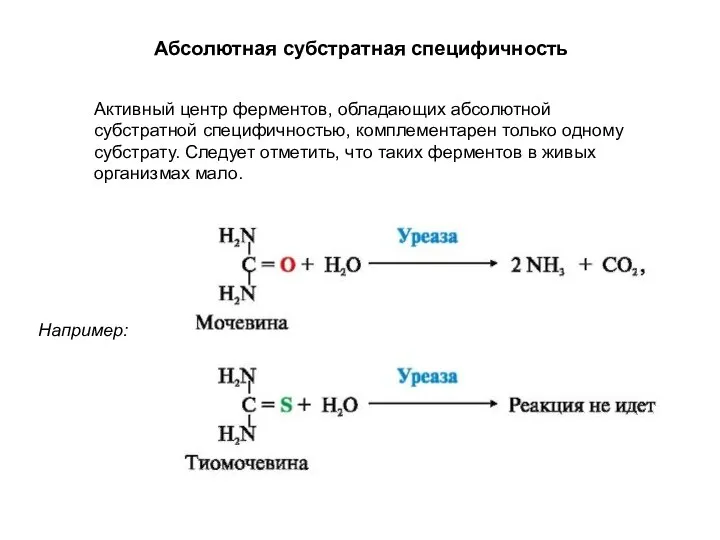
- 11. Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Следует отметить, что таких ферментов
- 12. Групповая субстратная специфичность Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов. Например:
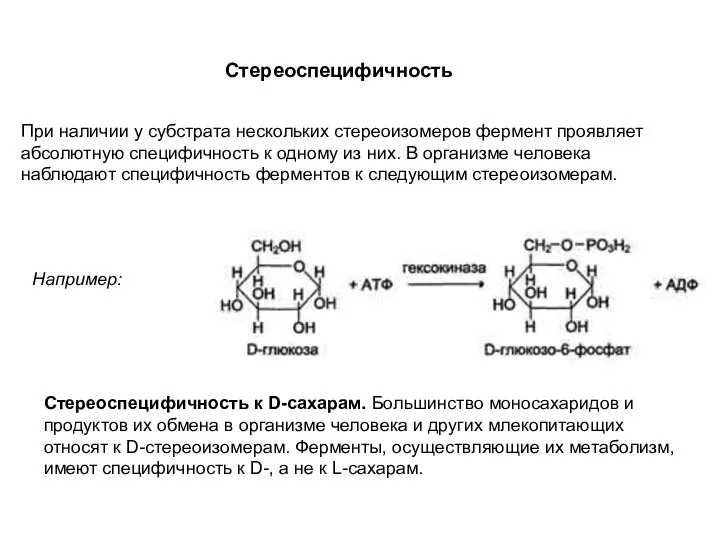
- 13. Стереоспецифичность При наличии у субстрата нескольких стереоизомеров фермент проявляет абсолютную специфичность к одному из них. В
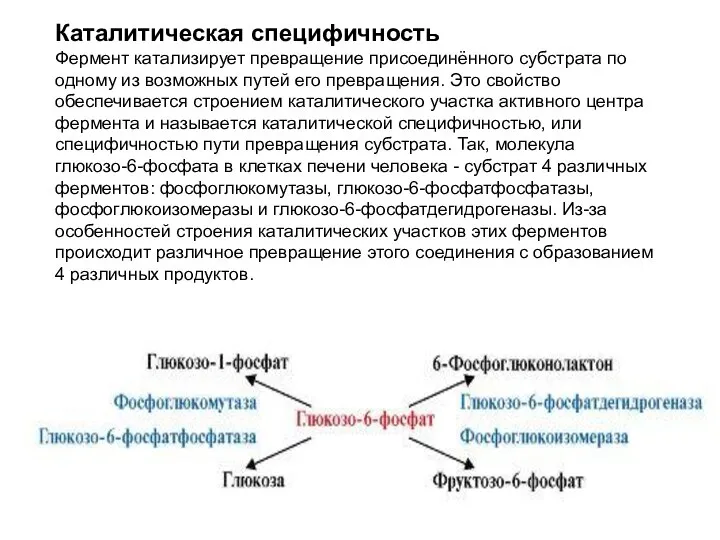
- 14. Каталитическая специфичность Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения. Это свойство
- 15. Для ферментов характерны: • специфичность. • каталитическая эффективность. Большинство катализируемых ферментами реакций высокоэффективны, они протекают в
- 16. • Активность ферментов может регулироваться. Действие ферментов в клетке, как правило, строго упорядочено: продукт одной ферментативной
- 17. ОСОБЕННОСТИ ФЕРМЕНТАТИВНОГО КАТАЛИЗА
- 18. Условия, необходимы для химического взаимодействия молекул, чтобы произошла химическая реакция: 1) Молекулы должны сблизиться (столкнуться). Но
- 19. При достижении этого энергетического барьера в молекуле происходят изменения, вызывающие перераспределение химических связей и образование новых
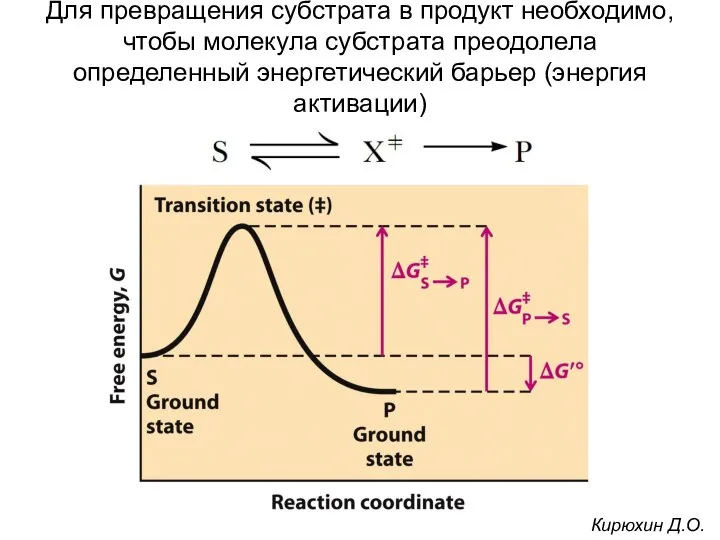
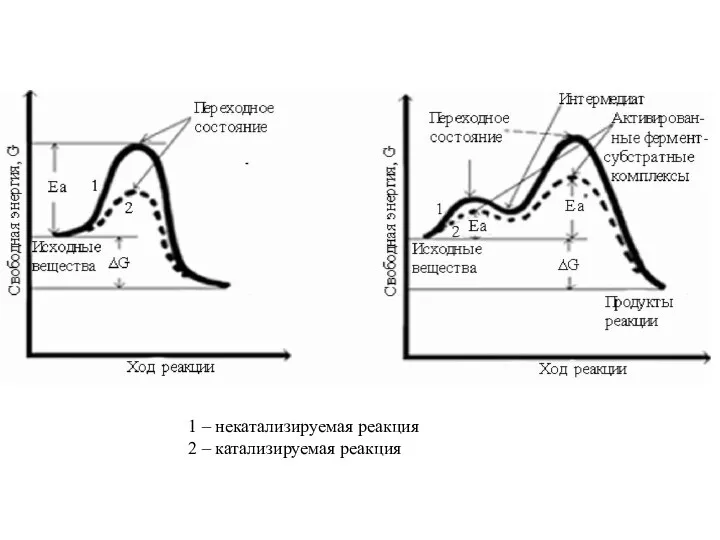
- 20. Для превращения субстрата в продукт необходимо, чтобы молекула субстрата преодолела определенный энергетический барьер (энергия активации) Кирюхин
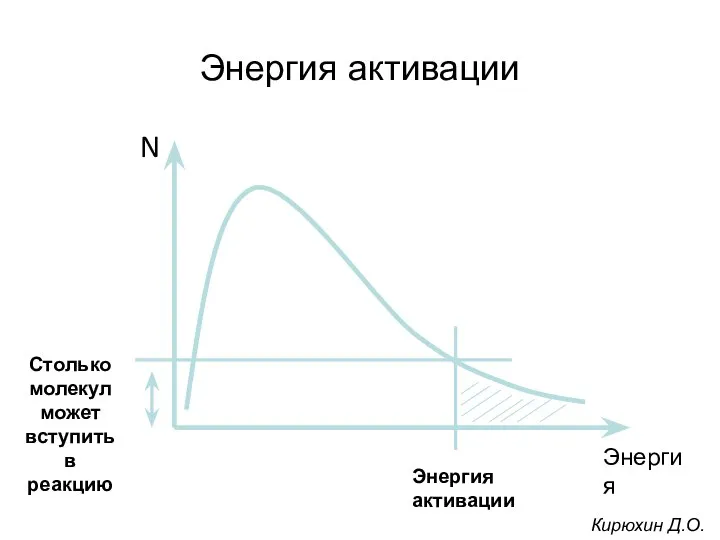
- 21. Чем больше молекул обладает энергией, превышающей уровень Еа, тем выше скорость химической реакции. Повысить скорость химической
- 22. Энергия активации Кирюхин Д.О.
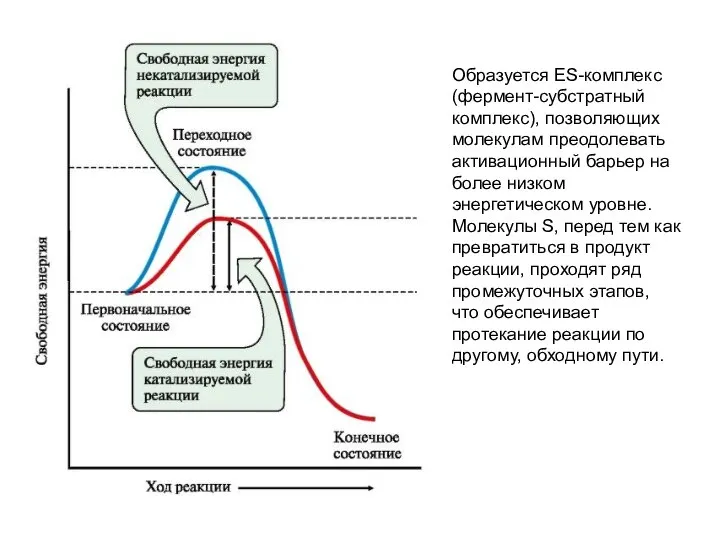
- 23. Образуется ES-комплекс (фермент-субстратный комплекс), позволяющих молекулам преодолевать активационный барьер на более низком энергетическом уровне. Молекулы S,
- 24. • На первом этапе фермент взаимодействует с субстратом с образованием нового соединения - ES E +
- 25. Иначе говоря, катализатор открывает новый, дополнительный путь превращения исходных веществ в продукты реакции через такие состояния,
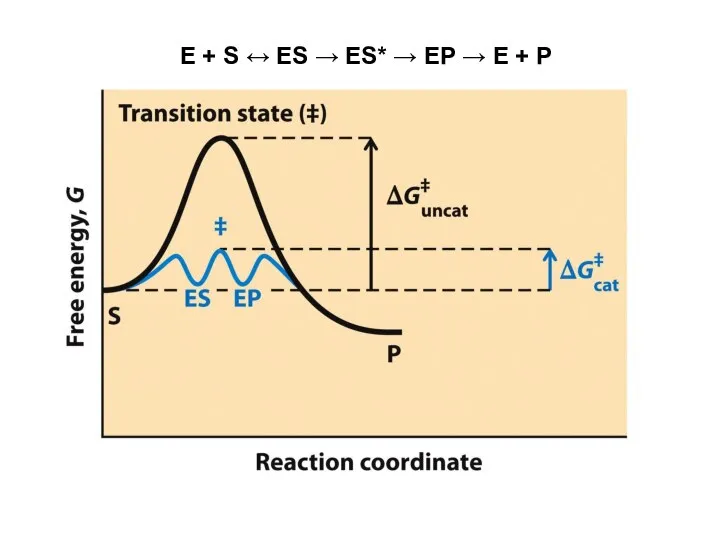
- 26. E + S ↔ ES → ES* → EP → E + P
- 27. 1 – некатализируемая реакция 2 – катализируемая реакция
- 28. ЭНЕРГЕТИЧЕСКИЙ ИТОГ РЕАКЦИИ - разность между энергетическим уровнем исходных веществ (субстратов) и энергетическим уровнем продуктов реакции,
- 29. Теории узнавания ферментом субстрата
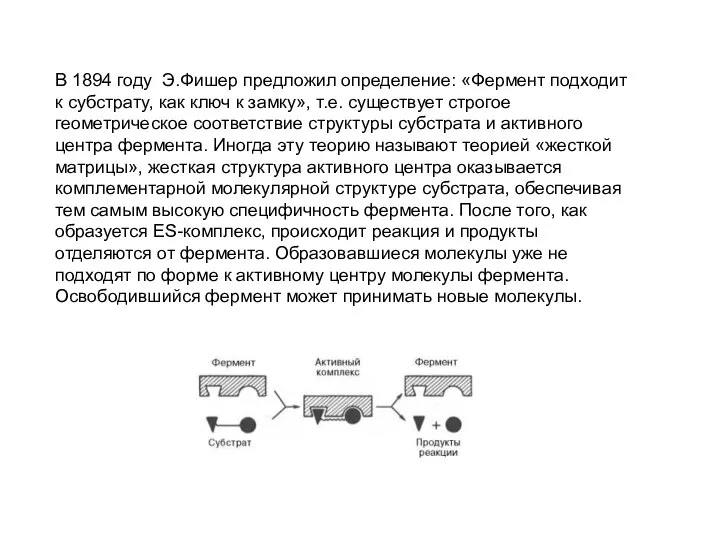
- 30. В 1894 году Э.Фишер предложил определение: «Фермент подходит к субстрату, как ключ к замку», т.е. существует
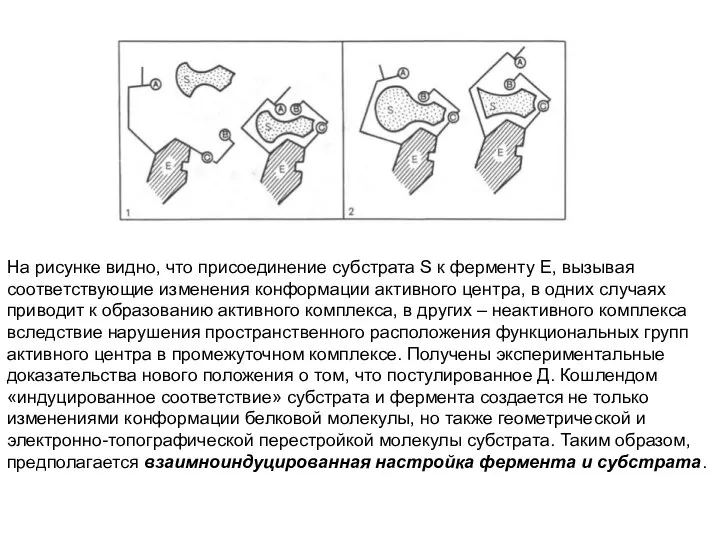
- 31. В противоположность модели Э. Фишера Д. Кошлендом в 50-е годы 20 века была разработана теория «индуцированного
- 32. На рисунке видно, что присоединение субстрата S к ферменту Е, вызывая соответствующие изменения конформации активного центра,
- 33. КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- 34. Кинетика ферментативных реакций - это раздел энзимологии, изучающий зависимость скорости химических реакций, катализируемых ферментами, от химической
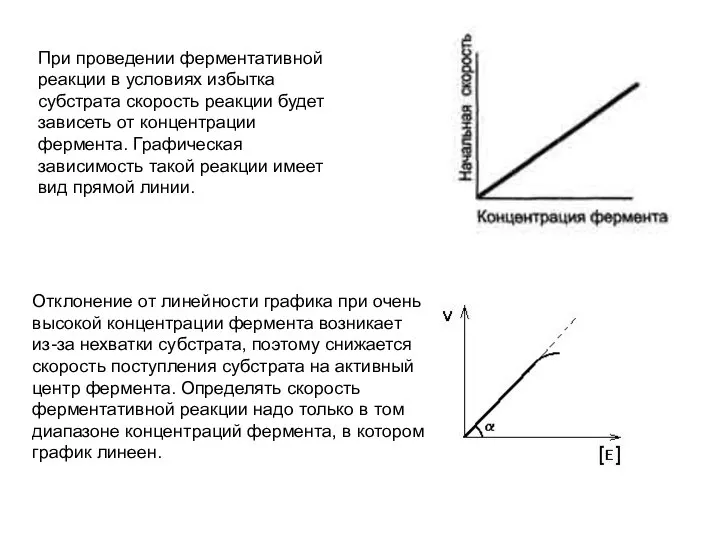
- 35. При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента. Графическая
- 36. Количество фермента часто невозможно определить в абсолютных величинах, поэтому о количестве ферментов судят по скорости катализируемой
- 37. Для выражения концентрации фермента и количественной оценки его активности в условных единицах Комиссией по ферментам Международного
- 38. В медицине активность ферментов выражают чаще всего в единицах активности на 1 л биологической жидкости либо
- 39. В простейшем случае ферментативную реакцию можно представить как двухстадийный процесс. Зависимость скорости реакции v от концентрации
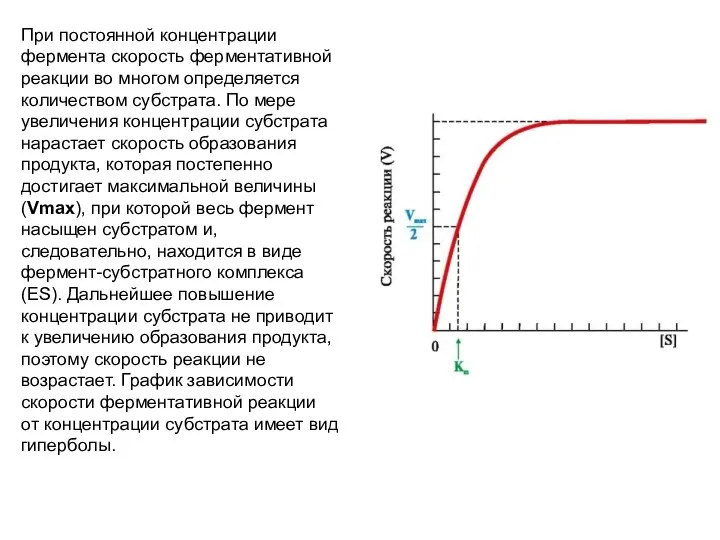
- 40. При постоянной концентрации фермента скорость ферментативной реакции во многом определяется количеством субстрата. По мере увеличения концентрации
- 41. Когда половина молекул фермента находится в комплексе с молекулами субстрата, скорость реакции равна 1/2 Vmax. Концентрация
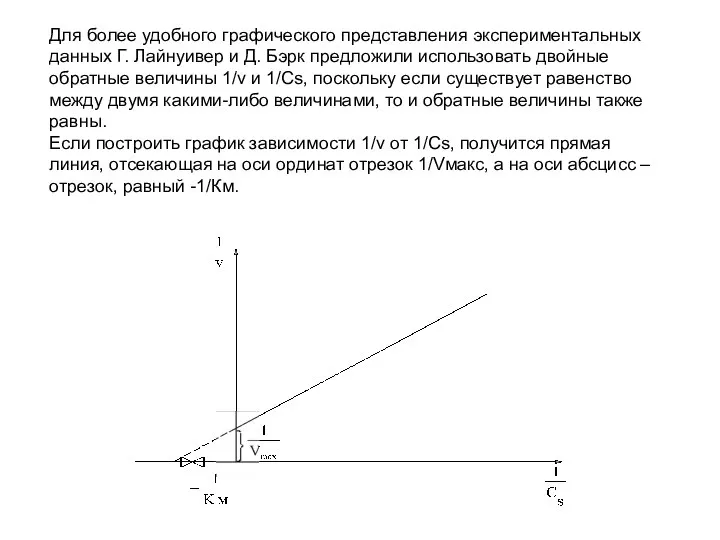
- 42. Для более удобного графического представления экспериментальных данных Г. Лайнуивер и Д. Бэрк предложили использовать двойные обратные
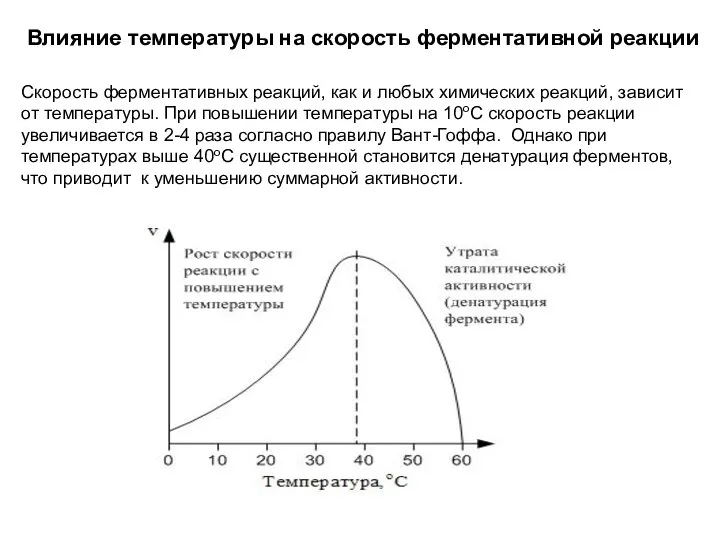
- 43. Влияние температуры на скорость ферментативной реакции Скорость ферментативных реакций, как и любых химических реакций, зависит от
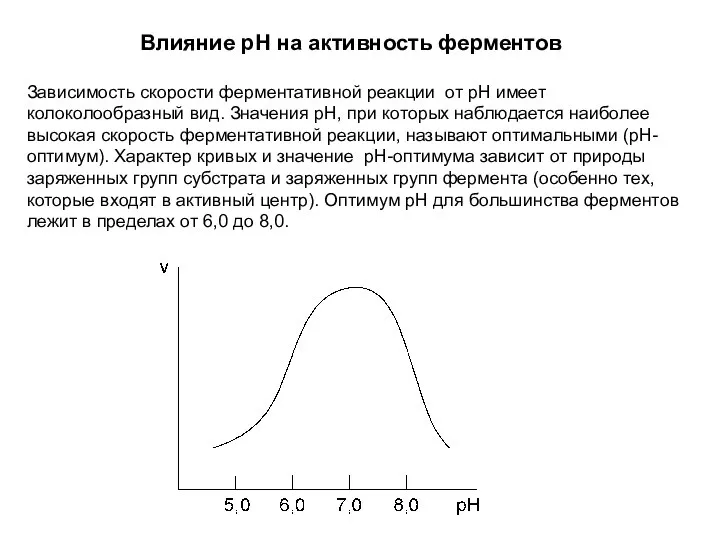
- 44. Влияние pH на активность ферментов Зависимость скорости ферментативной реакции от рН имеет колоколообразный вид. Значения рН,
- 46. Отклонение рН среды от оптимального вызывает изменение: - ионизации функциональных групп фермента, а иногда и субстрата;
- 48. Скачать презентацию



























 Клетка - структурная единица. Соматические и половые клетки
Клетка - структурная единица. Соматические и половые клетки Анатомия. Страницы истории
Анатомия. Страницы истории Пищеварение в ротовой полости
Пищеварение в ротовой полости Естественные методы защиты растений
Естественные методы защиты растений Презентация на тему Память
Презентация на тему Память  Козлов Н.А. Общая гистология. Ткани домашних млекопитающих животных. 2004
Козлов Н.А. Общая гистология. Ткани домашних млекопитающих животных. 2004 Ауыспалы ылғалды мәңгі жасыл ормандар
Ауыспалы ылғалды мәңгі жасыл ормандар Адаптации. Возникновение приспособлений
Адаптации. Возникновение приспособлений Презентация на тему Клонирование за и против
Презентация на тему Клонирование за и против  Оплодотворение и развитие организма
Оплодотворение и развитие организма Анатомо-физиологические особенности органов мочеобразования и мочевыделения. Выделительные структуры и органы человека
Анатомо-физиологические особенности органов мочеобразования и мочевыделения. Выделительные структуры и органы человека Зоркий глаз
Зоркий глаз Высшие споровые растения. 5 класс
Высшие споровые растения. 5 класс Презентация по теме Органы дыхания
Презентация по теме Органы дыхания Биология - совокупность наук о живой природе
Биология - совокупность наук о живой природе Презентация на тему АМЁБА
Презентация на тему АМЁБА  Гипнопедия – методика обучения во сне
Гипнопедия – методика обучения во сне Книги для студентов из фонда отдела обслуживания научной библиотеки Аграрного института
Книги для студентов из фонда отдела обслуживания научной библиотеки Аграрного института Подготовка к олимпиаде. Биологические процессы и технологии
Подготовка к олимпиаде. Биологические процессы и технологии Презентация на тему РОГАТЫЕ НАСЕКОМЫЕ
Презентация на тему РОГАТЫЕ НАСЕКОМЫЕ  Хохлатка
Хохлатка 3649078f5ff1412197eed22690b56479
3649078f5ff1412197eed22690b56479 Разнообразие внешнего строения бактериальных клеток
Разнообразие внешнего строения бактериальных клеток Динозавры. Пермский период
Динозавры. Пермский период Осенняя жигалка - Stomoxys calcitran
Осенняя жигалка - Stomoxys calcitran Основы геоботаники (фитоценологии). Экосистема. Биогеоценоз (лекция 1)
Основы геоботаники (фитоценологии). Экосистема. Биогеоценоз (лекция 1) Картофель. Табак
Картофель. Табак призентация по биологии500832462pptx (1)
призентация по биологии500832462pptx (1)