Содержание
- 2. ФЕРМЕНТЫ МОДИФИКАЦИИ ДНК Ферменты модификации ДНК в настоящее время научились синтезировать искусственно и применять для воздействия
- 3. ЛИГАЗЫ ДНК-лигазы вирусов, бактерий, млекопитающих соединяют 5'-фосфатную и З'-гидроксильную группы нуклеотидов, находящихся на противоположных концах одноцепочечного
- 4. ФОСФАТАЗЫ Это фермент гидролаза, отщепляющая фосфат от нуклеотидов, белков и алкалоидов. Наиболее часто щелочная фосфатаза применяется
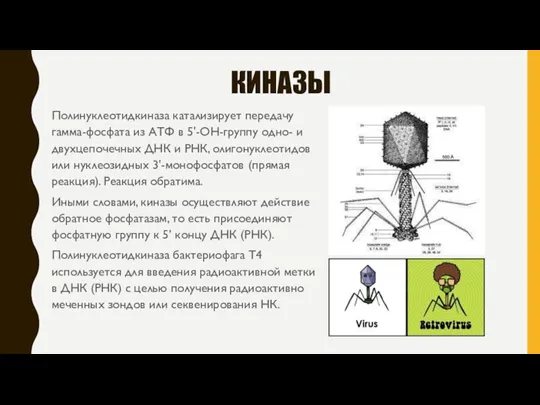
- 5. КИНАЗЫ Полинуклеотидкиназа катализирует передачу гамма-фосфата из АТФ в 5'-ОН-группу одно- и двухцепочечных ДНК и РНК, олигонуклеотидов
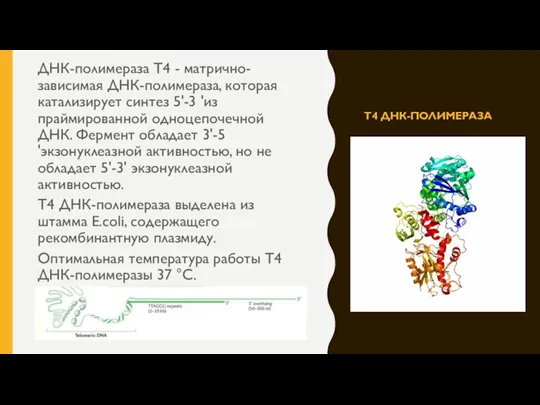
- 6. Т4 ДНК-ПОЛИМЕРАЗА ДНК-полимераза T4 - матрично-зависимая ДНК-полимераза, которая катализирует синтез 5'-3 'из праймированной одноцепочечной ДНК. Фермент
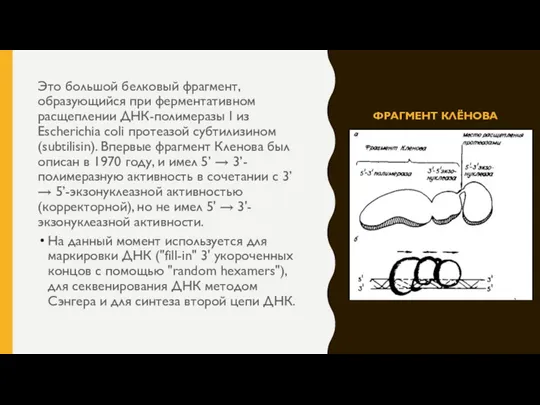
- 7. ФРАГМЕНТ КЛЁНОВА Это большой белковый фрагмент, образующийся при ферментативном расщеплении ДНК-полимеразы I из Escherichia coli протеазой
- 9. Скачать презентацию



 Чудесное превращение гусеницы в бабочку
Чудесное превращение гусеницы в бабочку Создание фитохитодезов, сопутствующие наблюдения и выводы
Создание фитохитодезов, сопутствующие наблюдения и выводы Мутации
Мутации Поєднання знімків Sentinel-2 і даних повидільної таксації для дешифрування деревного запасу лісових насаджень
Поєднання знімків Sentinel-2 і даних повидільної таксації для дешифрування деревного запасу лісових насаджень Эволюционизм
Эволюционизм Презентация на тему Русская школа генетики
Презентация на тему Русская школа генетики  Онтогенез, морфология и физиология слухового анализатора
Онтогенез, морфология и физиология слухового анализатора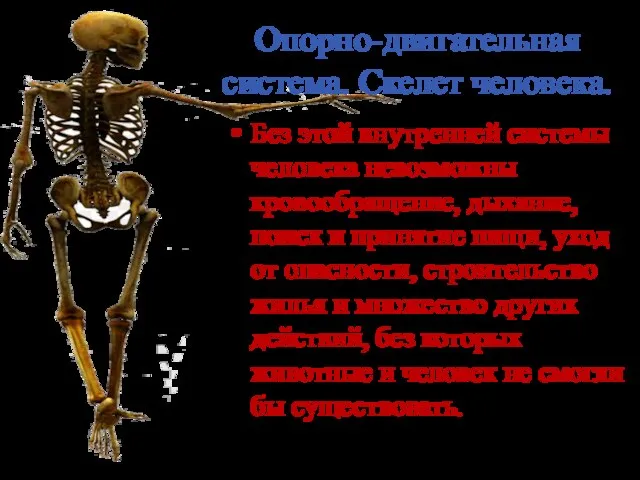 Опорно-двигательная система. Скелет человека
Опорно-двигательная система. Скелет человека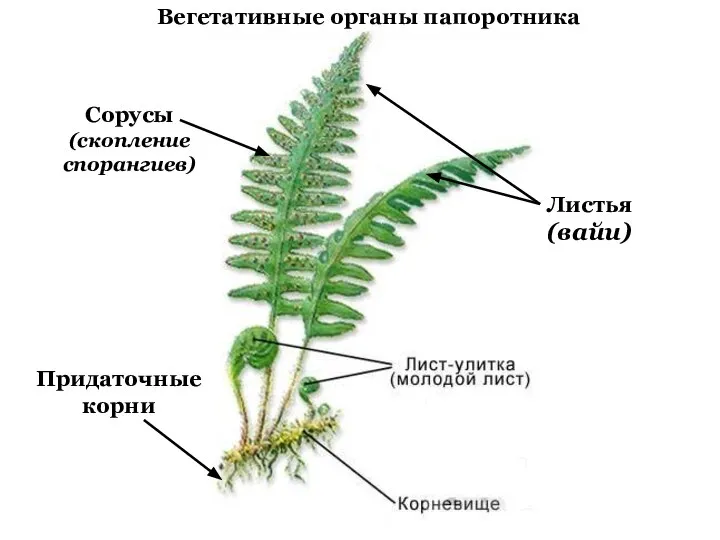 Вегетативные органы папоротника и хвоща
Вегетативные органы папоротника и хвоща Tang xiaoming
Tang xiaoming Связочный аппарат матки и ее придатков
Связочный аппарат матки и ее придатков Строение органа слуха. Гигиена органа слуха. 8 класс
Строение органа слуха. Гигиена органа слуха. 8 класс Журавли
Журавли Грибы – космополиты
Грибы – космополиты Любимая порода собак
Любимая порода собак Блоттинг
Блоттинг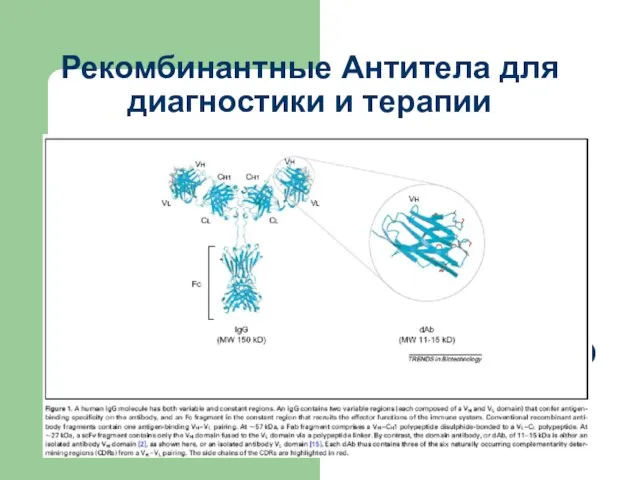 Recombinant antibodies for diagnosis and therapy
Recombinant antibodies for diagnosis and therapy Легенда о морошке
Легенда о морошке Животное рысь
Животное рысь Вестибулярный анализатор
Вестибулярный анализатор Паспорта комнатных растений
Паспорта комнатных растений Класс Земноводные - Амфибии
Класс Земноводные - Амфибии Домашнее животное
Домашнее животное Пептидные гормоны растений
Пептидные гормоны растений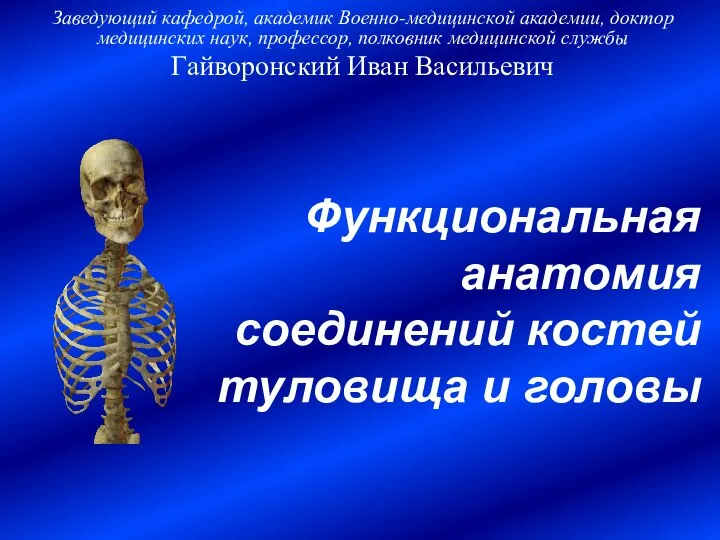 Л.6 - ФА соединения костей туловища и головы
Л.6 - ФА соединения костей туловища и головы Решение задач. Моногибридное
Решение задач. Моногибридное Функции крови
Функции крови Значение грибов в круговороте веществ в природе
Значение грибов в круговороте веществ в природе